複数分子イメージング研究チーム Multiple Molecular Imaging Research Laboratory
マルチトレーサーとは?
はじめに
放射性同位元素 (RI) を利用した研究は、広範な分野において応用研究が展開され、基礎から臨床応用まで含めて多くの成果が報告されています。生体における必須微量元素や環境中から曝露されるさまざまな元素に関する研究において、RIはきわめて有用なツールです。わが国におけるトレーサー技術の利用は、1950年代ころから使用されるようになり、医学、薬学、生物学、農学、栄養学、環境科学などの広範な応用研究に用いるようになってきました。これらの研究は、RIを使用しない他の手法に比べて、極めて感度が高い点が特筆すべきことです。RIトレーサー法は担体を含まないか、極微量のRIと同じ元素の安定同位体を含んでいます。またRIを用いてラベルした化合物を用いて研究する場合も元から、またはラベルしていない物質や化合物と化学的にもほぼ同等であり、代謝バランスや生理的状態に影響をほとんど与えることなく、ダイナミクスを反映しています。
ここでは生体微量元素研究のツールとして用いられているRIトレーサー法について概説し、マルチトレーサー法(多元素同時代謝追跡法)とそれらの測定法についても触れてみましょう。
RIトレーサー法と特徴
RIトレーサー法とは、前述のように放射性物質の検出感度が極めて大きいことを利用し、その系における物質の移動や分布、化学反応の過程などを調べる手法です。その特徴は、極微量(トレーサー量)で検出可能であり、また試料または検体によっては非破壊かつ、リアルタイム計測が可能です。
この手法の医学、生物学の応用分野は、動物や植物実験にRI標識化合物を用いて、生理機能や代謝過程を調べたり、オートラジオグラフィーやイメージングアナライザーにより、各種臓器、組織や細胞内小器官における標識化合物や元素の分布を調べるなどの利用が多くあります。その他、in vitro検査で行われているラジオイムノアッセイ法もRIトレーサー法の原理を利用しているものであり、核医学診断で行われている各種シンチグラフィ、SPECT (Single Photon Emission Computer Tomography) およびPET (Positron Emission Tomography) なども広い意味でのRIトレーサー法の応用といえます。
RIトレーサーの使用と法的規制
RIトレーサー法は非密封RI(自分で密封したものではなく、JIS規格に従い、密封RIとして販売、製造されているもの以外はすべて非密封RIである)の使用であり、わが国では放射線障害防止法の規制対象となるため使用許可が必要であり、本法令の基準に準拠した設備、施設および管理の元で行う必要があります。一方、医療機関などでは同じRIであっても、医薬品として取り扱われる放射性医薬品があるが、法律上は放射線障害防止法の規制対象に含まれず、薬事法上の規制対象となっています。しかし、これも化学的にはRIであり、その取り扱いは厳重に管理されています。諸外国におけるトレーサー利用状況もわが国とほとんど変わらないが、わが国の規制に比較して合理的であるため、その利用は多様で盛んです。諸外国の場合、極微量の放射能に対しては、規制が緩和されており、その利用および廃棄物の合理的な取り扱いが行われており、使用しやすいものです。わが国においてもRI利用技術の正しい理解が進み安全でかつ合理的な考え方が普及し、利用環境が整備されてゆけば、RI利用研究の優位性を生かした利用が期待できます。
放射線とその計測
放射線は、X線、γ線などの電磁波およびα線、β線、中性子線等の粒子線の総称です。この放射線は、原子核反応や原子核壊変により発生するものと、原子のエネルギー準位の変化によって発生するものとがあります。いずれの放射線も直接あるいは間接的に物質中の原子や分子を電離(電離作用)するが、物質によっては発光(蛍光作用)させたり、化学変化を惹起する。放射線はヒトの五感では認知できないので感じないので、放射線の測定には電離作用を利用した電離箱、GM計数管および半導体検出器、蛍光作用を利用したシンチレーション検出器、イメージングアナライザーなどが用いられます。
核医学領域ではPETやSPECTなどが用いられるが、これもまたγ線計測機器に分類できます。診断を目的として、体内に投与された放射性核種またはその化合物が放出するγ線を被検体に対し固定した検出器で測定し、その体内分布や臓器内分布を記録し、画像情報を提供する装置です。昨今、PETにおいては、18Fでラベルしたフルオロデオキシグルコースを用いた脳機能診断やがんの早期発見などが盛んに利用され、次世代型PETの開発やPETとCTやMRIの組み合わせによる複合機の開発、臨床応用が進んでいます。また、SPECTもコリメーターを用いないコンプトンカメラを利用した複数核種同時ガンマ線イメージング装置 (γ-ray Emsiion Imaging GREI) の開発も進められており(1)、これらの核医学診断装置が分子イメージングを含めた画像化技術の革新的進歩と基礎研究にもたらす恩恵も期待されます。
マルチトレーサー法
マルチトレーサー法は、1991年に理化学研究所の安部文敏らによって考案されました(2)。これは理化学研究所のリングサイクロトロンで加速される重イオンの多様性とそのエネルギー領域での核反応の特徴を生かし、多数の元素についてその化学的、生物学的挙動の同時追跡を可能にする新しいトレーサー技術であり、マルチトレーサー法と命名されました。1994年榎本秀一らは、動物における微量元素研究にマルチトレーサー法が有効であることを予測し、微量元素の生体内挙動に関する知見と従来の研究成果の比較をすることから研究をスタートした。現在まで生物、医学、化学、環境科学など多くの研究分野でマルチトレーサー法を用いた応用研究がなされています。詳細は榎本の総説などをご参照してください。
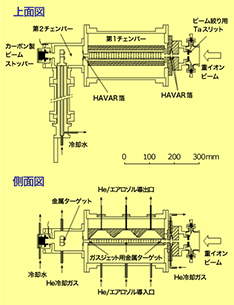
この後、榎本秀一と羽場宏光らは、マルチトレーサー製造技術を高度化し、高効率化と製造オンライン化も行ないました(3)。現在、理研加速器施設に設置されているマルチトレーサー製造ラインの模式図を図1に示します。近年、原子炉を利用した核分裂生成物を用いたFissionマルチトレーサーも京都大学原子炉研究所の柴田誠一らによって実用化され、環境科学分野の応用研究が推進されています(4)。
マルチトレーサー法は、同時に製造した多数の元素のRIを用いることにより、多数の元素についてその物理的、化学的、生物学的挙動の同時追跡を可能にする新しいトレーサー技術です。RIトレーサーは、これまで単独で、あるいは、ごく少数のトレーサーを組合わせて使われてきました。しかし、半導体検出器と電子計算機の普及で、γ線放出体については、多数のRIからのγ線を同時に測定し、データ処理によって個々のRIを定量することが容易になりました。RIはそれぞれ固有のエネルギーのγ線(多くの場合複数)を放出しますが、高純度Ge半導体検出器を使うと、これらのγ線スペクトルを高分解能で測定できます。多数のRIが共存する場合、スペクトル線の一部は重なり合うが、既存のプログラムで解析することができます。
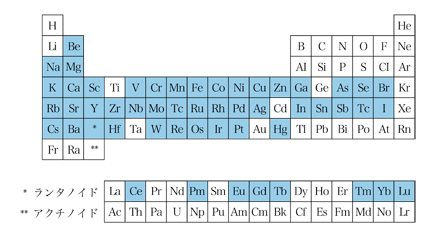
理研リングサイクロトロンはTaまでのイオンを加速する性能をもつ重イオン加速器で、C、N、Oなどのイオンは核子(原子核中の陽子と中性子)1個当たり135MeVにまで加速することができます。このような高エネルギーの重イオンで照射を行うと、ターゲット中の原子核と加速されたイオンの核の接触した部分が互いに破砕される核破砕反応 (Nuclear Fragmentation) と呼ばれる反応が起きます。そして、両方の核の残った部分は、多くの場合不安定な核、すなわち放射性の核となるわけです。このとき、ターゲット核と加速イオンの核の接触の仕方は様々なので、多様な放射性核種が生成し、その多くはγ線放出体です。この核反応を利用してマルチトレーサーを製造します。ターゲットとしては、Au、Ag、Tiなどを繁用しており、ターゲット中にはターゲット物質に応じて、多数の元素のRIが生成するので、その中のγ線放出体を利用します。一般には、ターゲットより原子番号の少ないすべての元素の原子核ができ、これまでに製造されたマルチトレーサーにγ線放出体が含まれる元素を図2の周期表上に示しました。Tl以上の元素については今後の課題であり、Sb以下で白抜きのままに残っているのは主として適当な半減期のγ線放出体のない元素です。重イオンの照射後、ターゲットを酸に溶解し、担体であるターゲット物質を化学的に除去(たとえば、Auをターゲットとした場合、王水に溶解して乾固した後、塩酸溶液として酢酸エチルでAuを抽出)すれば、多数の元素のRIを含むマルチトレーサー溶液が得られます。これらのRIは、いわゆる無担体の状態、すなわち各RIの安定同位体をほとんど含まない状態で得られます。また、化学分離操作を工夫することで、分離操作に由来する塩(たとえばNaCl)を含まない状態で得ることもできます。このようにして得られたマルチトレーサーは、そのまま、あるいは必要に応じてさらに群分離を行ってグループトレーサーとし、種々の系について多数の元素の物理的、化学的、生物学的挙動の同時追跡に用いています。マルチトレーサー中に含まれる多数のRIの個々の定量は、試料のγ線スペクトルを高純度Ge半導体検出器で測定し、得られるスペクトルを計算機処理して行います。昨今は、マルチトレーサーでスクリーニングしてめぼしをつけた興味深い振る舞いの元素をAVFサイクロトロンでシングルトレーサーとして製造し、それを用いて詳細な研究が進められるケースも多くなってきました。また、前述したGREIはマルチトレーサーのような複数核種の同時非破壊イメージングにも応用できるので、その装置の開発は、マルチトレーサーの研究にとっても有用となることが期待されています。
マルチトレーサー法の特長
マルチトレーサー法には実用上どのような特長があるのでしょうか?いうまでもなく、第一は高能率化です。すなわち、l回の実験で十数種から数十種の元素について情報が得られ、このことは一つの量的革新です。その波及効果の一つとして、これまでトレーサーの利用が考えられなかった新しい対象への適用が考えられます。たとえば、ある系で一定の挙動を示す元素を探したいとします。従来のトレーサー法では一つ一つの元素についてRIトレーサーを入手し、つぎつぎと実験してゆかなければならない状況でした。これに対してマルチトレーサーを利用すれば、1回の実験で目的を果たすことができるのです。もう一つ大切なことは、これらの情報が完全に同一の条件下で得られることです。多数の元素の挙動を比較する場合、これまでのシングルトレーサー法では、個々の元素について別々に実験して得られたデータをもとに議論されてきました。多くの場合、別々のグループにより報告されたデータが集められ、考察の基礎とされてきました。しかし、これは多くの場合かなり問題であり、特に、試料差、個体差の大きい地球環境試料や生体については、マルチトレーサー法によって、同時に完全に同一の条件下で多数の元素についてデータが得られることは、それらの相互比較においてきわめて重要で、これは質的革新といってもいいでしょう。前述したように、マルチトレーサー法では、RIが無担体で得られることも大きな特徴です。RIの放出する放射線は高い感度で検出できることから、トレーサーとして使用する際には、pgのオーダーで十分です。しかし、原子炉から得られるRIは、ある量の安定同位体(担体)と共存するため、使用する元素の量自体はこれよりはるかに多くなります。AsやHgのように毒性の強い元素を正常な個体に投与して追跡しようとするとき、これは大きな問題です。この点、マルチトレーサー法では、RIだけを投与できるため、投与量が微量ですみ、毒性をほとんど無視することができるのです。逆に、担体が含まれるほうが好ましい実験では、これを加えることは容易です。また、マルチトレーサーは意外な発見の可能性、いわゆるセレンディピティーをもっています。多くの元素について、"情報が得られてしまう"ため、必ずしも意図していなかった元素について予想もしなかった新しい事実が見つかる可能性があるのです。これは、個々に入手したRIを自分で混ぜたのでは起こりえないことです。さらに、マルチトレーサーは現在でも50種類を超える元素に適用可能で、今後その数はさらに増加してゆくはずであるが、すでに、シングルトレーサーとしても貴重な28Mgや47Caなどを含んでいます。28Mgは実用性のあるMgのトレーサーとしては唯一のものであるが、一般には供給されていません。Caのトレーサーとしては45Caが広く使われているが、このRIはほとんどγ線を放出せず、やっかいなβ線測定をしなければなりません(β線はγ線に比べて透過力がずっと弱く、たとえば試料を可溶化処理して液体シンチレーターに溶解して測定する必要あり)。これに対して47Caはγ線放出体であるので、多くの実験できわめて有利です。
参考文献
- Lowe, N., Jackson, M., eds., Advances in Isotope Methods for the Analysis of Trace Elements in Man, CRC Press, Washington, D. C., 2001.
- Ambe, F., Ambe, S., Enomoto, S., Tracer Technique, In: Vertes, A., Nagy, S., Klencsar, Z., eds., Chemical Applications of Nuclear Reaction and Radiation, Kluwer Academic Publishers, London, 443-474, 2003.
- Vertes, A., Nagy, S., Klencsar, Z., eds., Radiochemistry and Radiopharmaceutical Chemistry in Life Sciences, Kluwer Academic Publishers, London, 2003.
- 榎本秀一, 多元素同時分析法としてのマルチトレーサー法とその応用研究およびRIビームファクトリー計画における新展開, Radioisotopes, 52, 631-647, (2003).
- Nayak D., Multitracer techniques: applications in chemical and life sciences, Appl. Radiat. Isotopes, 54, 195-202, (2001).
引用文献
- Yang, Y. F., Gono, Y., Motomura, S., Enomoto, S., Yano, Y., A Compton camera for multitracer imaging, IEEE T. Nucl., Sci., 48, 656-661, (2001).
- Ambe, S., Chen, S. Y., Ohkubo, Y., Kobayashi, Y., Iwamoto, M., Yanokura, M., Ambe F., Preparation of radioactive multitracer solution from gold foil irradiated by 135 MeV/nucleon 14N ions, Chem. Lett., 20, 149-152, (1991).
- Haba, H., Kaji, D., Kanayama, Y., Igarashi, K., Enomoto, S., Development of a gas-jet-coupled multitarget system for multitracer production, Radiochim. Acta, 93, 1-4, (2005).
- Shibata, S., Takamiya, K., Ichihara, T., Sasaki, T., Separation of radionuclides in a multitracer prepared by thermal neutron fission of 235U, Appl. Radiation Isotopes, 60, 625-628, (2004).