2009年7月22日
独立行政法人 理化学研究所
RNAを12色でライトアップ、リアルタイム観察を実現
-マルチカラーを使って、生きた細胞のRNAイメージング確立へ-
ポイント
- 目的配列を持つ核酸(DNAやRNA)だけに結合し、光る人工核酸を開発
- 色素会合体特有の励起子相互作用で、ライトアップを自在にON、OFF
- 生きた細胞中の複数のRNAの挙動を、長時間にわたって同時観察
要旨
独立行政法人理化学研究所(野依良治理事長)は、特定の配列を持つ核酸(DNAやRNA)を認識、結合した場合に限り蛍光を放つ人工核酸を開発し、生きた細胞中のRNAの振る舞いを観察することに成功しました。理研基幹研究所岡本独立主幹研究ユニットの岡本晃充独立主幹研究員らによる研究成果です。
細胞機能を知るために、これまで数多くの蛍光タンパク質が開発されてきました。これらの蛍光タンパク質は、観察したい細胞内分子と融合し、その分子の生きた細胞内での挙動を蛍光の信号として表すことで、細胞内のさまざまな生命現象の解明に貢献してきました。しかし、蛍光タンパク質は分子サイズが小さいRNAなどの核酸の染色には向いていません。研究チームは、励起子相互作用※1という色素会合体特有の機能を持つ有機蛍光分子に着目し、その機能を含む人工核酸を開発しました。この人工核酸は、特定の配列を持つ核酸を認識、結合した場合に限り蛍光を発し、一本鎖DNAやメッセンジャーRNAだけでなく、約20塩基長しかないマイクロRNAの蛍光検出にも有効です。人工核酸は、標的核酸への結合の有無に応じて、蛍光分子の励起子相互作用のスイッチングが制御され、明瞭で可逆的な蛍光のオン・オフを得ることができます。また、標的とする核酸配列を自由に選んで人工核酸を設計、作製することができる上、複数の蛍光色を活用することが可能なことから、複数の核酸の挙動を同時観察できます。研究チームは、青色から赤色まで蛍光12色の人工核酸を作製し、この蛍光システムを活用して、ヒト子宮頸がん由来の培養細胞の中にあるRNAの挙動のリアルタイム観察に成功しました。さらに、緑や黄、赤などの蛍光を発する複数の蛍光分子を使って、複数のRNAの同時観察も実現しました。
この研究成果は、試験管内での核酸の解析に有用であるばかりでなく、細胞の分化など細胞機能を決める役割を持つとされるRNAの挙動を、生きた細胞を使って観察することができるため、幅広い分野への波及効果が期待されます。
本研究成果は、ドイツの科学雑誌『Angewandte Chemie International Edition』オンライン版(7月22日付け:日本時間7月23日)に掲載されます。
背景
タンパク質の蛍光標識は、緑色蛍光タンパク(GFP)をはじめとする蛍光タンパク質と、観察対象のタンパク質とを融合したタンパク質を作製することで得られます。この蛍光標識のシステムを活用することで、標的のタンパク質が細胞の中でどのような機能を持つかを知ることができます。一方、タンパク質と共に細胞の分化や分裂などの生命現象を支える重要な分子であるRNAは、タンパク質と違い、それ自身が可視光領域の蛍光を発することができません。このため、観察しようとする標的のRNAに特異的に結合して蛍光を発する蛍光色素を、外から加える必要があります。しかし、細胞に内在するRNAに対して、効率的に蛍光標識する方法は限られています。RNAは、さまざまな配列・機能を持つだけでなく、構造的にもそれぞれユニークな塩基長や高次構造を有しているので、どのRNAにも共通に活用できる蛍光標識のシステムを確立することは容易ではありません。特にサイズの小さいマイクロRNA(約20~25塩基長)の蛍光標識は困難でした。さらに、光りっ放しの蛍光標識は、余剰分子を洗浄除去できない生きた細胞内でのライブセルRNAイメージングの際、高いバックグラウンド蛍光(観察対象RNA以外からの蛍光)の要因になり、大きな問題となります。そこで、観察したいRNAを認識、結合したときだけ光る(結合が外れたときには消える)蛍光色素を開発することができると、バックグラウンド蛍光を抑制することができ、発現したRNAを効果的に定量することが可能となります。さらに、長時間にわたって維持可能な蛍光であれば、それだけ長い間RNAの挙動を観察でき、複数の蛍光色を活用することで、複数のRNAの挙動を同時に観察することが可能になります。
研究手法
研究チームは、色素会合体が示す励起子相互作用に着目し、有機分子色素を設計しました。チアシアニン型蛍光色素の1つチアゾールオレンジ※2は、2個を平行に重ねると励起子相互作用を示し、本来発するはずの蛍光が消えてしまいます。研究チームは、この色素2個を平行に重ね、1つのヌクレオチドに結合した新たな人工核酸を作製しました(図1)。通常、この人工核酸は励起子相互作用が働いて蛍光発光を抑制していますが(図1左上左)、一本鎖DNAやRNAと結合すると、2個の色素が核酸二本鎖構造の別の場所に入り込み物理的に離れることで、色素間の励起子相互作用が解除されます(図1左上右)。その結果、強い蛍光を発するようになります(図1写真)。この励起子相互作用を示すチアゾールオレンジを含む12種類の色素(蛍光波長450~700nm)を使って、色素各2個を平行に重ねて1つのヌクレオチドに結合した12色の人工核酸を作製しました(図2)。
研究成果
研究チームが作製した人工核酸は、標的になる核酸(DNAやRNA)配列を認識、結合して二本鎖を作ると、速やかに蛍光発光を示しました。蛍光強度が標的核酸の量に比例して増減するので、標的核酸を定量することができます。作製した12色の人工核酸すべてで核酸認識に伴う蛍光発光を観察できましたが、特にその中の8色が、RNA検出において明瞭な蛍光のオン・オフを示しました。吸収スペクトルおよび蛍光発光スペクトルの変化を測定した結果、いずれの人工核酸でも、標的RNAとの結合によって色素間の励起子相互作用のスイッチングが効果的に制御されていることを確認しました(図3)。これらの人工核酸は、リポフェクション法※3でもマイクロインジェクション法※4でも効率的に生きた細胞に取り込ませることが可能です。細胞内で、人工核酸が細胞内RNAに結合して蛍光が「オン」になり、その結合を阻害する競争的核酸を導入すると「オフ」になることも観察することができました。
研究チームは、緑、黄、赤色の3種の蛍光色でそれぞれ標識した人工核酸群を使って、生きたヒト子宮頸がん由来の培養細胞内に人工的に導入した複数のマイクロRNAの挙動をリアルタイムで同時に観察することにも成功しました(図4)。マルチチャンネルスペクトル検出器で細胞内からの蛍光スペクトルを観察すると、試験管内で観察される蛍光スペクトルと良い一致を示しており、各蛍光色が人工核酸由来であることを確認しました。
また、この人工核酸を使って長時間の細胞やRNA機能の観察が可能になりました。人工核酸の構造をDNA骨格から2'-O-メチルRNA骨格に変換すると、変換したRNA骨格が細胞内の核酸分解酵素の働きから免れ、分解されずに長時間にわたって存在することができたためです。通常は、核酸分解酵素でRNAが分解され、人工核酸からの蛍光が失われていきますが、この骨格変換により24時間後でも人工核酸からの蛍光を十分維持できるようになりました。
今後の期待
今回の研究成果は、試験管内での核酸解析に有用であるだけでなく、細胞が生きた状態でRNAの挙動を観察するライブセルRNAイメージングなど、大きな注目を集めている研究分野への波及効果が期待できます。RNAは、細胞の分化など細胞機能を決める重要な役割を持つといわれていますが、詳細な機能は謎のままです。ライブセルRNAイメージングは、格段の進歩を遂げた蛍光タンパク質によるタンパク質のライブセルイメージングと比べ、まだ未成熟な段階にあります。今回開発した人工核酸が、謎に満ちたRNAの機能を解明する牽引役となることが期待されます。
発表者
理化学研究所
基幹研究所 岡本独立主幹研究ユニット
独立主幹研究員 岡本 晃充(おかもと あきみつ)
Tel: 048-467-9238 / Fax: 048-467-9205
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.励起子相互作用
蛍光色素のいくつかで、複数の分子が集合して平行型会合体(H会合体)を形成すると消光を示す現象。これは、色素の双極子の配向に基づく励起軌道の分裂に起因する。H会合体の場合は、分裂した励起軌道のうち上位が許容遷移、下位が禁制遷移になる。色素は、上位軌道へのみ励起されるので、吸収スペクトルの短波長移動が観察される。その励起状態は、エネルギー的に安定な下位軌道へ速やかに遷移した後、そこから基底状態へ戻ろうとする。しかし、その過程は蛍光を伴わない放熱系であるので、蛍光発光は生じない。 - 2.チアゾールオレンジ
DNA結合発光性蛍光色素の1つ。ベンゾチアゾールとキノリンをメチンで連結した構造を有する。複数のチアゾールオレンジが集合して平行型会合体(H会合体)を形成すると励起子相互作用を示して消光する。 - 3.リポフェクション法
陽性荷電脂質が形成するリポソームが、陰性荷電の核酸との間に静電的な相互作用をすることによって得られる核酸-脂質複合体を使って、エンドサイトーシスを経由して細胞内へ核酸を取り込む方法。 - 4.マイクロインジェクション法
極細のガラスのキャピラリを細胞に挿すことにより、直接的に核酸を細胞内部へ注入する方法。
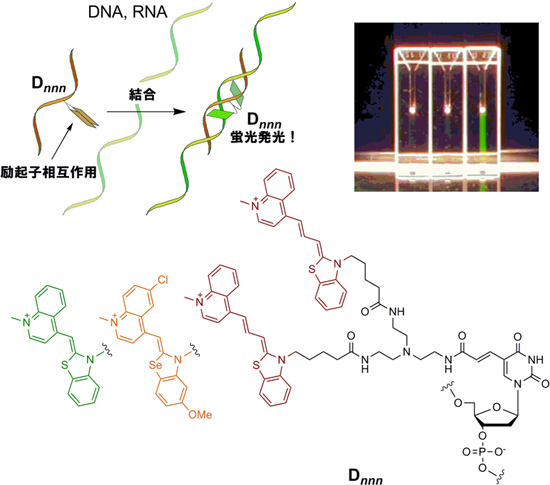
図1 標的の核酸と結合すると蛍光発光する人工核酸
デオキシウリジンから伸長した枝分かれリンカーの末端に2分子の色素を連結した。色素からの蛍光は、色素間の励起子相互作用により制御される。右上写真は、人工核酸を含む溶液にそれぞれ、水(左)、相補的でないDNA(中央)、相補的なDNA(右)を加え、白熱灯からの光を照射した様子である。右のガラス容器だけが目視により判別できる緑色蛍光を示した。
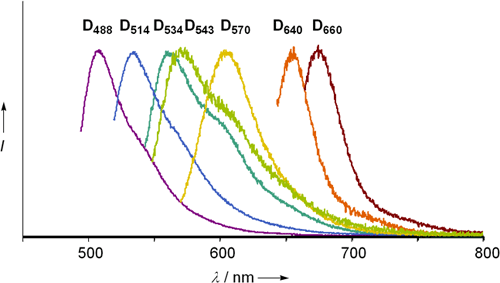
図2 マルチカラーの例
作製した人工核酸の中からピックアップした7種類の異なる色を持つ人工核酸の蛍光スペクトル。
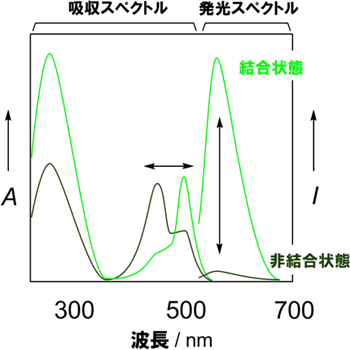
図3 吸収スペクトルと蛍光発光スペクトルの変化
人工核酸だけの状態を濃い緑色線、標的核酸とのハイブリッド状態を明るい緑色線で示す。
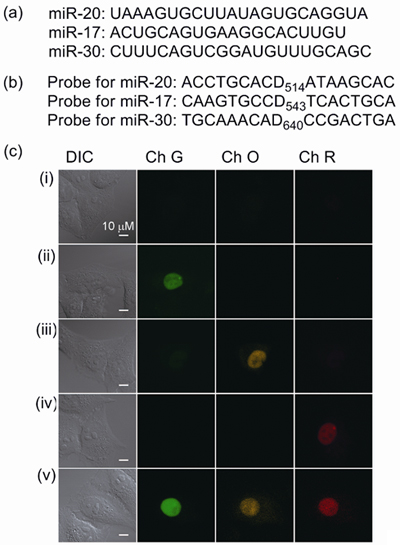
図4 細胞内RNAのマルチカラーライブセルイメージング
(a)細胞に人工的に導入した3種類のマイクロRNA。
(b)混合溶液として細胞へマイクロインジェクションした、異なる標的を認識する3種類の蛍光色の人工核酸。
(c)(a)のマイクロRNAを導入した各細胞の核に、(b)の3種類の人工核酸をマイクロインジェクションした。何色の蛍光を発しているかを観察することによって、その細胞が持つマイクロRNAの種類を識別することができる。(i)コントロールの細胞、(ii)miR-20を多く含む細胞、(iii)miR-17を多く含む細胞、(iv)miR-30を多く含む細胞、(v)miR-17,20,30の3種類すべてを多く含む細胞。
