2009年11月23日
独立行政法人 理化学研究所
細胞間を連結する細胞膜ナノチューブの形成因子「M-Sec」を発見
-遠隔にある細胞間を連結し、素早く確実に情報伝達するシステム解明に貢献-
ポイント
- M-Secにより突起が伸長し、細胞膜ナノチューブを形成する分子メカニズムを解明
- M-Secと細胞質のタンパク質との相互作用が細胞膜ナノチューブ形成に必須
- 新たな抗エイズ薬などとして、M-Secによる膜チューブ形成の阻害をターゲットに
要旨
独立行政法人理化学研究所(野依良治理事長)は、免疫系細胞で特に強く発現する「M-Sec」というタンパク質を同定し、このM-Secが、細胞間を連結して情報伝達を担う細胞膜ナノチューブ※1の形成因子であることを世界で初めて証明しました。免疫・アレルギー科学総合研究センター(谷口克センター長)免疫系構築研究チームの大野博司チームリーダー、長谷耕二研究員らと、横浜市立大学大学院生命ナノシステム科学研究科、米国アイオワ大学との共同研究※2による成果です。
マクロファージ※3や樹状細胞※3などの免疫系細胞には、細胞膜ナノチューブと呼ばれる細胞膜でできたチューブ構造が遠隔にある2つの細胞同士を物理的に連結し、細胞内シグナルやタンパク質を受け渡して素早く確実に情報伝達することを可能にする性質があります。しかし、この細胞膜ナノチューブを形成するメカニズムは不明でした。
研究グループは、マクロファージや樹状細胞で強く発現するタンパク質「M-Sec」を同定し、細胞膜ナノチューブの形成因子であることを発見しました。さらに、さまざまな細胞機能の調節に重要な役割を果たす低分子量GTPase※4の1つRal※4や、Exocyst※5と呼ばれる細胞質のタンパク質複合体がM-Secと相互作用して、この細胞膜ナノチューブの形成に関与することも観察しました。
エイズウイルス(HIV-1)※6などのウイルスやウイルスの病原タンパク質は、この細胞膜ナノチューブの存在を逆手に取り、チューブを“ハイジャック”したり、チューブ形成を促進することで、細胞から細胞へと移動して感染を広げたり、細胞機能を阻害して病態を悪化させたりすることも知られています。このため、M-Secを標的として、このチューブ形成を抑える薬剤を開発することができると、エイズによる免疫抑制を阻止する新たな抗エイズウイルスの薬の候補になり得ると期待できます。
本研究成果は、英国の科学雑誌『Nature Cell Biology』オンライン版(11月22日付け:日本時間11月23日)に掲載されます。
背景
マクロファージや樹状細胞といった免疫系の細胞には、細胞膜が細長く伸びた細胞膜の細いチューブ(細胞膜ナノチューブ)を伸ばして、遠隔にある2つの細胞を物理的に連結してカルシウムシグナルなどの細胞内シグナルを伝えたり、遠隔の細胞間でタンパク質を素早く確実にやりとりして情報交換を可能にする、という現象が知られています。このハイウェイのような機能を持つチューブの存在を逆手に取り、エイズウイルス(HIV-1)などのウイルスやウイルスの病原タンパク質が、このチューブを“ハイジャック”して、細胞から細胞へと移動することで感染を増悪させたり、細胞機能を阻害して病態を悪化させたりすることも知られています。しかし、この細胞膜ナノチューブを形成するメカニズムは分かっていませんでした。
研究手法と成果
研究グループは、今回、マクロファージや樹状細胞に特に強く発現する遺伝子をマウスで同定し、M-Sec遺伝子と命名しました。M-Sec遺伝子を持たないヒト子宮頸(けい)がん由来のがん細胞の一種であるHeLa細胞に、M-Sec遺伝子を外部から導入すると、まず細胞突起が発達し、次に細胞膜ナノチューブが形成され(図1A)、このチューブを介してカルシウムシグナルの伝達が起こることが分かりました(図1B)。さらに、マクロファージの細胞株からRNAi法※7によりM-Sec遺伝子の発現を抑えると、正常状態では形成しているナノチューブの形成が強く阻害され、それに伴いカルシウムシグナルの伝達も見られなくなりました(図2)。これらの結果は、M-Sec遺伝子の発現が、細胞膜ナノチューブの形成に必要であること、すなわち、M-Secがナノチューブの形成因子であることを示します。
次に、M-Secがどのような分子メカニズムで、細胞膜ナノチューブの形成を制御しているかを調べました。ナノチューブの形成にはアクチン細胞骨格系※8が関与することが知られていたので、この系の制御にかかわるとされている低分子量GTPaseについて調べました。具体的には、M-Sec遺伝子を持たないHeLa細胞に、M-Sec遺伝子とともにRal、Rac、Cdc42、Rhoの各GTPaseの遺伝子を導入し、細胞内でGTPaseとM-Secが同じ場所に存在(共局在)するかを蛍光免疫染色法により検討しました。また、それぞれのGTPaseの抑制変異体をHeLa細胞に発現させることで、M-Secによる細胞膜ナノチューブ形成が抑制されるかを調べました。その結果、M-SecはGTPaseの1つであるRalと相互作用することや、M-Secによるナノチューブの形成にはRalの活性化が必要であることを示唆できました。さらに、Ralと相互作用することが知られているExocyst複合体も、M-Secによるナノチューブの形成に関与することが分かりました(図3)。
今後の期待
エイズウイルスなどをはじめとする複数のウイルスは、細胞膜ナノチューブを利用して、細胞から細胞へと感染することが知られています。さらに最近、エイズウイルスに感染したマクロファージから、本来エイズウイルスには感染しないとされるBリンパ球※9に、Nef※10という免疫抑制活性を持つエイズウイルスタンパク質が細胞膜ナノチューブを介して移行することで、Bリンパ球の抗体産生が抑えられ、エイズの免疫不全が進行することが報告されました(Xu et al., Nature Immunology 10: 1008-1017, 2009)。 このため、M-Secを標的とする細胞膜ナノチューブ形成阻害薬は、新たな抗エイズ薬や抗ウイルス薬として機能することが期待できます。現在、研究グループを中心に、細胞膜ナノチューブ形成阻害薬の開発を新たな研究目標に定め、研究を開始しました。今後、分子メカニズムの解明に基づいた創薬に向けて貢献していきます。
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
免疫系構築研究チーム
チームリーダー 大野 博司(おおの ひろし)
Tel: 045-503-7031 / Fax: 045-503-7030
お問い合わせ先
横浜研究推進部 企画課Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.細胞膜ナノチューブ
免疫系の細胞や神経細胞は、その細胞膜を細長いチューブ状に伸長して、遠隔にある細胞の細胞膜と接続することにより、カルシウムシグナルなどの細胞内シグナルや、細胞内タンパク質などを直接受け渡すことで、素早く確実な情報伝達を行うことができる。細胞間情報伝達の仕組みの1つと考えられ、トンネリング ナノチューブ(tunneling nanotube)とも呼ばれる。 - 2.共同研究
理研RCAI(木村俊介、高津宏之、大前ますみ、河野早弥賀、北村浩、渡会浩志)、理研RCAI/横浜市立大学大学院生命ナノシステム科学研究科(伊藤誠)、アイオワ大学(Clayton Hazalett, Charles Yeaman)の研究者各氏。 - 3.マクロファージ、樹状細胞
白血球の一種であり骨髄で作られる。細菌などの異物を貪食し、消化分解して、得られた抗原ペプチドをTリンパ球に提示して活性化することで、獲得免疫応答を誘導する。マクロファージは貪食能が非常に強いのに対し、樹状細胞はTリンパ球の活性化能が強い。 - 4.低分子量GTPase、Ral
三量体Gタンパク質との対比からこのように呼ばれる、分子量20~30kDa(キロダルトン)の単量体のグアノシン三リン酸(GTP)加水分解酵素活性を持つタンパク質。GDPと結合した不活性型とGTPと結合した活性型の2つの状態の間をサイクルすることで、分子スイッチとして働く。哺乳動物ではRas(約20種)、Rho(約15種)、Ran(1種)、Rab(約60種)、Arf(約20種)の5つのファミリーに大別されるスーパーファミリーを構成する。アクチン細胞骨格を制御する低分子量GTAaseとしてはRasファミリーに属するRalや、Rhoファミリーに属するRho, Rac, cdc42が知られている。 - 5.Exocyst
8つのサブユニットからなるタンパク質複合体で、ゴルジ体由来の輸送小胞の細胞膜への結合・融合を制御することにより、細胞膜の突起やひだの形成、上皮細胞における極性輸送に関与する。Rab、Rho、Ralの低分子量GTPaseにより制御される。 - 6.エイズウイルス(HIV-1)
human immunoceficiency virus-1の略。エイズ(後天性免疫不全症候群、AIDS; acquired immune Deficiency syndrome)の原因ウイルス。 - 7.RNAi法
RNA interferenceの略。2本鎖RNAと相補的な塩基配列を持つmRNAが分解される現象を利用して、人工的に2本鎖RNAを細胞に導入することにより、導入した2本鎖RNAと相補的な配列を持つ任意の遺伝子の発現を抑制する方法。 - 8.アクチン細胞骨格系
微小管とともに細胞の形態形成・維持に働く。粒状のアクチンモノマーが重合してアクチン線維を形成することにより、細胞の形態の維持・変化や細胞の運動に働く。 - 9.Bリンパ球
生体防御に重要な役割を果たしているリンパ球の一種。体に侵入してきた異物を認識して、それらを排除するためのタンパク質である抗体を作りだす。 - 10.Nef
HIV-1の複製の初期に合成されるウイルスタンパク質。エイズの発症や、それに伴う免疫不全にかかわる。
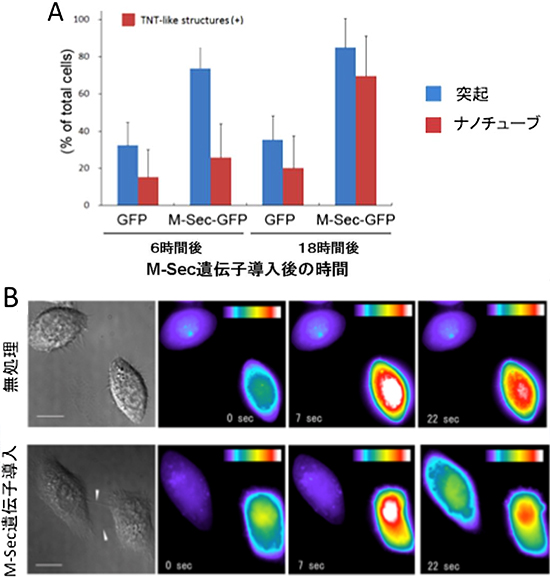
図1 M-Sec遺伝子を導入したHeLa細胞に見られる細胞膜ナノチューブ形成と細胞間カルシウムシグナル伝達
A:M-Secを持たない細胞に、緑色蛍光タンパク質(GFP)単独、またはM-SecとGFPの融合タンパク質(M-Sec-GFP)を遺伝子導入し、6時間後、18時間後に細胞膜突起および細胞膜ナノチューブを形成する細胞の割合を数えた。M-Sec-GFPを導入した細胞ではGFPのみを導入した細胞と比較して、まず細胞膜突起(青)、次に細胞膜ナノチューブ(赤)の形成が増大していた。
B:無処理の細胞は細胞膜ナノチューブで連結されておらず(上段)、右下の細胞を刺激すると、刺激された細胞はカルシウムシグナルの活性化が見られるが、左上の細胞への伝達は見られない。一方、M-Sec遺伝子導入細胞では細胞膜ナノチューブによる連結が見られ(下段、白い矢頭)、右下の細胞のカルシウム活性化シグナルが、左上の細胞へと伝達されている。
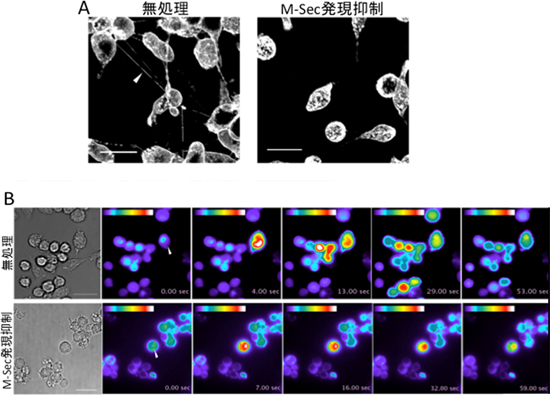
図2 マクロファージ細胞株のM-Sec発現抑制による細胞膜ナノチューブ形成とカルシウムシグナル伝達の阻害
A:無処理のマクロファージ細胞株(左)では細胞膜ナノチューブが細胞間を連結しているのが見られるが(白い矢頭)、M-Secの発現を抑制した細胞(右)では、細胞膜ナノチューブの形成が阻害されている。
B:無処理のマクロファージ細胞株(上段)では、刺激された細胞(白い矢頭)のカルシウムシグナルが周りの細胞へ次々と伝達されるが、M-Secの発現を抑制した細胞(下段)では、刺激された細胞(白い矢頭)だけでカルシウムシグナルが認められ、周りの細胞への伝達は阻害されている。
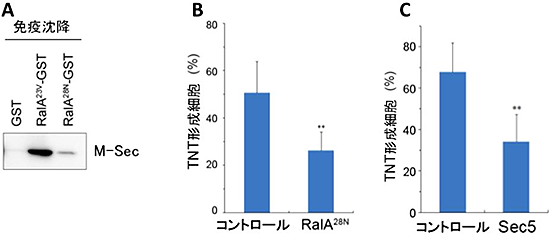
図3 M-Secによる細胞膜ナノチューブ形成のRalとExocyst依存性
A:M-Secは活性型のGTP結合型Ral(RalA23V-GST)とは強く結合するが、不活性型のGDP結合型Ral(RalA28N-GST)とはほとんど結合が見られない。
B:抑制変異体であるGDP結合型Ral(RalA28N)遺伝子を導入して、内在性のRalの活性を抑制した細胞(RalA28N)では、無処置の細胞(コントロール)に比べて、有意に細胞膜ナノチューブの形成が阻害されている。
C:Exocyst複合体のサブユニットの1つであるSec5の発現をRNAi法により抑制した細胞(Sec5)では、無処置の細胞(コントロール)に比べて有意に細胞膜ナノチューブの形成が阻害されている。
