2010年3月23日
独立行政法人 理化学研究所
実験用マウスは飼育舎で進化、ホルモン「メラトニン」を作らず早熟に
-理研が保有する世界中のマウス系統の研究リソースを駆使して発見-
ポイント
- マウスゲノムから、未発見だったメラトニン合成酵素の遺伝子を見つける
- その遺伝子は、特異なゲノム領域(偽常染色体領域)に存在し、変異が起きやすい
- 変異が起きてメラトニンが作れなくなると早く性成熟し、飼育者にとっても有利に
要旨
独立行政法人理化学研究所(野依良治理事長)は、医学や生物学の研究で広く用いられている実験用マウス(ハツカネズミ)から、ホルモン「メラトニン」を合成する酵素の遺伝子を初めて発見しました。飼育舎の中で長年にわたって飼育されてきた過程で、メラトニン合成酵素の遺伝子に突然変異が起きてメラトニンが作れなくなり、その結果、オスのマウスが早く性成熟することが分かりました。つまり、メラトニンが作れないマウスの、早く子孫を残すことができる特性が、飼育者にとっても有利となり、実験用マウスは飼育舎の中で独自の進化※1を遂げたと考えられます。これは、理研脳科学総合研究センター(利根川進センター長)精神疾患動態研究チームの笠原和起副チームリーダー、加藤忠史チームリーダー、理研バイオリソースセンター動物変異動態解析技術開発チームの阿部訓也チームリーダー、実験動物開発室の目加田和之研究員、吉木淳室長による研究成果です。
メラトニンは、脳に存在する松果体という器官から夜になると分泌されるホルモンです。しかし不思議なことに、実験用マウスのほとんどの系統はメラトニンを作ることができません。また、国際的な共同チームによってマウスのゲノム配列はほぼ完全に解読されたと宣言されていますが、メラトニンを合成する酵素(HIOMT※2)の遺伝子はなぜか見つかっていませんでした。今回、文部科学省によるナショナルバイオリソースプロジェクト(NBRP)※3の一環として理研バイオリソースセンターが体系的に収集・保存を行ってきたマウス系統の試料や研究リソースを用い、マウスのHiomt遺伝子を発見し、その結果を基に、多くの実験用マウス系統がメラトニンを作ることができなくなった理由を、ゲノムの構造と生理学的な機能の両面から明らかにしました。
本研究成果は、米国科学アカデミー紀要『Proceedings of the National Academy of Sciences of the United States of America(PNAS)』に掲載されるに先立ち、3月22日の週にオンライン掲載されます。
背景
人類が農耕を始めて以来、人間の生活圏にはマウス(ハツカネズミ)が生息していたと考えられています。そのような野生のマウスを捕獲し、人工の環境下で何世代も交配させてきたものが、現在、世界中の研究者が実験に用いているマウスの由来になっています。一般的な実験用マウスは、記録が残っているだけで百数十年間にわたって飼育されてきました。その結果、実験用マウスは、野生マウスに比べておとなしかったり、毛色がさまざまであったりと、多くの違いが見られます。また、このような簡単に分かる違いだけでなく、発がん性やホルモンの働きなどの生理学的な違いも見つかっています。その一つとして、実験用マウスのほとんどの系統は、ホルモンの一種であるメラトニンを作ることができません。メラトニンは、脳の松果体において夜間に合成分泌されるホルモンで、体内時計や季節性繁殖の調節にかかわっていると考えられています。海外では、メラトニンは時差ぼけや不眠を改善するために用いられています。また最近、メラトニンを模した薬が、抗うつ薬として使用されるようになりました。
メラトニンは、アミノ酸の一つであるトリプトファンから一連の酵素反応によって合成されますが、その最終段階の合成反応をHIOMT酵素が担っています。ヒトや、マウスに近い動物のラット(ドブネズミ)ではHiomt遺伝子が見つかっているにもかかわらず、マウスではまだHiomt遺伝子が見つかっていませんでした。
研究手法と成果
研究グループは、マウスHiomt遺伝子の配列はラットHiomtに似ているはずだと仮定し、公的データベースに登録されているマウスの遺伝情報を詳細に調べました。その結果、マウスHiomt遺伝子の一部ではないかと考えられる配列を見いだし、その配列を手がかりに、分子生物学の手法を駆使してマウスHiomt遺伝子の全配列を明らかにしました。さらに、遺伝子の構造を詳しく調べるために、この遺伝子を含むバクテリア人工染色体(BAC)クローン※4などによって染色体領域の情報を得ようとしました。しかし、一般的に用いられているBACライブラリー※4などにはHiomt遺伝子を含むクローンが見つかりませんでした。そこで、新たな研究リソースとして、熊本大学および理研バイオリースセンター(BRC)で作製したMSM/Ms系統のマウス(MSMマウス※5)のBACライブラリーを検索したところ、Hiomt遺伝子を含むBACクローンを単離することに成功しました。これを基に解析を行い、マウスHiomt遺伝子が、性染色体の偽常染色体領域※6と呼ばれる部分に存在することを発見しました(図1)。この偽常染色体領域は、性染色体の機能や進化を考える上で重要であるにもかかわらず、マウスゲノム解読プロジェクトでまったく解析できなかった部分でした。
マウスの多くの系統でメラトニンが作れなくなった理由を明らかにするために、さまざまな系統のマウスのHiomt遺伝子を調べました。具体的には、文部科学省によるナショナルバイオリソースプロジェクト(NBRP)の一環として理研BRCが収集・保存を行ったマウス系統のサンプルを用い、Hiomt遺伝子の塩基配列を解析しました。その結果、Hiomt遺伝子には、ほかの遺伝子では見られないほどの多様性が見つかり(図2)、偽常染色体領域に存在するためにマウスHiomt遺伝子には突然変異が起こりやすいことが示唆されました。また、一般的な実験用マウスのC57BL/6J系統(B6マウス)などでHIOMTの酵素活性が失われているのは、Hiomt遺伝子の複数の変異により酵素の発現が抑制されているためと判明しました。
次に、MSMマウスとB6マウスを用いて、メラトニンが作れる場合と作れない場合で生理機能にどのような違いがあるかを調べました。MSMマウスは森脇和郎博士(現、理研BRC特別顧問)らが約30年前に日本の野生マウスから樹立した系統で、野生マウスが持つさまざまな特性を現在も保持しており、メラトニンを作ることができます。MSMマウスとB6マウスを交配させて誕生したN2マウスのうち、メラトニンを作れないマウスは、作れるマウスと比較してオスの精巣の発達が早いことを見いだしました(図3A、B)。さらに、遺伝的にメラトニンを作れないICR系統のマウスにメラトニンを投与すると、精巣の発達が抑制されることも分かりました(図3C)。
今後の期待
今回の研究から、(1)マウスHiomt遺伝子は偽常染色体領域に存在するために突然変異が起きやすく、(2)突然変異によってHIOMT酵素の機能が失われてメラトニンを作ることができなくなると性成熟が早くなることが分かりました。
飼育施設という人工環境下では、性成熟が早くなると、次世代をより早く作ることができ、マウスにとっても、飼育者にとっても有利だったと考えられます。一方、野生のマウスには、その理由は明らかではありませんが、生存のためにメラトニンが重要のようです。メラトニンを作ることができなくなった現象は、飼育舎内という特殊な環境における進化であり、今回、そのメカニズムの一端を理研BRCが収集してきたさまざまなマウス系統を調べることによって明らかにしました。今後、一般的な実験用マウス系統を用いたマウスゲノム解読プロジェクトでは解析できていない偽常染色体領域についても、今回単離したBACクローンを利用して研究が進展していくものと思われます。
長い間、人間によって飼われてきた一般的な実験用マウスは、マウス本来の数々の性質を失っています。今後は、新しく樹立されたMSMマウスなどの野生由来系統を利用した医学・生物学の研究や、複数の系統を比較する研究などが、ますます重要になっていくと考えられます。
発表者
理化学研究所
脳科学総合研究センター 精神疾患動態研究チーム
副チームリーダー 笠原 和起(かさはら たかおき)
チームリーダー 加藤 忠史(かとう ただふみ)
Tel: 048-467-6949 / Fax: 048-467-6947
お問い合わせ先
脳科学研究推進部Tel: 048-467-9757 / Fax: 048-462-4914
筑波研究所研究推進部
Tel: 029-836-9136 / Fax: 029-836-9100
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.進化
集団の一部の個体に突然変異が生じ、自然選択あるいは偶然(遺伝的浮動)、もしくはその両方の要因によって、その変異が集団の中に広まり固定化されることをいう。価値概念を含むものではなく、「進歩」という意味はない。すなわち、機能獲得であろうが、機能喪失(退化)であろうが、生物学的には「進化」である。 - 2.HIOMT
Hydroxyindole O-methyltransferase(ヒドロキシインドール O-メチル基転移酵素)の略。現在、この酵素をコードする遺伝子の標準的な名称は、マウスに関しては今回の研究が初めてのため確定していないが、ヒトの場合は ASMT遺伝子( N-acetylserotonin O-methyltransferaseの略)と定められている。 - 3.ナショナルバイオリソースプロジェクト(NBRP)
NBRPは文部科学省によるライフサイエンス研究の基盤を整備するプロジェクト。2002年度からバイオリソース(実験動植物やES細胞など幹細胞などの生物遺伝資源)について収集・保存・提供を実施する拠点の整備を行ってきた。理研は中核的拠点整備プログラムの代表機関として、実験動物マウス(BRC)、ゼブラフィッシュ(脳科学総合研究センター)、遺伝子材料(BRC)などのバイオリソースの整備を担っている。
ナショナルバイオリソースプロジェクト(NBRP)ホームページ - 4.バクテリア人工染色体(BAC)クローン、BACライブラリー
染色体の一部をバクテリア人工染色体(BAC)ベクターに挿入したものをBACクローンといい、それを何万~何十万クローンを集め、ゲノム全体の配列を網羅した集合体をBACライブラリーと呼ぶ。MSMマウスのBACクローンは現在、理研BRC遺伝子材料開発室から提供している。また、理研BRCは一般的な実験用マウス系統であるC57BL/6NのBACライブラリーを作製し、NBRPゲノム情報等整備プログラムにより国立遺伝学研究所と共同でクローン末端配列を決定した。このBACクローンも、同じく遺伝子材料開発室から提供している。
(MSMについて) MSM/Ms mouse BAC clone
(C57BL/6Nについて) C57BL/6N (B6N) mouse BAC clone - 5.MSMマウス
三島市において捕獲された日本産野生マウス( Mus musculus molossinus)に由来する系統で、1978年から国立遺伝学研究所によって飼育されてきた。兄妹交配を繰り返し、近交系として樹立されている。また、SPF化済みである(特定の病原体を持っていない)。現在、国立遺伝学研究所および理研BRCがMSMマウスを分与している。
NIG Mouse - 国立遺伝学研究所ホームページ
RBRC00209 - 理研BRCホームページ - 6.偽常染色体(ぎじょうせんしょくたい)領域
ほ乳類の性染色体であるX染色体とY染色体は、進化の過程でサイズも配列も大きく異なるようになった。しかし、ヒトの性染色体も含め、XとYにはまったく同じ配列の領域が存在し、偽常染色体領域と呼ばれている。この領域はきわめて短いが、精子が形成されるときの減数分裂の際に、XとYの性染色体が正しく対合(二価染色体の形成)するために重要である。また、この領域において性染色体も乗換え(相同組換え)を起こす。理由は不明だが、マウスやラットの仲間は、ほかの生物に比べて偽常染色体領域がさらに短いことが知られている。
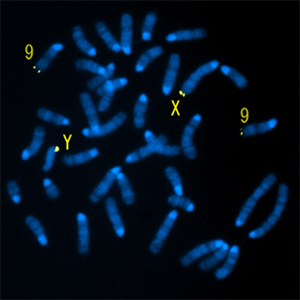
図1 マウスHiomt遺伝子を含むBACクローンを用いたFISH(染色体の蛍光染色)像
X染色体とY染色体のテロメア付近(すなわち偽常染色体領域)に強いシグナルを得た。XとYにおけるシグナル強度は、ほぼ同じである。9番染色体のテロメア付近にも弱くシグナルが検出されたが、偽常染色体領域の一部の配列と相同な配列がこの領域に存在することはすでに知られている。
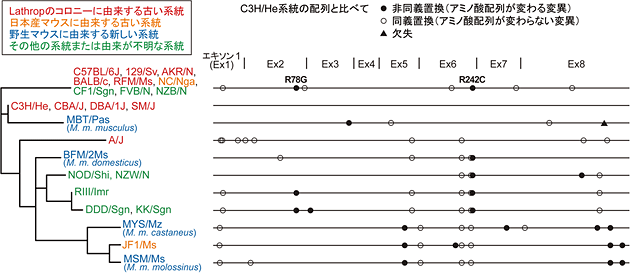
図2 24種類のマウス系統におけるHiomt遺伝子(コード領域)の多型
世界中で一般的に用いられている実験用マウスの多くは、約100年前に米国でマウスのブリーダーをしていたラスロップ女史(Abbie E. C. Lathrop)のマウスに由来する。それ以外にも、世界中には新旧さまざまな系統のマウスが飼育されており、これらのなかから24種類を選んだ。これらのHiomt遺伝子の配列を明らかにし、古い系統のなかで例外的にメラトニンを作ることができるC3H/He系統(上から2番目)と比較して塩基多型を表現した。メラトニンが作れないC57BL/6J系統(B6マウス、1番上)と完璧に同一の配列(アリール)が、由来を異にする多数の系統からも見つかった。左端の分子系統樹は、最尤法で作成した。
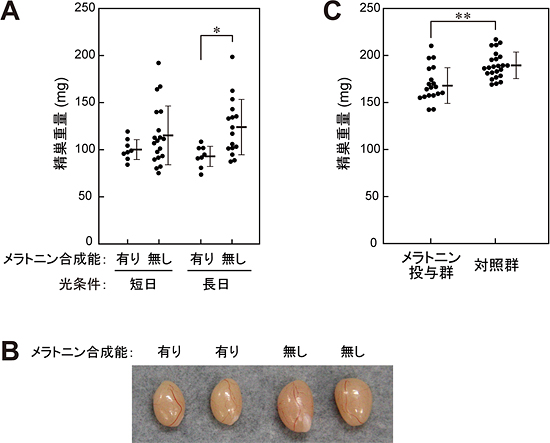
図3 メラトニンが精巣の発達に与える影響
(A)MSMとB6を交配させて誕生したN2マウスを、離乳後から短日(明8時間:暗16時間)あるいは長日(明16時間:暗8時間)の光条件下で飼育し、7週齢時の精巣の重さを測定した。メラトニンの合成能によって精巣重量に有意な違いがあり(P < 0.01, ANOVA)、特に長日条件下においてその差が顕著であった(*P < 0.002, posthoc t-test)。
(B)代表的な4個体の精巣の写真。
(C)メラトニン合成能を持たないICR系統のマウスに胎児の時期からメラトニンを投与し、5週齢時の精巣の大きさを測定した。メラトニンを投与した群では、精巣が有意に小さかった(**P < 0.001)。
