2010年4月1日
独立行政法人 理化学研究所
腸管関連リンパ組織内共生細菌群の発見およびその共生機構の解明
-腸内細菌研究に新たな展開、新規経口ワクチン開発の可能性-
ポイント
- 宿主リンパ組織内に共生する細菌群を世界で初めて発見
- 細菌と宿主との共生機構に関する既成概念に新たな視点を供与
- 新規経口ワクチン抗原の運搬手段としての応用展開の可能性
要旨
独立行政法人理化学研究所(野依良治理事長)は、マウスの腸管粘膜に存在するパイエル板※1などの腸管関連リンパ組織内に共生している、非常にユニークな細菌群(Alcaligenes sp.など)を新たに発見しました。また、粘膜免疫システム※2はこれらパイエル板組織内共生細菌群に対して、粘膜免疫応答を誘導する一方、全身免疫応答はまったく誘導しないことが明らかになり、組織内に限局して同細菌群が存在していることが支持されました。さらに、Alcaligenesをはじめとするこれら細菌群はヒトにおいても確認され、今後の臨床応用への発展も大いに期待されます。
これは、元理研バイオリソースセンター微生物材料開発室辨野義己室長(現 理研イノベーション推進センター辨野特別研究室特別招聘研究員)、ならびに理研バイオリソースセンター微生物材料開発室(大熊盛也室長)の坂本光央協力研究員、東京大学医科学研究所炎症免疫学分野清野宏教授、小幡高士博士課程学生を中心とする研究グループの成果です。
今回の成果は、ほ乳動物のリンパ組織内に特定の細菌群が共生していることを世界で初めて示したもので、宿主動物と細菌との共生関係機構に関するこれまでの知見にまったく新しい視点を投げかけるものです。また、ヒトにも存在するこれらパイエル板指向性細菌群を、経口ワクチンデリバリーのためのキャリアとして用いることで、優れた経口ワクチン開発の可能性も広がり、極めて画期的といえます。
本研究成果は、米国科学アカデミー紀要『Proceedings of the National Academy of Sciences of the United States of America(PNAS)』2010年4月1日オンライン版に掲載されました。
背景
ヒトの粘膜の表面積は、口腔、鼻腔、消化器、呼吸器、泌尿・生殖器を含めると、実に400m2(テニスコート約1.5面分)にも及び、皮膚表面積の200倍以上です。これら粘膜組織の中でも腸管は最も多くの細菌、ウイルスに常時曝露されています。腸管には一般に腸内細菌と呼ばれる共生細菌が棲みついており、宿主側の成長、疾病の発症などに密接にかかわるだけでなく、宿主側も巧妙かつ柔軟な粘膜免疫システムを備えることで本来非自己である共生細菌に対して偽自己化を確立し、共生細菌を質・量ともに制御しています。この相互作用は極めて複雑かつ絶妙なバランスの上に成立しており、その複雑さゆえにこれまで分子・細胞・個体レベルでの機序解明がほとんど行われてきませんでした。また、腸内細菌のほとんどが難培養性細菌であり、これまでの培養法を基盤とした細菌学的手法だけでは実態の解明・把握が不十分だったことも本領域の進展を遅らせた大きな理由の1つです。しかし近年、16S rRNA遺伝子クローンライブラリー法をはじめとする非常に優れた微生物ゲノム解析手法が確立し、これにより高精度で難培養性細菌も含めた腸内細菌プロファイルを検出・精査することが可能となりました。
培養可能細菌を用いたこれまでの報告から、腸内細菌の主要な取り込み口は、パイエル板と呼ばれる腸管免疫誘導リンパ組織であることがすでに明らかにされています。パイエル板の管腔側表面には、抗原取り込み専門細胞であるM細胞が存在し、その直下には樹状細胞やマクロファージ、T細胞、B細胞といった各種免疫担当細胞が待機しています。
研究手法と成果
今回、研究チームはパイエル板の構造と機能を考えたとき、パイエル板もしくはその近傍が粘膜免疫システムを構築する上で最も重要な腸内細菌の共生場所ではないかという仮説を立て、研究を展開しました。これまでにも、パイエル板表面に腸内細菌が常在することは知られていましたが、研究チームはパイエル板の内部にもAlcaligenes sp.などの特定の共生細菌群が常在することを新たに発見しました(図)。同時に、宿主免疫系はAlcaligenesをはじめとするこれらパイエル板組織内共生細菌群に対して、粘膜免疫応答を誘導する一方、全身免疫応答はまったく誘導しないことが明らかになり、組織内に限局して同細菌が存在していることが支持されました。さらに、パイエル板を欠損したマウスでは、これら共生細菌群に対する粘膜免疫応答がほとんど誘導されないことからも、Alcaligenesをはじめとするパイエル板組織内共生細菌の存在が免疫学的にも支持されました。
このAlcaligenesのパイエル板組織内共生という現象は、マウスだけでなく、サルやヒトにおいても同様に確認することができました。このことからも、パイエル板組織内を共生場所とする細菌群が、ほ乳動物の種を超えて、粘膜免疫システムの誘導・制御ならびに腸管組織の恒常性維持に重要な役割を担っていることが推察されます。さらに研究チームは、腸管を含め全身に細菌が一切存在しないマウス、いわゆる「無菌マウス」にこのAlcaligenesを経口的に植え付けると、元来の存在場所であるパイエル板組織内でだけ移植細菌が検出されることを発見しました。この「パイエル板指向性」という性質を利用することで、経口ワクチン抗原を効率よくパイエル板組織内に運ぶ運搬手段としての応用も視野に入れて、現在さらなる研究を行っています。
本研究結果は、ほ乳動物のリンパ組織内に共生細菌が存在すること示唆する初めてのものであり、宿主免疫系と共生細菌との関係性に関するこれまでの知見に新たな視点を投げかけるものです。本領域は現在、最もホットな研究領域として世界中で日々精力的な研究が展開されています。
今後の期待
今回、研究チームは世界で初めて、宿主リンパ組織内に共生細菌群が存在することを発見しました。これら組織内共生細菌群はヒトにおいても存在することが確認され、これら細菌群をパイエル板指向型の経口ワクチンデリバリーキャリアとして利用できるほか、新たなプロバイオティクスとして応用することも十分考えられます。また米国ではすでに、医学的に有用な遺伝子組み換え細菌が新たなバイオ医薬品候補として認識されつつあります。例えば、Cequent Pharmaceuticals社(Cambridge, MA)の大腸がんRNAi治療薬候補CEQ508は、現在臨床試験開始の段階にあり、また、Anaeropharma Science社(Tokyo,Japan)のBEST-CD (Bifidobacterial Selective Targeting-Cytosine Deaminase)療法剤APS001も、間もなく米国で臨床試験が開始される予定です。さらに、Osel社(Santa Clara, CA)も積極的に新製品候補の研究開発を行っております。こうした米国バイオ産業界発の“細菌治療(Bac-Therapy)”という新しい流れにも、本研究は深く関与する可能性が期待されます。
発表者
理化学研究所
イノベーション推進センター 特別研究室プログラム 辨野特別研究室
Tel: 048-467-1948 / Fax: 048-467-1949
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.パイエル板
1677年にスイスのJoseph Peyer医師によって発見された小腸の隆起状組織であり、彼の名にちなんでパイエル板と命名されている。それから約300年後の1971年に、米国ジョンズホプキンス大学のCebra博士らにより、パイエル板が腸管における主要な免疫誘導組織であることが初めて証明された。パイエル板はマウス小腸においては8~10個、ヒトにおいては200個以上も存在する二次リンパ組織である。 - 2.粘膜免疫システム
粘膜は、ほ乳動物の体内で外界との接点が最大の部位であり、ウイルスや細菌、有害物質に対する防御機構の最前線になっている。粘膜には全末梢リンパ球の約60%にも及ぶ非常に多くの、そして多種多様な免疫担当細胞がユニークな粘膜免疫システムを形成しており、それらが外来抗原に対して特異的・防御的な免疫応答を誘導している。全身免疫応答では抗体の中心的アイソタイプがIgG抗体であるのに対し、粘膜免疫応答ではIgAアイソタイプを基本とした分泌型IgA(SIgA)抗体がその主役を担っている。SIgA抗体の機能としては、細菌の粘膜上皮への付着阻止、細菌由来毒素の中和、ウイルスの中和など、非常に多岐にわたっている。また、マウスの全抗体産生細胞の約90%が小腸IgA抗体産生細胞であり、ヒトの全抗体の60%以上がIgA抗体であるという事実からも、粘膜SIgA抗体がいかに宿主免疫系にとって重要な存在かが伺える。SIgA抗体の誘導は、パイエル板に代表される粘膜免疫誘導組織によって行われ、最終的に粘膜固有層に代表される粘膜免疫実効組織において産生・分泌される。
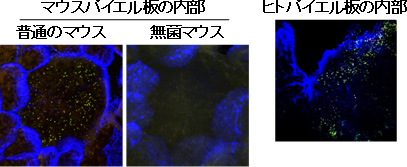
図 パイエル板内部に共生するAlcaligenes菌
細菌特有の遺伝子配列を認識するプローブを用いて、特定の細菌を可視化したもの。Alcaligenes菌は「黄色の点」として確認できる。
