2010年7月2日
独立行政法人 理化学研究所
T細胞になるという運命決定を支配するマスター遺伝子を同定
-転写因子Bcl11b欠損型のT細胞性白血病の発症機序を解明-
ポイント
- T細胞分化決定の停止/再開をコントロールできる培養系を確立
- 転写因子Bcl11bが欠損したマウスでは分化が止まりT細胞がほぼ皆無に
- 造血幹細胞分化の「ミエロイド基本型モデル」の正しさを分子機構の面から実証
要旨
独立行政法人理化学研究所(野依良治理事長)は、血液細胞の源である造血幹細胞が、免疫応答の司令塔として働くT細胞系列へ分化する運命の決定に遺伝子「Bcl11b」が必須であることを見いだしました。これは、理研免疫・アレルギー科学総合研究センター(谷口克センター長)免疫発生研究チームの河本宏チームリーダー、伊川友活研究員らと、新潟大学との共同研究による成果です。
多能性をもつ造血幹細胞からT細胞が作られる過程では、分化能が少しずつ限定され、最終的にT細胞だけにしかなれないT前駆細胞になるという過程を経ます。この最終過程は、T細胞になるという運命を決定づける重要なステップです。研究チームはこれまで、T前駆細胞になる前の段階の前駆細胞が、マクロファージ(大食細胞)※1に代表されるミエロイド系細胞への分化能を保持していることを明らかにしています。本研究では、T細胞系列への最終的な分化過程を明らかにするため、ミエロイド-T前駆細胞が、ミエロイド系細胞への分化能を失うステップに焦点を当てて研究を進めました。
研究チームは、増殖や分化を支持するフィーダー細胞※2を用いない条件下でマウスの造血幹細胞を培養すると、ミエロイド-T前駆細胞の段階で分化が停止し、自己複製※3により増え続けることを見いだしました。さらに、Bcl11bという転写因子※4を欠損したマウスの造血幹細胞でも、同じ段階で分化が停止し、細胞が自己複製することを発見しました。すなわち、Bcl11b遺伝子はT細胞系列への運命決定をつかさどっているマスター遺伝子であることが明らかとなりました。
研究チームは以前から「T前駆細胞はミエロイド-T前駆細胞から作られる」という「ミエロイド基本型モデル」※5を提唱しており、今回の成果は、分子メカニズムの面からこのモデルを支持する結果となりました。T細胞性急性リンパ性白血病※6の中には、Bcl11b遺伝子が不活性化されているタイプが報告されています。その発症機序は不明でしたが、今回の結果から、転写因子Bcl11bを欠損すると、ミエロイド-T前駆細胞が自己複製サイクルに入ることが示されたため、これがこのタイプの白血病を発症する第一段階であると考えられました。この機序をさらに研究することで、治療法の開発に結びつけられると期待できます。
本研究成果は、米国の科学雑誌『Science』(7月2日号)に掲載されます。
背景
T細胞は、ほかの免疫細胞と同様に、多能性造血幹細胞から作られます。古典的な分化モデル※7では、造血幹細胞からの最初の分岐で、ミエロイド系細胞と赤血球を作る前駆細胞と、T細胞とB細胞だけを作る前駆細胞の2通りに分かれるとされてきました(図1A)。このモデルでは、T細胞系列へ分化決定が起こるのは、B細胞への分化能を失う時ということになります。一方、研究チームはこれまでに、古典的な分化モデルとは異なる「ミエロイド基本型モデル」を提唱してきました(図1B)(Y. Katsura, H. Kawamoto, Intern. Rev. Immunol. 20:1, 2001、H. Kawamoto, Y. Katsura, Trends Immunol. 30:193, 2009)。この新モデルでは、造血幹細胞からT細胞への分化の過程で、まず赤血球系への分化能が、次いでB細胞への分化能が失われ(H. Wada et al., Nature 452: 768, 2008)、最終的にはミエロイド系への分化能が消失してT細胞系列に完全に運命決定すると考えています(2008年4月10日プレスリリース)。
このように、T細胞系列への最終的な分化決定過程は、ミエロイド-T前駆細胞がミエロイド系細胞への分化能を失う時ということができ、極めて重要な出来事と言えます。そこで、研究チームは、このミエロイド細胞への分化能を失うステップに焦点を当てて研究を進めてきました。
T細胞は、細胞表面にCD4やCD8などの機能分子を発現しており、これらの分子をマーカーとして調べることで、T細胞の分化過程を知ることができます(図2)。胸腺※8の中で起こるT細胞の分化では、CD4もCD8も発現していない細胞(double negative:DN細胞)が最も未分化な状態です(初期T前駆細胞)。T細胞は、この未分化なDN細胞から、CD4とCD8を共に発現する細胞(double positive:DP細胞)に分化し、その後CD4だけを発現するヘルパーT細胞とCD8だけを発現するキラーT細胞へと分化していきます。今回の研究で焦点を当てたステップは、DN段階で起こります。DN段階中の分化は、造血系の未分化な前駆細胞に広く発現がみられるc-kitとCD25という分子の発現でたどることができ、DN1、DN2、DN3、DN4という順序で進みます。
細胞分化は、ある定常状態から次の定常状態へと、段階的に進みます。その間のステップでは、外からの特定のシグナルとそれに連動して起こる細胞内の特定の遺伝子の発現が必要です。このような分化の「節目」となるステップを、分化の“チェックポイント”(checkpoint:関門や検問所という意味)と呼んでいます。あるステップが重要なチェックポイントであることは、例えば、ある培養条件、あるいはある遺伝子改変条件の下で、特定の分化ステップに進む直前の段階で分化が停止し、さらに細胞が自己複製を行うことで判別できます。
研究チームのこれまでの研究により、ミエロイド系細胞への分化能はDN2段階の途中で消失することが分かっていました(K. Masuda et al., J. Immunol. 179: 3699, 2007)。しかし、この段階で何らかの条件を加えると、分化が停止し、細胞が自己複製するかどうかは明らかになっていませんでした。
研究手法と成果
(1)増殖や分化を支持するフィーダー細胞を使わないT細胞培養系では、初期T前駆細胞はDN2段階で分化停止し、自己複製を開始する
DLL4※9分子は、T前駆細胞に発現するノッチ(Notch)という受容体にシグナルを入れることができます。このDLL4を発現させたフィーダー細胞を用いた培養系では、初期T前駆細胞はDP段階まで分化します。研究チームは、フィーダー細胞が無い条件で、初期T前駆細胞を培養してみました(図3)。まず、プラスチックディッシュの底に、DLL4分子を固相化しました。これに、SCF、Fl3L、IL-7というサイトカイン※10を添加しました。この培養系で、マウス胎仔肝臓※11から採取した造血幹細胞を培養すると、1週間でDN2細胞様の細胞が生成しました。このまま培養を続けると、細胞は同じDN2段階のまま、計算上では1ヵ月で1億倍にもなるほど増え続けました。この結果は、DN2段階で分化が停止して、細胞が自己複製していることを示しています。しかも、この自己複製DN2細胞は、T細胞とミエロイド系細胞への分化能を保持していました。この結果から、DN2段階から先に進むステップ、すなわちミエロイド-T前駆細胞がミエロイド系への分化能を失ってT前駆細胞に進むステップが、T細胞系列への分化の重要なチェックであることが分かりました。
(2)IL-7の濃度を減らすと、T細胞は分化を再開する
(1)の培養条件では、DN2段階で分化は足踏みして先へ進めません。T細胞分化の分子メカニズムの研究を進めるために、分化を誘導する条件を検討しました。その結果、培養の途中でIL-7の濃度を10分の1に減らすだけで、DP段階まで分化が進むことが分かりました(図4)。培養系は単純であればあるほど、細胞分化の研究に有用です。この分化誘導系は、培養に用いる要素を極限にまで絞り込んでおり、フィーダー細胞を用いないT細胞分化の誘導を可能にします。このため、今回開発したフィーダー細胞を用いないT前駆細胞増幅培養系やT細胞の分化誘導培養系は、臨床応用へ向けての大きな一歩となります。例えば、骨髄移植後の免疫不全状態や、エイズなどの後天性の免疫不全状態の患者のT細胞を試験管内で作製して、生体に戻すという方法を用いることで、免疫能を上げることが期待できます。
(3)転写因子Bcl11bはT細胞系列への決定のマスター遺伝子である
DN2段階からの分化決定過程がチェックポイントであることが分かり、このステップを駆動している転写因子があるはずだと考えました。このステップでは、多くのミエロイド系遺伝子や幹細胞を特徴付ける遺伝子の発現が抑制されるとともに、T細胞系列に特異的な遺伝子が発現されます。今回完成した分化決定の停止/再開を制御することができる培養系を用いて、誘導の前後に発現が変わる遺伝子を、Q-PCR※12やマイクロアレイ法※13で調べました。研究チームは、このステップで発現が上昇するT細胞系列に特異的な遺伝子の中で、Bcl11bという転写因子の発現に注目しました。転写因子Bcl11bをコードするBcl11b遺伝子は、がん抑制遺伝子として新潟大学の木南らによって単離された遺伝子で、その欠損マウスではT細胞が激減することがすでに報告されていました(Y. Wakabayashi et al., Nat. Immunol. 4: 533, 2003)。しかし、どの時点で分化が停止するかは不明のままでした。今回、Bcl11b欠損マウスを新潟大学から入手し、研究チームが詳細に調べたところ、このマウスの胸腺では、DN2段階で分化が停止し、T細胞がほとんど作られないことが分かりました(図5)。また、細胞を取り出してきてT細胞分化を誘導できるフィーダー細胞と共培養しても、DN2段階で分化を停止したまま自己複製し続けました。
研究チームは、さらに、フィーダー細胞を用いない培養系で、DN2段階のまま分化が停止している細胞にBcl11b遺伝子を強制発現させてみました。すると、分化の停止が解除されて、次のDN3段階まで分化が進みました。
これらの知見は、Bcl11b遺伝子が、T細胞系列への分化決定をつかさどるマスター遺伝子であることを示しています(図6)。
今後の期待
今回の発見は、以下のような大きな意義があります。
(1)T細胞系列への分化決定過程のさらなるメカニズムの解明が進む
Bcl11bは、抑制性の転写因子として知られています。転写因子Bcl11bがどのような遺伝子を抑制することでT細胞系列への分化決定を引き起こしているかを調べると、分化決定のメカニズムの解明が大きく進むと期待できます。
(2)「ミエロイド基本型モデル」を分子メカニズムの面から支持
フィーダー細胞を用いない培養系で生成した初期T前駆細胞や、転写因子Bcl11b欠損マウスの初期T前駆細胞は、ミエロイド-T前駆細胞段階で分化が停止し、その分化能を維持したままでした。これは、ミエロイド系細胞への分化能を消失することが、T細胞になるための重要なチェックポイントとして働いていることを示しています。このような分子メカニズムは「B細胞への分化能の消失点がT細胞への決定点」とする古典的モデルでは解釈できません。すなわち、分子メカニズム面から「ミエロイド基本型モデル」を強く支持する結果です。言い換えれば、今回の成果は、ミエロイド基本型モデルを土台とすることで得られた成果で、今後のさらなる研究の発展が期待できます。
(3)白血病の発症機序の解明
Bcl11b遺伝子は、もともとはがん抑制遺伝子として見つかりました。放射線照射で胸腺リンパ腫を誘発したマウスでは、Bcl11b遺伝子が不活性化されていることが多いと報告されています(Y. Wakabayashi et al. , Biochem. Biophys. Res. Commun. 301: 598, 2003)。またヒトでは、Bcl11b遺伝子が不活性化されているタイプのT細胞性急性リンパ性白血病が報告されています(G. K. Przybylski et al., Leukemia 19: 201, 2005)。しかし、Bcl11b遺伝子と白血病との関連は不明でした。今回の発見により、転写因子Bcl11bを欠損すると、ミエロイド-初期T前駆細胞が自己複製サイクルに入ることが分かり、これがこのタイプの白血病化の第一段階であると考えられました。この機序をさらに研究することで、治療法の開発に結びつけられると期待できます。
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
免疫発生研究チーム
チームリーダー 河本 宏(かわもとひろし)
Tel: 045-503-7010 / Fax: 045-503-7009
お問い合わせ先
横浜研究推進部 企画課Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.マクロファージ(大食細胞)
体内に侵入した異物を取り込み消化すること(食作用)を主な役割とする免疫細胞。マクロファージや顆粒球などの食細胞は、まとめてミエロイド系細胞とも呼ばれる。 - 2.フィーダー細胞
細胞を培養する時に、その細胞の増殖や分化を支持するために共培養する細胞のこと。ここでは、TSt-4というマウス胸腺間葉系細胞由来のストローマ細胞株に、遺伝子導入によりDLL4を強制発現させた細胞(TSt-4/DLL4)を用いている。TSt-4は、1992年に京大の桂義元研究室(当時京都大学胸部疾患研究所教授)が樹立した細胞株で、TSt-4/DLL4は研究チームが樹立した細胞株である。 - 3.自己複製
細胞分裂により生じた細胞が、先のステージへ分化しないで同じ分化ステージにとどまることを自己複製という。ある培養条件あるいはある遺伝子改変条件の下、特定の分化ステップの直前の段階で分化が停止し、さらにこの分化停止した細胞が自己複製を行うと、その段階が分化における重要なチェックポイントであることが分かる。 - 4.転写因子
遺伝子の発現を制御する分子。多くはDNAとの結合部位を有し、標的遺伝子のエンハンサー、プロモーター、サイレンサーなどの配列に結合して、標的遺伝子の発現を増強または抑制する。 - 5.ミエロイド基本型モデル( 図1B参照)
河本宏(理研免疫発生研究チームチームリーダー)が進めてきた研究に基づいて、2001年に桂義元(当時京都大学再生医科学研究所教授)と共に提唱したモデル。造血幹細胞から分化する最初の分岐では、ミエロイド-赤血球系列に共通の前駆細胞とミエロイド-T-B系列に共通の前駆細胞に分岐し、後者からミエロイド-T前駆細胞とミエロイド-B前駆細胞が作られ、それぞれからT前駆細胞、B前駆細胞が作られるというモデル。赤血球、T細胞、B細胞へ向かう分化の途中まで、それぞれにミエロイド系細胞を作る能力が付随すると表現することもできる。古典モデル (図1A)では、ミエロイド系列をほかの系列と平行に独立した系列として扱うが、本モデルではミエロイド系列はすべての系列のプロトタイプ(原型)であるとするという点で、決定的に異なっている。 - 6.T細胞性急性リンパ性白血病
白血病は進行度の速さから急性と慢性に分けられ、また、起原となる細胞がミエロイド系かリンパ球系かによってそれぞれ骨髄性、リンパ球性に分けられる。リンパ球性はT細胞系列が起原のものとB細胞系列が起原のものに分けられる。すなわち、T細胞性急性リンパ性白血病は、T細胞系列の細胞ががん化したことによって起こる急性リンパ性白血病である。 - 7.古典的な分化モデル(図1A参照)
血液系細胞の分化経路は、30年も前から、近縁な細胞が共通の分化経路を経て作られるという想定のもとに描かれた「仮の分化経路図」で説明されてきた。その中で、T細胞とB細胞は特別に近縁な細胞であろうと想定されていたので、ほとんどの医学・生物学の教科書では、造血の最初の段階でミエロイド-赤血球系列に共通の前駆細胞とT-B系列に共通の前駆細胞(いわゆるリンパ系共通前駆細胞)に分岐するという分化経路が描かれていた。 - 8.胸腺
T細胞が作られる臓器で、心臓の上に位置する。T細胞のもとになるT前駆細胞は、胎生期には肝臓から、生後は骨髄から胸腺へ移住する。胸腺で分化成熟したT細胞は末梢組織へ移出される。 - 9.DLL4
ノッチ(Notch)という受容体タンパク質のリガンドとして働く分子の1つ。ノッチシグナルは、神経や血液細胞の発生/分化のさまざまな局面で重要な役割を担っている。T細胞の初期分化にもノッチシグナルが必須である。胸腺での分化途上にあるT前駆細胞の表面にレセプターとしてNotch1が発現しており、そのリガンドとして働いているのが胸腺上皮細胞に発現しているDLL4である。 - 10.サイトカイン
細胞に増殖、分化などの指令を伝える液性因子。 - 11.マウス胎仔肝臓
ほ乳類の多くでは、成体の造血は骨髄で起こるが、胎生期の造血は肝臓で起こる。従って、胎仔肝臓は造血系幹細胞や前駆細胞を多く含んでいる。 - 12.Q-PCR
PCRは、遺伝子の特定の部位を増幅することにより検出する方法である。Q-PCRは定量的なPCRのこと。 - 13.マイクロアレイ法
塩基配列が既知の多種類の遺伝子のDNAをプローブとして、プレート上に規則正しく貼付けておく。調べたい細胞からmRNAを採取し、蛍光標識する。これをプレート上に貼付けられたDNAと反応させ、蛍光強度を読み取ることにより、mRNAの発現量を網羅的かつ定量的に調べることができる。
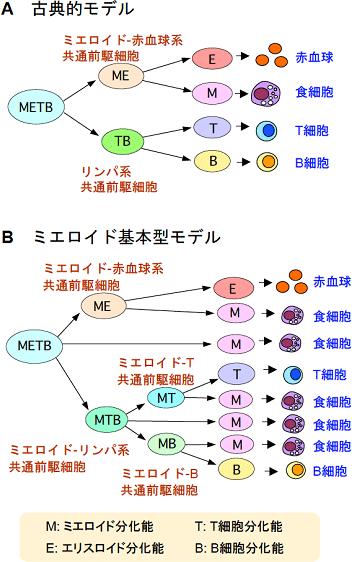
図1 造血過程の基本モデル
A. 古典的モデル。ほとんどの教科書などで使われている。1997年に、米国のI.ワイスマンらのグループがこのモデルを支持する論文を出してからは、その論文がこのモデルの論拠となった。
B. ミエロイド基本型モデル。研究チームが提唱するモデルで、赤血球、T細胞、B細胞へ向かう分化の途中まで、それぞれにミエロイド系細胞(食細胞)を作る能力が付随するというもの。古典モデルでは、ミエロイド系列をほかの系列と平行に独立した系列として扱うが、本モデルでは、ミエロイド系列はすべての系列のプロトタイプ(原型)であるとする点で、決定的に異なっている。
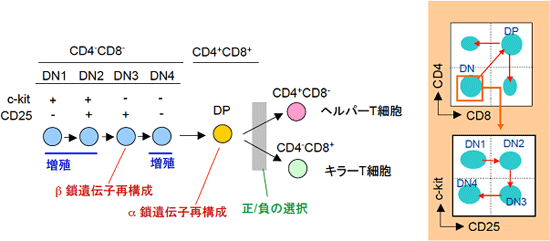
図2 胸腺内T細胞分化経路
T細胞は、胸腺で分化する。胸腺中のT細胞系列の細胞をまとめて胸腺細胞という。胸腺細胞の初期分化段階ではCD4とCD8を発現しておらず、double negative(DN)段階といわれる。DN段階はc-kitとCD25の発現によってさらに4群に分けられ,DN1からDN4へと分化が進む。DN1とDN2段階では、最初の旺盛な増殖が起こる。DN3段階で増殖は停止し、T細胞受容体(TCR)β鎖遺伝子の再構成が起こる。TCRβ鎖の再構成に成功した細胞の多くは、DN4段階で旺盛に増殖した後にCD4+CD8+(double positive:DP)段階へと分化を進める。DP段階に移行する過程でTCRα鎖遺伝子の再構成が起こり、表面にαβTCRを発現するようになる。TCRからのシグナルを受けたDP細胞は、CD4+CD8-すなわちCD4 single positive (SP)細胞およびCD8SP細胞へと分化し、末梢組織へ移住する。DP細胞からCD4SP細胞およびCD8SP細胞が作られるためには、一定の強度のTCRシグナルを受けることが必要で、これを正の選択と呼ぶ。一方、TCRシグナルが強すぎると、細胞は死ぬ。この過程を負の選択と呼ぶ。負の選択により自己反応性T細胞は除去される。右側には、胸腺細胞の分化の順序を示している。
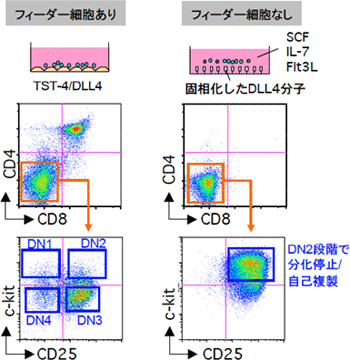
図3 フィーダー細胞を用いないT細胞培養系では、前駆細胞はDN2段階で分化停止し、自己複製サイクルに入る
左側の列はフィーダー細胞を用いた培養系、右側はフィーダー細胞を用いない培養系を示している。フィーダー細胞としては、TSt-4/DLL4という細胞を用いている。一方、フィーダーを用いない培養系では、DLL4分子をディッシュの底に固相化してあり、数種類のサイトカイン(SCF、IL-7、Flt3L、各10ng/ml)を添加している。マウスの胎仔肝臓から単離した造血幹細胞をTSt-4/DLL4細胞と培養すると、DP細胞が生成する。一方、フィーダーを用いない培養系では、DN2段階で分化が停止している。この細胞は自己複製サイクルに入っており、長期間(数週間)にわたり増幅可能である。
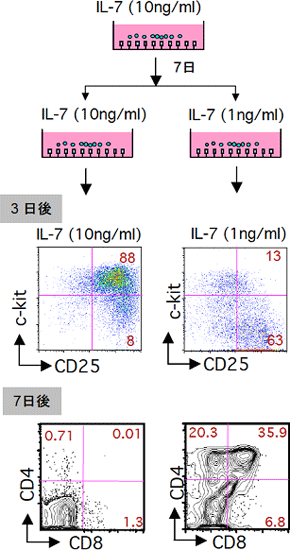
図4 フィーダー細胞を用いないT細胞培養系でIL-7の濃度を減らすと、T細胞は分化を再開する
図3に示したフィーダー細胞を用いない方の培養系において、培養開始1週間後にIL-7の濃度を10分の1減らした。その3日後にはDN3細胞が生成し、1週間後にはDP細胞が生成した。
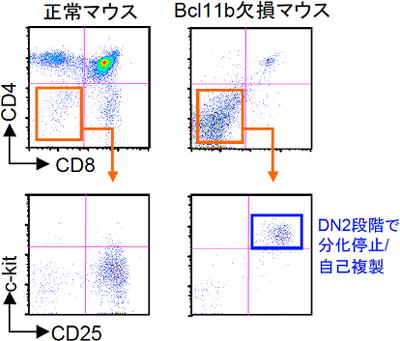
図5 転写因子Bcl11b欠損マウスの胸腺細胞は、DN2段階で分化が停止している
転写因子Bcl11b欠損マウスは、新生仔期に死ぬので、成体胸腺でのT細胞分化の状況を調べることができない。そこで、Bcl11b欠損マウスの胎仔肝臓細胞を、放射線照射により造血幹細胞を殺傷した正常マウスに移植した。このようにすると、Bcl11b欠損マウス由来の造血幹細胞の分化を成体で調べることができる。左側のパネルは正常な胎仔肝臓細胞を移植したマウスの胸腺細胞。右のパネルは、Bcl11b欠損マウスの胎仔肝臓を移植したマウスの胸腺の解析。DN2段階で分化が停止しているのが分かる。
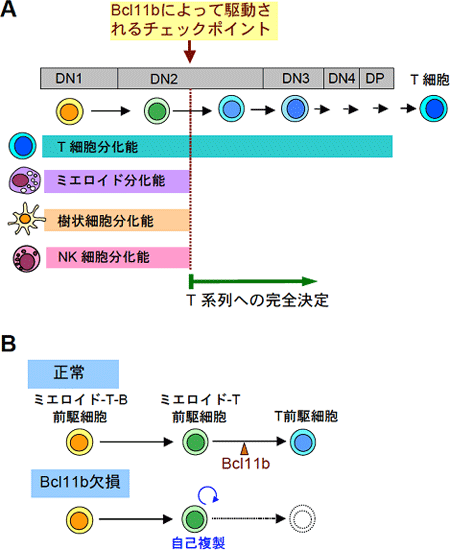
図6 Bcl11b遺伝子はT細胞系列への決定のマスター遺伝子である
A. 胸腺で分化する初期T前駆細胞は、初めはミエロイド系細胞、樹状細胞、NK細胞などへの分化能を有しているが、DN2段階の途中でそれらの分化能は消失し、T細胞系列に完全に決定される。このステップにはBcl11b遺伝子が必須である。
B. Bcl11b遺伝子を欠損すると、分化停止した前駆細胞は自己複製サイクルに入ってしまう。これは白血病発症の第一段階と考えられる。
