2010年8月13日
独立行政法人 理化学研究所
国立大学法人 東京大学大学院理学系研究科
生物に必須な元素「セレン」をタンパク質に正しく取り込む仕組みを解明
-21番目のアミノ酸と注目される「セレノシステイン」の生合成過程が鍵-
ポイント
- 毒性あるセレンを安全に用いるため、セレンをアミノ酸へ導入する仕組みを解明
- リン酸化酵素PSTKがtRNAを正しく認識し、強い結合でセレン取り込みを高選択
- 遺伝暗号が進化した仕組みに基づいた新機能タンパク質の創生などへ期待
要旨
独立行政法人理化学研究所(野依良治理事長)と国立大学法人東京大学(濱田純一総長)は、あらゆる生物のタンパク質を構成する20種類の基本的なアミノ酸に加えて、「21番目のアミノ酸※1」と呼ばれるセレノシステイン(Sec)の生合成の仕組みを明らかにしました。Secの生合成には、リン酸化酵素「O-ホスホセリル-tRNAキナーゼ(PSTK)」による転移RNA(tRNA)※2のリン酸化が必須ですが、このPSTKがSec専用の転移RNA(tRNASec)を選択的に認識し、リン酸化する機構を解明しました。これは、理研生命分子システム基盤研究領域の横山茂之領域長(東京大学大学院理学系研究科 構造生物学社会連携講座兼任教授)、東京大学大学院理学系研究科 構造生物学社会連携講座の関根俊一特任准教授(理研生命分子システム基盤研究領域システム研究チーム客員研究員)らによる研究成果です。
セレン(Se)は、私たちヒトを含め幅広い生物の生存に必須の元素です。反応性が高く一定量以上では有毒ですが、微量成分として不可欠で、Seの欠乏が、がんや高血圧などの疾病と結びつくことが指摘されています。Seは主にセレノシステイン(Sec)というアミノ酸に取り込まれ、抗酸化作用の機能を持つ酵素など、一部のタンパク質(セレン含有タンパク質)の構成要素として細胞内に存在し、酸化還元反応のための活性中心として有効に機能しています。
Secには、このアミノ酸を運搬する専用の転移RNA(tRNASec)が存在し、通常の20種類のアミノ酸と同様に遺伝暗号に従ってセレン含有タンパク質に取り込まれるため、Secは「21番目のアミノ酸」と呼ばれています。Secは、複数の酵素反応を経てtRNASecと結合(Sec-tRNASec)します。今回、Secの生合成に必須なリン酸化酵素PSTKとtRNASecとの複合体の結晶構造解析に初めて成功し、生物が反応性や毒性の高いSeを有用なSecというアミノ酸としてタンパク質に正しく取り込む仕組みを解明しました。
この成果は、遺伝暗号の進化の過程で生命が新たなアミノ酸を獲得してきた仕組みを理解する上で重要であるとともに、非天然アミノ酸を組み込んだ機能性タンパク質など、新しいタンパク質医薬の開発にも新しい道を切り開くものと考えられます。
本研究成果は、ターゲットタンパク研究プログラム、文部科学省科学研究費補助金、東京大学グローバルCOEプログラムなどの支援を受けて行われたもので、米国の科学雑誌『Molecular Cell』(8月13日号)に掲載されるに先立ち、オンライン版(8月12日付け:日本時間8月13日)に掲載されます。
背景
タンパク質は、タンパク質合成を担う細胞内小器官である「リボソーム※3」において、伝令RNA(mRNA)※4上の3つの塩基からなる遺伝暗号の単位(コドン※5)が、転移RNA(tRNA)を介して対応するアミノ酸に翻訳されることで合成されます。すべての生物において、一般にタンパク質は20種類のアミノ酸から構成されていますが、初期の生命では20種類よりも少ない数のアミノ酸しか存在せず、進化の過程で新しいアミノ酸が遺伝暗号に組み込まれたと考えられています。このため、タンパク質の生合成機構を詳細に調べることは、生物が進化しながら遺伝暗号を付け加え、新たなアミノ酸を獲得してきた仕組みの解明にもつながります。
セレン(Se)は、ヒトから細菌まで幅広い生物の生存に必須の微量元素で、周期表では酸素(O)、硫黄(S)、セレン(Se)と続く酸素族に属する元素です。反応性に富み有毒ですが、微量成分として必須で、Seの欠乏は、がんや高血圧などの疾病に結びつくことが指摘されています。主にSeは、セレノシステイン(Sec)というアミノ酸に取り込まれ、抗酸化作用の機能を持つ酵素など、一部のタンパク質(セレン含有タンパク質)の構成要素として細胞内に存在しています。Secは、セリン(Ser)またはシステイン(Cys)というアミノ酸の、それぞれ酸素(O)または硫黄(S)が、Se原子で置換された構造を持っています(図1)。こうして生物は、高い反応性を持って有毒なSeを安全な形でタンパク質に取り込み、活性酸素種の除去など、主に酸化還元反応の活性中心として有効活用しているのです。
Secは「21番目のアミノ酸」として知られ、遺伝暗号に従ってタンパク質に取り込まれます。しかし、生物の持つ基本的な遺伝暗号は20種類のアミノ酸に対応した暗号です。そのため、この21番目のアミノ酸を加えるため、生物は巧妙な工夫を施しています。Secには、専用の特殊なtRNA(tRNASec)が存在します。tRNASecはUGAコドン(通常はタンパク質合成の終了を指示する)に対応するアンチコドン※6を持っており、セレン含有タンパク質の設計図となるmRNAの特定のUGAコドンを終止コドンからSecコドンへと読みかえることでSecを挿入します。このように、生物はSeを利用するために、20種類にしか対応していない基本的な遺伝暗号を進化させ、21番目のアミノ酸に対応させています。
Secは、複数の酵素反応を経てtRNASecに結合した状態で合成されます。tRNASecは、まず通常のアミノ酸であるSerを付加され(Ser-tRNASec)、次にO-ホスホセリル-tRNAキナーゼ(PSTK)というリン酸化酵素によってリン酸化を受け(P-Ser-tRNASec)、最後にSeを取り込んでSec-tRNASecとなります(図2)。ここで、PSTKは、tRNASecとほかの標準的なtRNA、特に、Serに対するtRNA(tRNASer)を厳密に区別し、tRNASecだけをリン酸化してSecの合成へと導く一方で、通常のtRNA上で誤ってSeが取り込まれるようなことがないように品質管理の役目を担っていることが知られています。しかし、その詳細な選別の仕組みはこれまで明らかにされていませんでした。
そこで研究グループは、PSTKとtRNASecとの複合体の結晶構造を解析し、高い反応性を持ったSeを有用なSecという21番目のアミノ酸に変換してセレン含有タンパク質に取り込む仕組みの解明に取り組みました。
研究手法と成果
PSTKおよびtRNASecの複合体の結晶を作製し、理研の大型放射光施設SPring-8のBL41XUビームラインと、大学共同利用機関法人高エネルギー加速器研究機構の放射光科学研究施設フォトンファクトリー(Photon Factory)のNW12Aビームラインを用いて立体構造を決定しました。その複合体の立体構造解析から次のようなことが分かりました。
(1)tRNASec・PSTK複合体の立体構造
研究グループは、古細菌由来のtRNASecとPSTKの複合体の結晶を作製し、2.4~2.9Å(オングストローム:1Åは10-10m)の分解能でその複合体の構造を明らかにしました(図3)。PSTKは2分子で二量体を形成しており、それぞれの分子が1分子のtRNASecと結合していることを解明しました。
PSTKは、C末端ドメインとN末端ドメイン、およびこれら2つのドメインを連結するリンカーから構成されています。複合体中では、N末端ドメインとC末端ドメインが、それぞれtRNASecのアクセプターアーム※7およびDアーム※8と呼ばれる部分と結合することが分かりました。また、PSTKはtRNASecに特有のアンチコドン(UGAコドンと対合する)とは接触しないことも分かり、PSTKはこのアンチコドンを認識しているのではないことが明らかとなりました。
(2)PSTKのC末端ドメインはtRNASecに固有のDアームを認識する
tRNASecのDアームは、6塩基対からなるステムと4塩基からなるループを持ち、通常、3~4塩基対からなるステムと7~11塩基からなるループを持つ標準的なtRNAの構造と大きく異なっています(図4上)。これは、tRNASecに特有な構造的特徴の1つです。
X線結晶構造解析の結果、PSTKのC末端ドメインは、このtRNASecのDアームの構造的特徴にぴったりと適合して結合していることが分かりました(図4下水色)。生化学的な解析の結果、PSTKのC末端ドメインのtRNASecのDアームへの結合が、PSTKによるtRNASecの認識に必須であることを明らかにすることができました。PSTKはC末端ドメインを用いてDアームを足場にtRNASecと強く結合し、N末端ドメインをtRNASecのアクセプターアームに配置して、アームの末端に結合したアミノ酸のリン酸化を行うと考えられます。標準的なtRNAのDアームは、PSTKのC末端ドメインと適合しないため(図4下青色)、PSTKによるリン酸化が起こることはありません。従って、例えばtRNASer上で誤ってSecが合成され、Seを含むSecがSerの代わりにタンパク質へ導入されるようなことは未然に防がれています(図5)。このように、「PSTKのC末端ドメインがtRNAのDアームをチェックする」ことによりtRNAを厳密に区別し、通常の翻訳の精度を維持したまま、セレン含有タンパク質の特定の部位へ正確にSecの導入が行われる仕組みを明らかにすることができました。
今後の展望
この研究成果は、「21番目のアミノ酸」であるSecが正しく作られ、セレン含有タンパク質に導入される仕組みを解明する上で極めて重要であるとともに、遺伝暗号の進化を研究する上でも重要な知見を提供しています。進化の過程で、生物が必要に応じて遺伝暗号を拡張し、多くの有用な機能を持った天然または非天然のアミノ酸をタンパク質の目的の位置に導入する仕組みは、新しい機能を担うタンパク質を創製する技術開発基盤の構築や、それらを通じた新しいタンパク質医薬などの開発にもつながることが期待できます。
発表者
理化学研究所
生命分子システム基盤研究領域
領域長 横山 茂之(よこやま しげゆき)
Tel: 045-503-9196 / Fax: 045-503-9195
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.21番目のアミノ酸
一般に、タンパク質は20種類のアミノ酸を材料にしてリボソームで合成される。これは、タンパク質の設計図であるmRNAのコドンの各々が普遍的に20種類のアミノ酸(ないし翻訳の終了)のいずれかに対応していることに基づく。生物の中には、普遍的な20種類に加えて、21番目、22番目といった異なるアミノ酸をタンパク質合成に用いるものがある。ヒトを含めた動物や、細菌や古細菌の一部は、セレノシステインというアミノ酸を用いることが知られており、普遍的な20種類に加えて新たに発見されたことから「21番目のアミノ酸」と呼ばれる。セレノシステインは、一部のタンパク質(セレン含有タンパク質)を合成する際に、通常は翻訳の終了を指示するUGAコドンを、セレノシステインを指定するものと解釈して挿入される。 - 2.転移RNA(tRNA)
転移リボ核酸(transfer RNA)の略号。各アミノ酸の種類ごとに1~数種類のtRNAが存在する。tRNAはそれぞれ対応するアミノ酸を末端に結合し、リボソームまで運搬する。リボソームにアミノ酸を受け渡すと、再びアミノ酸を結合して、リボソームまで運搬する働きを繰り返す。 - 3.リボソーム
mRNAの持つ遺伝情報を翻訳してタンパク質を合成する細胞内小器官の1つ。 - 4.伝令RNA(mRNA)
伝令リボ核酸(messenger RNA)の略号。DNAからコピーされタンパク質に翻訳される塩基配列情報を含んでいる。 - 5.コドン
mRNAに含まれる、連続する3つの塩基からなる遺伝暗号の単位。リボソームにおいて、mRNAの塩基配列がタンパク質を構成するアミノ酸配列へと翻訳されるときに、各アミノ酸を指定する。64種類のコドンのうち、UGAを含む3種類は終止コドンと呼ばれ、翻訳の終了を指示する。 - 6.アンチコドン
tRNA上に存在する、連続する3つの塩基からなる配列。mRNAのコドンと結合して、遺伝情報を各アミノ酸に対応付ける。 - 7.アクセプターアーム
tRNAは一本の鎖からなるRNA分子で、分子内で塩基対を作ることによって、 図3(上)の模式図に示されるような4~5つの「腕(アーム)」をもった二次構造をとる。さらに、これらの腕のいくつかが相互作用することによって、三次元的に折り畳まれた立体構造をとっている。アクセプターアームはtRNAの腕の1つ( 図3, 4ではピンク色で着色)。末端にCCAという保存配列が付いており、そのAにアミノ酸が結合する。アクセプターアームは「アミノ酸を受け取る腕」という意味。 - 8.Dアーム
Dアームは、tRNAの腕のうちの1つ( 図3, 4では水色で着色)。ほかの腕と相互作用することで、tRNAを三次元的に折り畳んで立体構造をとらせる。立体構造の中では、tRNAのちょうど中央部を占める (図3b)。
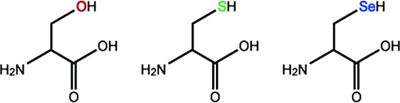
図1 セリン(Ser)、システイン(Cys)、セレノシステイン(Sec)の構造
セレノシステイン(Sec)は、セリン残基(Ser)側鎖の酸素原子(O)、システイン残基(Cys)側鎖の硫黄原子(S)がセレン原子(Se)に置き換わった構造をしている。
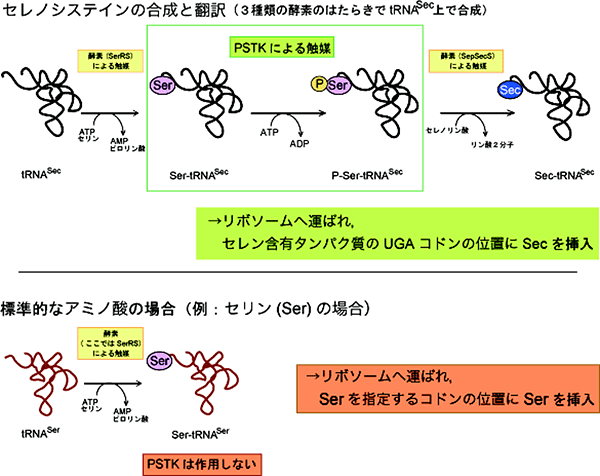
図2 セレノシステイン(Sec)の生合成
tRNASecはまずセリン(Ser)を付加された後(Ser-tRNASec)、O-ホスホセリル-tRNAキナーゼ(PSTK)によってリン酸化を受け(P-Ser-tRNASec)、最終的にSec-tRNASecに変換される(上)。一方、ほかのtRNA、例えばtRNASerの場合は、Serは付加されるが、PSTKによるリン酸化は受けない。
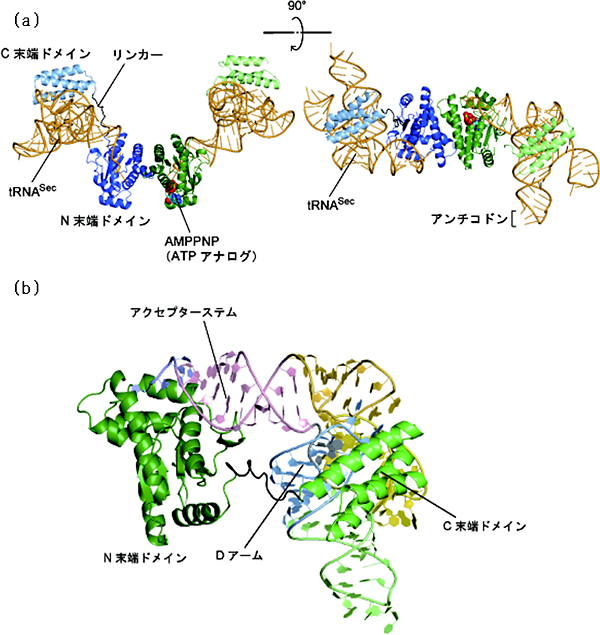
図3 tRNASec・PSTK複合体の立体構造
(a)PSTKは2分子でホモ二量体(青色・緑色)を形成しており、それぞれの分子が1分子のtRNASec(オレンジ色)と結合している。PSTKのN末端ドメインとC末端ドメインはリンカーでつながっており、互いに独立してtRNASecと相互作用することができる。
(b)PSTK2量体のうちの片方と、tRNASec1分子を色分けして示した。PSTKのN末端ドメイン(濃緑色)とC末端ドメイン(緑色)は、それぞれtRNASecのアクセプターアーム(ピンク色)とDアーム(水色)と呼ばれる部分と結合する。PSTKはUGAコドンに対応するアンチコドンとは接触しない。
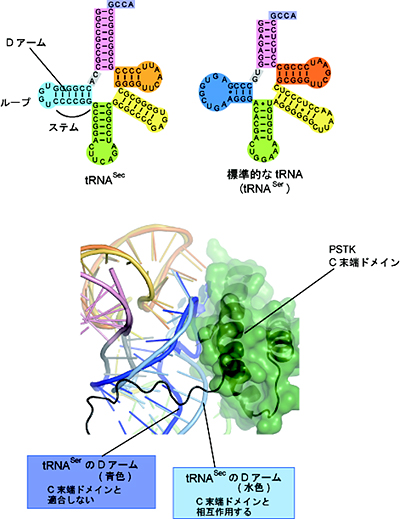
図4 tRNASecの特徴的なDアームとPSTKのC末端ドメインの相互作用
(上図)tRNASecのDアームは、6塩基対からなるステムと4塩基からなるループを持ち(図左)、 標準的なtRNAの構造(3~4塩基対からなるステムと7~11塩基からなるループ)(図右)と異なっていた。
(下図)今回決定したtRNASec・PSTK複合体の立体構造に、標準的なtRNA(ここではT. thermophilusのtRNASer)を重ね合わせると、PSTKのC末端ドメイン(緑色)はtRNASecのDアーム(水色)にぴったり適合しているのに対し、標準的なtRNAのDアーム(青色)には立体構造が適合せず、十分に相互作用できないことが分かった。
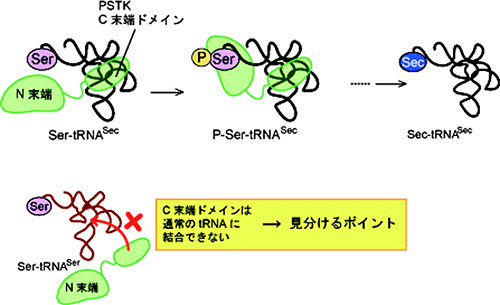
図5 PSTKによるtRNASec認識の模式図
PSTKによるtRNASecの認識は、tRNASecの特殊なDアームの構造とPSTKのC末端ドメインとの相互作用に依拠すると考えられる。通常のtRNAのDアームはPSTKのC末端ドメインと適合しないため、通常のtRNA(特にtRNASer)上で誤ってSecが合成されることがない。よって、UGA以外のコドン(セリンコドンなど)に対してSecが挿入されるようなことは起こらない。
