2010年9月21日
独立行政法人 理化学研究所
世界最大のN-結合型糖鎖クラスターの開発と体内動態解析に成功
-糖鎖の有無や結合部位で代謝が大きく異なることを分子イメージングで証明-
ポイント
- 分子量5万以上(糖鎖が16個)の世界最大の糖鎖クラスターを開発
- ヌードマウス体内での糖鎖の動態をPETと蛍光イメージング技術で初観察
- 炎症やがん組織を標的とする糖鎖診断薬開発に期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、分子量が5万以上の世界最大の糖鎖クラスターを開発し、ヌードマウスを用いて、糖鎖分子の体内動態を可視化することに世界で初めて成功しました。これは、理研分子イメージング科学研究センター(渡辺恭良センター長)分子プローブ動態応用研究チーム(渡辺恭良チームリーダー)の野崎聡研究員、長谷川功紀研究員、と大阪大学大学院理学研究科天然物有機化学研究室(深瀬浩一教授)の田中克典助教、キシダ化学株式会社(大阪市中央区本町橋、岸田充弘代表取締役)の小山幸一研究員、米国スクリプス研究所(Scripps Research Institute)のJ.C.ポールソン(J.C.Paulson)教授らとの共同研究による成果です。
N-結合型糖鎖※1は、細胞膜や細胞内などに多種多様な形態で存在し、タンパク質の血中内での安定性や、さまざまな生体分子との相互作用など、生命活動に欠かせない非常に重要な役割を示すことが知られています。これら糖鎖は、細胞表面などで不均一なクラスター(集合体)を形成することで、タンパク質との相互作用を増強し、さまざまな機能調節をつかさどっている(クラスター効果)と考えられているものの、詳細については解明されていませんでした。
研究グループは、ポリリジン※2を基本骨格とする、分子量が5万以上ある世界最大の新たな糖鎖クラスターの開発に世界で初めて成功しました。さらに、この糖鎖クラスターを、高速6π-アザ電子環状反応※3を用いて、放射性核種である68Gaや近赤外線に吸収を持つ蛍光物質Cy5(発光波長が670nmの赤色)で効率的に標識した後、生きたままのヌードマウスに投与して、ポジトロン断層撮影装置(PET)や蛍光イメージング装置で糖鎖分子の体内動態を可視化しました。その結果、糖鎖の有無やその結合様式によって、生体内でのダイナミクスや代謝が著しく異なることを初めて明らかにしました。これらの成果は、糖鎖の“生きている動物内”での動態を解明する大きな一歩であり、炎症やがん組織を標的とする糖鎖診断薬の開発が期待されます。
本研究成果は、独国の科学雑誌『Angewandte Chemie International Edition』(10月25日号)に掲載されます。
背景
N-結合型糖鎖(アスパラギン結合型糖タンパク質糖鎖)は、細胞間相互作用、タンパク質品質管理、免疫応答調節など、さまざまな生物学的機能に深く関与しています。特に、可溶性のタンパク質に付加する場合には、血中内での安定性にも重要な役割を果たしています。また、N-結合型糖鎖は、その種類によって臓器特異的に集積する性質を持ちます。このような糖鎖機能が、生体内でどのようなダイナミックな過程を経て発現するのか、また、生きている動物内で、実際にどのような代謝過程を経て、臓器選択性を示すのかを明らかにすることは、N-結合型糖鎖を基盤とした診断や治療薬を開発する上で大変重要です。しかし、このN-結合型糖鎖の研究は、これまで試験管内での解析が主流だったため、生体内での動態は明らかにされていませんでした。
研究グループはこれまでに、N-結合型糖鎖を人工的に付加したリンパ球の“動き”を、生体内で可視化することや、この糖鎖付加リンパ球をがん組織へ効率的に集積させることに成功しています(2010年5月20日プレス発表)。これらの研究で得た、糖鎖に依存した細胞の動態変化に関する知見を基に、今回、糖鎖分子自体の生体内での動態を解析する技術の開発に挑戦しました。一般的に、単分子の糖鎖は、分子サイズが小さく、腎臓から素早く排出されて体内にとどまらないため、生体内での動態を可視化することは困難です。また、単分子の糖鎖と、糖鎖を認識するタンパク質との相互作用は一般的に弱く、糖鎖が機能を発揮しにくいことが知られています。
生体内の糖鎖の多くは、構造が少しずつ異なる不均一な状態(グライコフォーム)で存在しており、これらがクラスターを形成することで多くの組み合わせが生じ、糖鎖機能に多様性をもたらしています。このような多様性の高い糖鎖分子社会が、タンパク質や細胞の動態や機能を微妙に調節している(クラスター効果)ものと考えられています。そこで研究グループは、糖鎖の有無や結合様式などの糖鎖構造の違いがクラスター効果へ与える影響を解析するために、N-結合型糖鎖の分子クラスターを人工的に開発し、分子イメージング技術を用いて、生体内での動態を解析する技術の開発に挑みました。
研究手法・成果
ポリリジンを基盤骨格とする、分子量が5万以上ある世界最大の糖鎖クラスターを新たに開発するため、ポリリジン型デンドリマー※4の末端に導入したプロパルギルグリシン※5に対して、銅媒介によるHuisgen[2+3]環化反応※6を用いて、4、8および16分子のN-結合型糖鎖を効率的に導入しました。この際、研究グループが独自に開発したヒスチジン誘導体を活性化剤とする自己活性化クリック反応※7を実施することにより、さまざまな構造を持つ複合型N-結合型糖鎖を、室温40分という温和な反応条件の下、定量的にクラスター化することに成功しました(図1)。
さらに、糖鎖クラスター末端にあるアミノ基を持つリンカー(架橋剤)に対して、研究グループが開発した高速6π-アザ電子環状反応(2010年4月19日プレス発表)を用いて、放射性核種である68Gaや近赤外線に吸収を持つ蛍光物質Cy5(670nm、赤色)で効率的に標識した後(図1)、この糖鎖クラスターをヌードマウスに投与し、PETや蛍光イメージングを用いて、生体における糖鎖クラスターの可視化を行いました。
まず、非還元末端※8に2つのNeuα(2-6)Gal構造※9を持つN-結合型糖鎖をヌードマウスに投与し、デンドリマーの分岐数が生体内動態に及ぼす効果を調べました(図2)。その結果、この糖鎖を4分子、または8分子持つクラスター(分子量は1万~2万程度)は、5分以内に速やかに腎臓から排出されるのに対して(図2 a,b)、糖鎖を16分子持つクラスター(分子量は5万程度)では、血中での滞留性が著しく向上して、4時間後に主に肝臓に集積し、その後腎臓を経た膀胱からの排出に加えて、胆のうを経てゆっくりと消化管から排出されることが分かりました(図2 c)。このように、N-結合型糖鎖の“生きている動物内”におけるダイナミクスを効率良く可視化するためには、糖鎖を16分子以上の大きさでクラスター化することが重要であると分かりました。
さらに、糖鎖を16分子持つクラスターを用いて、糖鎖構造が代謝や臓器への集積に及ぼす効果について検討しました。アシアロ糖鎖※10の場合には、予測されたように、アシアロ糖タンパク質受容体を介して肝臓へ集積し、さらに腎臓から速やかに体外へ排出されることを観察しました(図3 R1)。これは、糖鎖クラスターにシアル酸が存在することにより、生体内での安定性が向上することを示していると考えられます。しかし、2つのNeuα(2-3)Gal非還元末端構造を持つ糖鎖の場合では、Neuα(2-6)Gal構造を持つ糖鎖の場合(図3 R3)とは劇的に異なり、腎臓から5分程度で速やかに排出されることが判明しました(図3 R2)。このように、生体内イメージングの手法を用いることにより、シアル酸のガラクトース残基への結合位置によっても、代謝過程が著しく異なることを初めて見いだすことができました。さらに、さまざまな糖鎖構造を持つクラスターのイメージングを解析した結果、生体内での代謝安定性にはNeuα(2-6)Gal構造を少なくとも1つ持つことが必要であることや、これら糖鎖クラスターが、4時間後に有意に脾(ひ)臓に集積することを見いだしました。
また、ヒト由来の大腸がん細胞株であるDLD-1細胞を移植したがんモデルマウスを用いて、同様に糖鎖クラスターの非侵襲的な生体内蛍光イメージングを実施した結果、正常マウスとは劇的に異なる生体内動態を観察しました(図4)。正常マウスでは速やかに代謝されたアシアロ糖鎖R1は、がんモデルでは生体内安定性が著しく向上することが分かりました。また、2つのNeuα(2-6)Gal構造を持つクラスターR3、およびNeuα(2-3)Gal構造とNeuα(2-6)Gal構造を1つずつ持つR4、R5は、正常モデルマウスでは最終的に脾臓に集積したのに対して、がんモデルマウスでは脾臓への集積が認められませんでした。これらの結果は、がん組織をマウスに移植したことにより、がん組織から産生されるサイトカインなどがレクチンや糖鎖レセプターを飽和したり、その発現量を調節・抑制したりしていることを示唆しますが、今回開発した糖鎖クラスターは、これに敏感に反応・感知していることを示します。このように、N-結合型糖鎖クラスターR1~5は新しいタイプのがん診断プローブとなり得ることを明らかにしました。
今後の期待
今回研究グループが開発した糖鎖クラスター合成法を活用することで、単一の糖鎖だけではなく、多くの種類の糖鎖をクラスター化することが可能となりました。すなわち、細胞膜に存在する糖鎖の不均一なクラスターを疑似化して、糖鎖相互作用の強度や臓器選択性を増強し、多様性の高い糖鎖生体分子社会を自由自在につくりだすことができると考えられます。このように、研究グループが独自に開発した糖鎖クラスターのイメージングの方法は、これまでに手つかずの状況であった自然界での糖鎖の動態を“生きている動物内”で解明する大きな一歩となることが期待できます。さらに、この方法を基盤とした、炎症やがん組織を選択的に認識したり、ターゲティングを効率的に行ったりすることができる糖鎖診断薬の開発が期待できます。
発表者
理化学研究所
分子イメージング科学研究センター
分子プローブ動態応用研究チーム
チームリーダー 渡辺 恭良(わたなべ やすよし)
研究員 野崎 聡(のざき さとし)
研究員 長谷川 功紀(はせがわ こうき)
Tel: 078-304-7124 / Fax: 078-304-7126
お問い合わせ先
神戸研究推進部 企画課Tel: 078-306-3007 / Fax: 078-306-3039
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.N-結合型糖鎖
アスパラギン結合型糖タンパク質糖鎖。糖タンパク質の糖鎖のうち、タンパク質のアスパラギン側鎖のアミド窒素に結合している糖鎖を示す。これに対し、タンパク質のセリンまたはスレオニン側鎖の水酸基に結合している糖鎖は O-型糖鎖とよばれる。 - 2.ポリリジン
アミノ酸であるリジンが直鎖状、または分岐状に重合したポリペプチドの総称。 - 3.高速6π-アザ電子環状反応
1-アザトリエンの末端炭素原子と窒素原子が結合してピリジン誘導体を与える反応をアザ電子環状反応と呼ぶ。この反応は古くから良く知られていたものの、長い反応時間と高い反応温度が必要とされ、さらに収率も良くなかったことから積極的に合成法として活用されることは少なかった。しかし1998年に、アザ電子環状反応を強力に促進させる置換基効果が発見されて以来、この“高速アザ電子環状反応”は天然物の合成に限らず、生物分野や医療分野への応用、例えば、生体分子や細胞の標識、あるいはエンジニアリングのための次世代クリック型反応として大きな注目を集めるようになった。
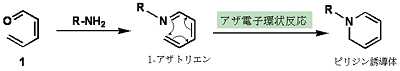
- 4.ポリリジン型デンドリマー
分岐状(デンドリマー状)に重合させたポリリジン。 - 5.プロパルギルグリシン
アミノ酸であるグリシンのα-位にプロパルギル基が置換された非天然アミノ酸。 - 6.Huisgen[2+3]環化反応
1961年にR.ヒュスゲン(R. Huisgen)によって、アジド(N3原子団を持つ化合物)とアルキン(炭素-炭素三重結合を持つ化合物)が[3+2]型の付加環化反応を起こし、1,2,3-トリアゾールを形成することが見いだされた。この1,3-双極子付加環化反応は、Huisgen反応と呼ばれている。 - 7.自己活性化クリック反応
1価の銅を活性化剤として用いるHuisgen反応において、反応するアジド基やアセチレン基の隣接位にヒスチジンが存在すると反応が著しく促進される、または反応が良好に進行することが、2007年、大阪大学の田中克典、深瀬浩一らによって発見された。この活性化反応を自己活性化クリック反応と呼ぶ。 - 8.非還元末端
糖鎖構造において、グリコシド性ヒドロキシル基の存在する末端を還元末端、その反対側を非還元末端という。 - 9.Neuα(2-6)Gal構造
ノイラミン酸(シアル酸)が、ガラクトースの6位の水酸基とα結合を介して結合する2糖構造。 - 10.アシアロ糖鎖
糖鎖構造の非還元末端にシアル酸が付加していない糖鎖。通常 N-結合型糖鎖の場合には、アシアロ糖鎖ではガラクトースが非還元末端に存在する。
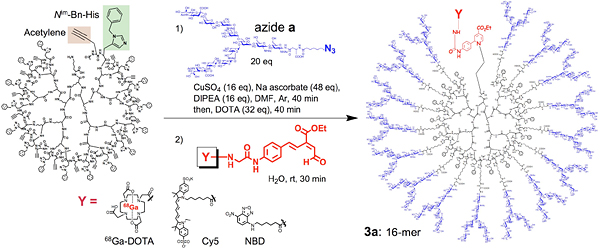
図1 糖鎖クラスターの合成
ポリリジン型デンドリマーの末端に導入したプロパルギルグリシン(左)に対して、銅媒介によるHuisgen[2+3]環化反応(中央、1)を用いて、N-結合型糖鎖を効率的に導入した(右)。この際、ヒスチジン誘導体を活性化剤とする自己活性化クリック反応を実施し、さまざまな構造を持つ複合型N-結合型糖鎖を、室温40分という温和な反応条件の下、定量的にクラスター化することに成功した。さらに、糖鎖クラスター末端のアミノリンカーに対して、高速6π-電子環状反応により、放射性核種である68Gaや近赤外線に吸収を持つ蛍光物質Cy5(670nm、赤色)(中央、2)で効率的に標識した。
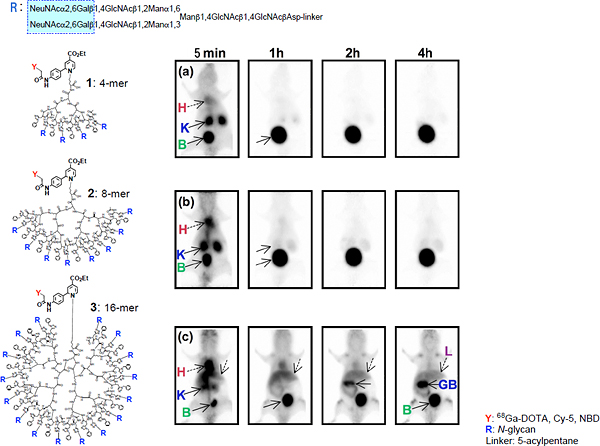
図2 デンドリマーの分岐数が生体内動態に及ぼす影響
糖鎖を4分子または8分子持つクラスターは、5分以内に速やかに腎臓から排出されるのに対して、糖鎖を16分子持つクラスターは、血中での滞留性が著しく向上し、4時間後に主に肝臓に集積し、その後腎臓を経た膀胱からの排出に加えて、胆のうを経てゆっくりと消化管から排出されることが判明した。
H:心臓、K:腎臓、L:肝臓、B:膀胱(ぼうこう)、GB:胆のう
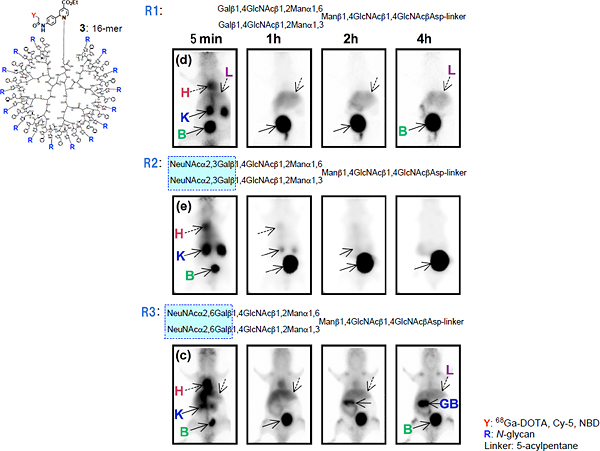
図3 糖鎖構造が代謝や集積に及ぼす影響
アシアロ糖鎖(R1)の場合には、アシアロ糖タンパク質受容体を介した肝臓への集積と、腎臓からの速やかな体外排出を観察した。2つのNeuα(2-3)Gal非還元末端構造を持つ糖鎖(R2)の場合では、Neuα(2-6)Gal構造を持つ糖鎖(R3)の場合とは劇的に異なり、腎臓から5分程度で速やかに排出する。
H:心臓、K:腎臓、L:肝臓、B:膀胱(ぼうこう)、GB:胆のう
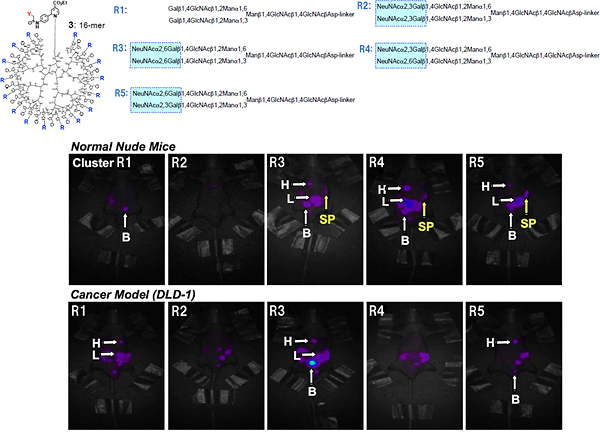
図4 がんモデルマウスにおける糖鎖動態の変化
正常マウス(BALB/cヌードマウス)(上段)および大腸がん細胞株DLD-1担がんモデルマウス(下段)へCy5標識糖鎖クラスターを尾静脈投与し蛍光イメージング装置で観察した。その結果、正常マウスでは速やかに代謝されたアシアロ糖鎖(R1)は、がんモデルマウスでは生体内安定性が著しく向上した。また、少なくとも1つのNeuα(2-6)Gal構造を有する糖鎖クラスターR3、およびR4,5では、正常マウスでは最終的に脾臓に集積したのに対して、がんモデルマウスでは脾臓への集積が認められなかった。
H:心臓、L:肝臓、B:膀胱(ぼうこう)、SP:脾臓
