2011年1月14日
独立行政法人 理化学研究所
夕方の遺伝子発現の仕組みと役割を初めて解明
-体内時計の動作原理が"遅れを持った負のフィードバック"であることを証明-
ポイント
- Cry1遺伝子の夕方の発現は昼と夜の発現制御の組み合わせで生成
- Cry1遺伝子が昼に発現すると体内時計は弱くなり、夜に発現すると遅くなる
- 体内時計の転写ネットワークは単純な2つの歯車の組み合わせで成り立つと提唱
要旨
独立行政法人理化学研究所(野依良治理事長)は、体内時計のリズムを生み出す転写ネットワーク※1の基本的な作動メカニズムを明らかにしました。これまで重要と考えられてきた夕方の遺伝子発現の仕組みを解明し、体内時計の転写ネットワークの動作原理が“遅れを持った負のフィードバック※2”であることを明らかにしました。理研発生・再生科学総合研究センター(竹市雅俊センター長)システムバイオロジー研究プロジェクトの上田泰己 プロジェクトリーダー、鵜飼‐蓼沼磨貴 テクニカルスタッフおよび山田陸裕 基礎科学特別研究員と、米国・メンフィス大のアンドリュー・リウ(Andrew C. Liu)教授ら、スイス・フリブール大のユルゲン・リッペルガー(Jürgen A. Ripperger)教授による共同研究の成果です。
哺乳類の体内時計の転写ネットワークでは、朝・昼・夜に遺伝子を発現させる3つの制御DNA配列※3と約20個の転写制御因子※4が互いに制御し合う複雑な「設計図」が描かれてきました。研究グループはこれまでに、この設計図によって実際に昼と夜の遺伝子発現を説明できることを明らかにしましたが、朝については十分に解明できていませんでした。一方、朝の遺伝子発現を強く抑制するCry1遺伝子が夕方に発現することで形成される“遅れを持った負のフィードバック”が体内時計の転写ネットワークの動作原理であると考えられており、Cry1遺伝子を夕方に発現させるメカニズムの解明が待たれていました。今回の研究では、Cry1遺伝子を詳細に解析し、昼と夜の制御DNA配列の組み合わせがCry1遺伝子を夕方に発現させることを突き止めました。これにより、朝の遺伝子発現が夕方に発現を抑制されることで実現している可能性が示唆されました。さらに、Cry1遺伝子の発現時刻を人工的に昼から夜の間で変化させたところ、体内時計の振動の振幅や周期に大きく影響することが分かりました。この発見は、体内時計の転写ネットワークの動作原理が“遅れを持った負のフィードバック”であることを初めて証明したものです。これは、哺乳類体内時計システムの理解を大きく前進させる成果となります。
本研究は、文部科学省科学研究費補助金「ゲノム特定領域研究(生命システム情報)」の一環として行われ、一部は、上原記念生命科学財団、三菱財団の助成により進められました。本研究成果は米国の科学雑誌『Cell』(1月21日号)への掲載に先立ち、オンライン版(1月13日付け:日本時間1月14日)に掲載されます。
背景
体内時計は、バクテリア、ショウジョウバエ、マウス、ヒトなど多くの生物種に存在し、ヒトでも睡眠・目覚めをはじめとするさまざまな生理機能に影響を与える重要なシステムです。この体内時計システムは、約24時間周期で数多くの遺伝子がリズミカルに機能する複雑な遺伝子ネットワークから成り立っていると考えられています。これまでに、哺乳類の体内時計の転写ネットワークについては、それぞれ朝・昼・夜の基本時刻に遺伝子を発現させるためのゲノム上の3つの制御DNA配列と約20個の転写制御因子が組み合わさり、互いに制御し合う複雑な「設計図」が描かれてきました。
研究グループは、この「設計図」が実際に基本時刻のうち昼・夜の遺伝子発現を説明できることを明らかにしてきましたが(2008年9月22日プレスリリース)、朝については十分に解明できていませんでした。一方、朝の遺伝子発現を強く抑制するCry1遺伝子が、夕方に発現することで形成される“遅れを持った負のフィードバック”が体内時計の転写ネットワークの動作原理であると考えられてきました。しかし、遅れの重要性について実験的な検証はされておらず、負のフィードバックに重要なCry1遺伝子を基本時刻から外れた夕方に発現させる制御メカニズムも未解明のままでした。
研究グループは今回、Cry1遺伝子を夕方に発現させる制御メカニズムを解明するとともに、Cry1遺伝子の発現制御を人工的に改変することで、Cry1遺伝子が関与する“遅れを持った負のフィードバック”の遅れの大きさに変化を与え、その重要性を検証しました。
研究手法
(1)Cry1遺伝子を夕方に発現させる制御メカニズムの解析
研究グループはこれまでに、培養細胞系を用いた体内時計システムの観察手法を構築しています。今回の研究では、体内時計を持ったマウスNIH3T3細胞を利用して、Cry1遺伝子を夕方に発現させる制御メカニズムを解析しました。具体的には、プラスミドDNA※5上に、Cry1遺伝子のプロモーター※6などの発現制御配列※7と、レポーター遺伝子(Luc;ルシフェラーゼ※8)を配置し、NIH3T3細胞へ導入しました。発現制御配列が誘導する発現時刻に応じてLuc遺伝子が発現するため、その発光を測定することで、プラスミドDNA上の発現制御配列がいつLuc遺伝子の発現を誘導したかを検出できます。この発光の変動を数日間観測して、発現のピーク時刻や発現振動の周期などを測定し、Cry1遺伝子を夕方に発現させる制御メカニズムを解析しました。
(2)Cry1遺伝子の発現時刻の改変が体内時計へ与える影響の解析
次に、Cry遺伝子群を欠損することで体内時計を失った細胞(Cry1-/-:Cry2-/-細胞※9)を用いて、プラスミドDNAでCry1遺伝子などを導入する実験を行いました。この細胞を用いると、プラスミドDNA上のCry1遺伝子の発現制御メカニズムが十分に生体内のメカニズムを反映していれば、Cry1遺伝子の発現により細胞の体内時計は復活し、振動が回復します。つまり、(1)の実験で解析した発現制御メカニズムの正確さを検証することができます。また、人工的に発現制御を改変してCry1遺伝子をさまざまな時間に発現させることで、Cry1遺伝子の発現時刻の遅れの大きさが体内時計にどのような影響を与えるか観察することができます。
研究成果
(1)Cry1遺伝子を夕方に発現させる制御メカニズムの解明
体内時計を持ったNIH3T3細胞を用いて、Cry1遺伝子のプロモーター領域が誘導する発現時刻をレポーター遺伝子の活性を指標にして検出したところ、昼に発現のピークを迎えることが分かりました。生体内でCry1遺伝子は夕方に発現することが知られており、生体内では何らかの要素がCry1遺伝子の発現を遅らせていると考えられました。そこで、ゲノム配列の詳細な解析を行ったところ、Cry1遺伝子のイントロン領域に夜配列(夜の制御DNA配列)を見つけました。このCry1遺伝子のイントロン(夜)とプロモーター(昼)とを組み合わせてレポーター遺伝子の発現時刻を観察すると、レポーター遺伝子は夕方に発現のピークを示しました。これにより、Cry1遺伝子は、昼配列と夜配列の組み合わせで夕方に発現していることが明らかになりました(図1)。
次に体内時計を失ったCry1-/-:Cry2-/-細胞を用いて、Cry1遺伝子のイントロン(夜)とプロモーター(昼)とを組み合わせてCry1遺伝子を夕方に発現させたところ、Cry1-/-:Cry2-/-細胞が失っていた体内時計が回復しました。体内時計が回復したことから、昼と夜の制御DNA配列の組み合わせが、生体内でCry1遺伝子を夕方に発現させるメカニズムであることを突き止めました。すでにCry1遺伝子が朝の制御DNA配列を強く抑制することが知られており、今回の結果により、朝の遺伝子発現がその反対側の夕方に遺伝子発現を抑制されることで実現している可能性が示唆されました。これは、哺乳類の体内時計システム解明に向けた大きな前進につながる成果となります。
(2)Cry1遺伝子の発現時刻の改変による体内時計への影響の解析
研究グループは、Cry1-/-:Cry2-/-細胞中でCry1遺伝子を発現させる時、発現制御を人工的にさまざまに改変し、Cry1遺伝子の発現する時刻を昼から夜の間で変えてみました。すると、Cry1遺伝子の発現が夕方より昼に寄るほど(“遅れ”が小さくなるほど)Cry1-/-:Cry2-/-細胞に回復した体内時計の振動の振幅は弱くなりました。一方、Cry1遺伝子の発現が夜に寄るほど(“遅れ”が大きくなるほど)回復した体内時計の振動の周期が延び、遅くなることが分かりました(図2)。これは、Cry1遺伝子の発現の遅れを生み出すメカニズムを初めて解き明かすとともに、体内時計の転写ネットワークの動作原理が”遅れを持った負のフィードバック”であることを初めて証明したものです。米国のテキサス農工大(Texas A&M University)のポール・ハーディン教授(Dr. Paul E. Hardin)らにより遅れを持った負のフィードバックの重要性が提唱されてから(Nature, 343, 536-40, 1990)、21年目にしてそのメカニズムを解明したことになります。
(3)時計遺伝子の時刻制御メカニズムのモデルを提案
さらに、包括的で定量的な実験とデータ解析により、上記の時刻制御の設計原理が非常にシンプルなベクトルモデルで近似的に説明できることを示しました(図3)。このモデルは、今回の研究成果だけでなく、これまで研究グループが解明してきた、昼と夜をはじめとするさまざまな時刻の遺伝子発現の設計原理をも説明可能です。今後、より多くの時刻生成の設計原理の解析に役立つことが期待されます。
今後の期待
今回の結果と、以前発表した昼と夜の設計原理を考え合わせ、研究グループは、体内時計の3つの基本時刻を作る最小単位の転写ネットワークモデルを提案しました(図4)。このネットワークは、2つのより単純な、しかしそれぞれ独立に発振可能と考えられている歯車が組み合わさった構造から成り立っています。1つ目の歯車は“Repressilator(リプレッシレーター)※10”、2つ目は“遅れをもった負のフィードバック”です。果たしてこの構造を人工的に模倣することで、概日時計の転写ネットワークを再現できるのでしょうか?あるいは、まだ解明されていない制御が潜んでおり、ネットワークは再現できないのでしょうか?体内時計システムを完全に理解するには、引き続きメカニズムの研究を重ねる必要があります。しかし、今回の研究成果は、哺乳類の体内時計の転写ネットワークの動作原理が“遅れを持った負のフィードバック”のメカニズムであることを証明したものであり、複雑な哺乳類の体内時計システムの理解に一歩近づいたといえます。このように体内時計システムの理解が進んだことで、リズム障害をはじめとする体内時計の異常によって引き起こされる疾患の、より効果的な診断や治療法の開発へつながることが期待できます。
発表者
理化学研究所
発生・再生科学総合研究センター システムバイオロジー研究プロジェクト
プロジェクトリーダー 上田 泰己(うえだ ひろき)
お問い合わせ先
神戸研究所研究推進部 広報国際化室
Tel: 078-306-3092 / Fax: 078-306-3090
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.転写ネットワーク
ある遺伝子が他の遺伝子の発現を制御するつながりのこと。 - 2.遅れを持った負のフィードバック
ある遺伝子が他の遺伝子の発現を制御し、この制御のつながりが巡り、元の遺伝子へ負の制御となって戻ってくる回路一般のこと。発現抑制の制御が遅れて戻ってくることで、各遺伝子発現の振動が可能であると考えられている。ここでは特に、”遅れを持った負のフィードバック”に含まれる特定の構造(「ある遺伝子が次の遺伝子の発現を活性化する」セットが2つつながり、その後で「ある遺伝子が最初の遺伝子の発現を抑制する」制御としてスタート地点へ戻る回路)を指すこともある( 図4参照)。 - 3.制御DNA配列
体内時計システムに関与する遺伝子(時計遺伝子)が朝・昼・夜のどの時刻に発現するかを規定するDNA上の短い配列。 - 4.転写制御因子
ここでは特に、制御DNA配列に結合して機能し、その遺伝子の発現の制御に関与する時計遺伝子。 - 5.プラスミドDNA
細胞が持つゲノムDNAとは別に、外から細胞へ遺伝子導入する際に用いるDNAの一種。プラスミドDNAには、遺伝子発現を誘導する配列や遺伝子配列を挿入しておく。 - 6.プロモーター
その遺伝子からの遺伝子産物を「いつ」・「どこで(どの細胞で)」・「どのくらい」作るのかに関与するDNA領域のこと。 - 7.発現制御配列
プロモーターなどを含む、「いつ」・「どこで(どの細胞で)」・「どのくらい」遺伝子を発現させるかをつかさどるDNA領域のこと。ここでは特に、朝・昼・夜の遺伝子発現時刻を規定する3つの短い発現制御配列を、制御DNA配列( ※3参照)と呼ぶ。 - 8.ルシフェラーゼ(Luc)
ホタルの発光タンパク質。発光物質が光を放つ化学反応を触媒する作用を持つ酵素で、培養細胞の培養液に発光物質である基質ルシフェリンを添加すると、ルシフェラーゼの作用により光が発生する。 - 9.Cry1-/-: Cry2-/-細胞
ゲノムDNA上の2つの Cry遺伝子( Cry1と Cry2)の両方を働かないようにした細胞。 Cry遺伝子の一方だけを欠損しても、細胞の体内時計は振動を示すため、両者を働かないようにして細胞の体内時計を止め、 Cry1遺伝子の発現メカニズムの解析を可能とした細胞。 - 10.Repressilator(リプレッシレーター)
「ある遺伝子が次の遺伝子の発現を抑制する」セットが3つつながり、ループ構造を形成した、転写抑制活性だけでできている回路。一定の周期を持つ安定した自律振動が可能であると考えられている。
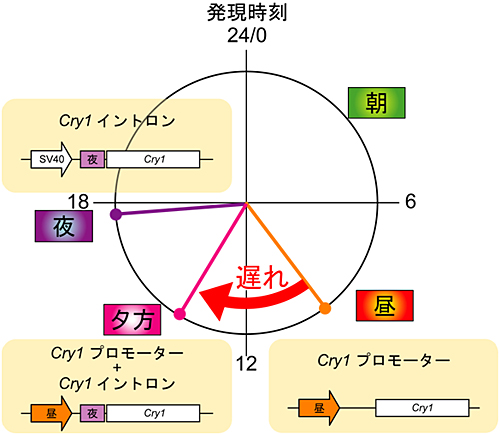
図1 Cry1遺伝子を夕方に発現させるメカニズム
24時間時計上の発現時刻に、各発現メカニズムの模式図を配置した。Cry1遺伝子のプロモーター領域が誘導する昼の発現が、イントロン領域の夜の配列の存在により“遅れる”ことで、Cry1遺伝子が夕方に発現する。これは、プロモーター領域とイントロン領域にそれぞれ存在する昼と夜の制御DNA配列の影響が合わさった結果であることが分かった。太矢印:プロモーター(SV40は発現に振動を示さないプロモーター)、長方形:イントロン。
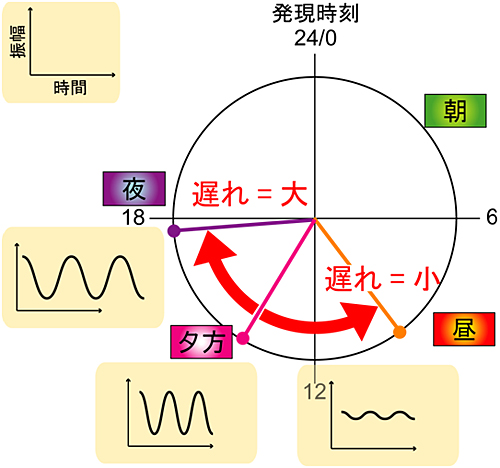
図2 Cry1遺伝子発現の遅れの大きさの重要性
Cry1-/-:Cry2-/-細胞中でCry1遺伝子を発現させる時刻を昼から夜の間で変化させた。24時間時計上の各時刻にCry1遺伝子が発現した時刻と、その時に回復した体内時計の振幅と周期の模式図を配置。生体内と同じ時刻(夕方)にCry1遺伝子を発現させた時に回復する体内時計に対し、Cry1遺伝子を発現させる時刻を変えると、周期や振幅に大きな影響が現れた。Cry1遺伝子の発現が夕方より昼に寄るほど("遅れ"が小さくなるほど)回復した体内時計の振動の振幅は減弱した。Cry1遺伝子の発現が夜に寄るほど("遅れ"が大きくなるほど)回復した体内時計の振動の周期が延びた。
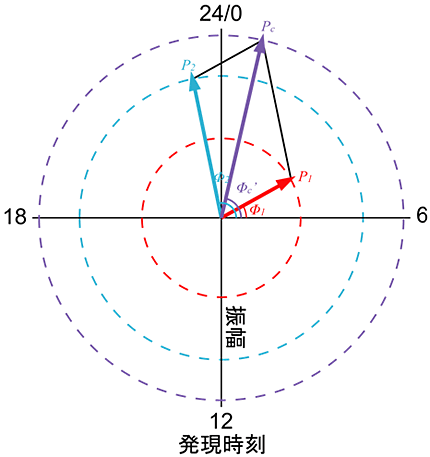
図3 発現時刻制御の設計原理を表すベクトルモデル
時計遺伝子の発現を制御する制御DNA配列の強さと発現時刻をベクトルで表現することで、2つの制御DNA配列の組み合わせによって得られる発現時刻を近似的に説明できる。今回の、[Cry1遺伝子のプロモーターの時刻:昼] + [Cry1遺伝子のイントロンの時刻:夜] = [Cry1遺伝子が発現する時刻:夕方] を説明するだけではなく、その他の時刻の組み合わせも説明できることが分かった。
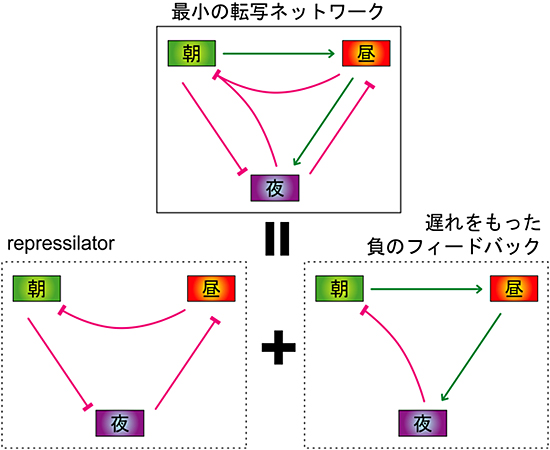
図4 体内時計の最小単位の転写ネットワーク
これまでの成果から、体内に存在する実際の複雑なネットワークを単純化して予測した、体内時計の3つの基本時刻(朝・昼・夜)を創出する最小単位の転写ネットワーク(上)。これまでに明らかにしていた昼の設計原理(朝の転写活性化と夜の転写不活性化)と夜の設計原理(昼の転写活性化と朝の転写不活性化)に加え、今回の成果が示唆する朝の設計原理(昼と夜の制御で創出される夕方の転写不活性化)を含む。この転写ネットワークは、2つのより単純な、しかし独立して発振可能と考えられている歯車(“Repressilator”と“遅れをもった負のフィードバック”)が組み合わさった構造を持つ(下)。矢印:転写の活性化、T字:転写の不活性化
