2011年1月27日
独立行政法人 理化学研究所
神経幹細胞が脳室側だけで細胞分裂する仕組みを解明
-神経幹細胞の分化と細胞極性維持の協調的制御が増殖位置を決定-
ポイント
- 神経幹細胞の増殖の仕組みを、ゼブラフィッシュで分子遺伝学的に解析
- 神経幹細胞の分化と細胞極性の維持を協調的に制御する機構を発見
- 神経発生機構や脳の進化の理解に重要な手がかりを得る
要旨
独立行政法人理化学研究所(野依良治理事長)は、モデル動物のゼブラフィッシュ※1を用いて、脳を構成するさまざまな細胞に分化する「神経幹細胞※2」が、未分化性と細胞極性※3の協調的な維持によって、脳の内側(脳室側)だけで増殖する仕組みを解明することに初めて成功しました。理研脳科学総合研究センター(利根川進センター長)発生遺伝子制御研究チームの岡本仁チームリーダー、大畑慎也研究員と国立大学法人東京大学(濱田純一総長)総合文化研究科及び農学生命科学研究科、独立行政法人沖縄科学技術研究基盤整備機構(シドニー・ブレナー理事長)との共同研究による研究成果です。
神経幹細胞は、細胞周期に応じて脳の内側(脳室側)から外側(脳膜側)までエレベーターのように細胞核を移動させ、核が脳室側に存在する時にだけ細胞分裂を行い、増殖します。しかし、どのような分子機構で脳室側でだけ細胞分裂をするのかは不明のままで、神経発生学上の中心的課題として残されていました。
研究チームは、脊椎動物の中で最も単純な脳を持つゼブラフィッシュを用い、神経幹細胞の細胞極性を維持するために必須な因子(細胞極性制御因子)の機能を失った突然変異体を単離・解析しました。この変異体では、神経幹細胞が「中間神経前駆細胞※4」へと分化し、より脳膜側で細胞分裂を行っていました。この結果から、細胞極性制御因子が、神経幹細胞の分化と細胞極性維持の両方を協調的に制御することで、神経幹細胞の細胞分裂の場所を脳室側に限定していることが分かりました。
今回の成果は、細胞極性制御因子による精巧な神経系形成の分子機構を解明した世界初の発見となりました。今後さらにこの研究を進めることによって、神経幹細胞の増殖の全体像が明らかになることが期待できます。
本研究成果は、米国の科学雑誌『Neuron』(1月27日号)に掲載されます。成果の一部は科学研究費補助金とJST 戦略的創造研究推進事業 チーム型研究(CREST)「生物の発生・分化・再生」研究領域における研究課題「Genetic dissectionによる神経回路網形成機構の解析」(研究代表者:岡本仁)によって得られました。
背景
神経系は、神経細胞とその標的細胞で構成される精巧で複雑なネットワークによって機能することから、その形成は非常に精密に制御されなければなりません。また、神経発生の異常は、さまざまな神経疾患を引き起こすことから、神経発生機構の理解は神経科学上だけでなく、医学・薬学上でも重大な課題であるといえます。
ヒトなどの生物の脳を構成するさまざまな細胞に分化する「神経幹細胞」は、脳の内側(脳室側)から外側(脳膜側)まで伸びる突起を持つ細長い細胞です(図1)。そして、細胞周期に応じて、その細胞核をエレベーターのように移動させ、核が脳室側に位置する時だけ細胞分裂を行い、増殖します。機能的な神経系を構築するためには、神経幹細胞が特定の位置で秩序を持って増殖することが必要不可欠であると考えられます。しかし、どのような分子機構で脳室側だけで細胞分裂をするのかは不明のままで、神経発生学上の中心的課題として残されていました。
これまでに、神経幹細胞の細胞極性を維持するために必須な因子(細胞極性制御因子)の機能を阻害すると、本来脳室側だけでしか増殖しないはずの神経幹細胞が、より脳膜側で増殖するようになることが分かっていました。また、ショウジョウバエを用いた遺伝学的研究によって、細胞極性制御因子が神経幹細胞から神経細胞への分化を抑制する因子(分化抑制因子)を制御することが明らかとなっていました。
そこで、研究チームは分子遺伝学的な手法によって、①細胞極性制御因子がどのような分子機構で神経幹細胞の増殖位置を制御しているのか、②細胞極性制御因子がどのように神経幹細胞の分化抑制因子を制御しているか、の解明に着手しました。
研究手法
研究チームは、遺伝子にランダムに変異を引き起こす化合物「N-ethyl-N-nitrosourea(ENU)」をゼブラフィッシュに投与し、神経系の発生に異常を持つさまざまな突然変異体を単離・同定してきました(和田、岡本ら2005 Development;和田、岡本ら2006 Development;田中、岡本ら2007 Development;大畑、木下、岡本ら 2009 Development)。本研究では、これらの突然変異体のうち、細胞極性制御因子の機能を失った突然変異体の解析を行いました。
ゼブラフィッシュをモデル生物として使うことのメリットの1つは、遺伝子発現を容易に操作できることです。遺伝子発現は、ゲノムDNAからメッセンジャーRNA(mRNA)が転写され、さらにmRNAがタンパク質へと翻訳されることによって行われます。ゼブラフィッシュの卵に、試験管内で合成したmRNAを注入することによって、遺伝子を過剰に発現させることができます。一方、mRNAと相補的な塩基配列を持つ「モルフォリノオリゴヌクレオチド」という試薬を注入すると、遺伝子の発現を抑制することができます。研究チームは、これらの手法を用いて細胞極性制御因子や分化抑制因子の働きを調べました。
研究成果
(1)細胞極性制御因子は分化抑制因子を制御して神経幹細胞の細胞分裂位置を規定する
研究チームは、細胞極性制御因子の遺伝子配列に、分化抑制因子と結合するタンパク質が共通して持つ部分配列が存在することに気づきました。そして、試験管内での実験によって、細胞極性制御因子が分化抑制因子と直接結合し、その活性を制御することを明らかにしました。
細胞極性制御因子の機能を失ったゼブラフィッシュ突然変異体では、分化抑制因子の活性が顕著に減少していました。これは、細胞極性制御因子が分化抑制因子の活性を制御する機能を持つことを示しています。研究チームは、この突然変異体では、神経幹細胞が神経細胞へと分化し、増殖細胞数が減少していると考えました。しかし、予想に反して増殖細胞数は減少しておらず、本来であれば増殖細胞がほとんど観察されないはずの、より脳膜側で増殖する細胞の数が、約3倍と顕著に増加していました(図2b)。
これまで、哺乳類の神経発生の過程で、神経幹細胞の分化抑制因子の活性を低下させると、神経幹細胞が中間神経前駆細胞へと分化し、より脳膜側で増殖することが知られていました。そこで研究チームは、ゼブラフィッシュ突然変異体で観察した脳膜側で増殖する細胞が、この中間神経前駆細胞と同じような性質を持っているのではないかと仮説を立てました。ゼブラフィッシュ突然変異体で中間神経前駆細胞のマーカーの発現を調べたところ、これらの細胞が中間神経前駆細胞のマーカーを発現していることが分かりました。さらに、分化抑制因子の活性型mRNAをゼブラフィッシュ突然変異体に注入すると、脳膜側での異所的な増殖細胞数が顕著に減少しました(図2c)。これらの結果から、細胞極性制御因子が分化抑制因子の活性を制御することによって、神経幹細胞の細胞分裂位置を脳室側に限定する、という仕組みが判明しました。
(2)神経幹細胞の分化抑制因子は細胞極性を転写非依存的に維持する
これまでに、細胞極性制御因子が網膜の神経幹細胞の細胞極性維持に必須であることは明らかにされていました。研究チームは、脳の神経幹細胞においても細胞極性制御因子が同様の働きをしているのではないかと考えました。正常なゼブラフィッシュの脳では、細胞極性マーカーが脳室面にだけ局在します。一方、細胞極性制御因子の機能を失ったゼブラフィッシュ突然変異体の脳では、このような細胞極性マーカーの集積は観察されず、脳室側から離れた場所に散らばって存在していることを発見しました。このことから、細胞極性制御因子が、脳においても神経幹細胞の細胞極性を維持するために必須の役割をしていることが明らかになりました。さらに、研究チームは、この突然変異体に分化抑制因子の活性型mRNAを注入すると、散在していた細胞極性マーカーが再び脳室面に集積するという興味深い現象も発見しました。
分化抑制因子は、遺伝子発現制御によって神経幹細胞の分化を抑制することが知られています。非常に驚いたことに、遺伝子発現制御の能力をなくした分化抑制因子のmRNAを突然変異体に注入しても細胞極性の回復が認められたことから、分化抑制因子による細胞極性の制御には遺伝子発現制御は必要ないことが判明しました。この一連の結果から、分化抑制因子は、細胞極性制御因子による活性制御を受け、遺伝子発現制御によって神経幹細胞の未分化性を維持するとともに、遺伝子発現制御によらない経路で神経幹細胞の細胞極性を維持していることが明らかとなりました(図3)。
今後の期待
今回の研究から、神経幹細胞の細胞極性制御因子が分化抑制因子を制御して、神経幹細胞の未分化性と細胞極性を同時に維持し、細胞分裂の場所を脳室側に制限していることが分かりました。今後のさらなる研究によって、神経幹細胞の細胞分裂の場所を決める分子機構の全体像が明らかとなり、神経発生機構への理解が深まると、神経疾患に対する治療へも貢献することが期待できます。
また、今回の研究で、神経幹細胞の細胞極性制御因子の変異によって分化抑制因子の活性が低下すると、中間神経前駆細胞様の細胞が顕著に増加することが判明しました。進化に伴う脳の大きさの増大には、中間神経前駆細胞の数の増加が重要な役割を果たしているのではないかと考えられていることから、本研究は脳の進化の理解にも重要な手がかりを与えるものと期待されます。
発表者
理化学研究所
脳科学総合研究センター 回路機能メカニズムコア 発生遺伝子制御研究チーム
チームリーダー 岡本 仁(おかもと ひとし)
Tel: 048-467-9712 / Fax: 048-467-9714
お問い合わせ先
脳科学研究推進部企画課Tel: 048-467-9757 / Fax: 048-462-4914
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.ゼブラフィッシュ
ゼブラフィッシュ(Danio rerio)はインド原産の小型熱帯魚で、飼育が容易、多産、世代交代期間が短い、遺伝子操作が容易などの特長を持つことから、発生生物学を研究するのに非常によいモデル実験動物として用いられている。

- 2.神経幹細胞
脳を構成する複数の種類の細胞(神経細胞、アストロサイト、オリゴデンドロサイト)に分化する「多分化能」と、新たな神経幹細胞を生み出す「自己複製能」を持った細胞。 - 3.細胞極性
細胞内が持つ空間的な極性の総称。細胞膜や分子の成分が偏って存在することに由来する。極性は細胞の空間的な制御において重要な役割を持ち、細胞が正常に働く上で必須の要素である。細胞が正常な細胞極性を形成・維持しているかどうかは、細胞内の特定の位置に偏って存在する細胞極性マーカーの局在を観察することによって調べることができる。 - 4.中間神経前駆細胞
神経幹細胞から生み出された後に、脳室から離れた部位で細胞分裂を1回だけ行い、神経細胞だけを生み出す細胞 (図1参照)。
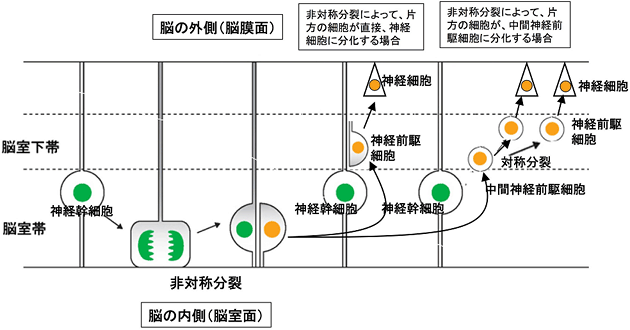
図1 神経幹細胞が細胞周期に応じて核を移動させ脳室側だけで分裂する模式図
脳のさまざまな細胞に分化する「神経幹細胞」は、脳の内側(脳室側)から外側(脳膜側)まで突起を伸ばした細長い細胞である。細胞周期に応じて、その核をエレベーターのように移動させ、核が脳室側に位置する時だけ非対称細胞分裂を行う。非対称細胞分裂によって生み出された2つの細胞のうち、片方が神経幹細胞に戻る一方で、もう片方の細胞は直接または中間神経前駆細胞を経て、神経細胞に分化する。
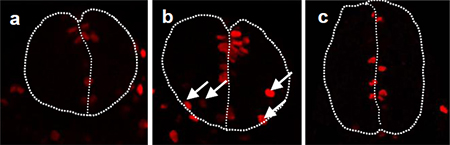
図2 分化抑制因子が細胞極性制御因子の制御を受けて神経幹細胞の細胞分裂位置を規定する様子
(a)野生型胚、(b)細胞極性制御因子の突然変異体胚
(c)分化抑制因子の活性化体mRNAを注入した胚
写真は脳の断面図で、外側の破線は脳の輪郭を、真ん中の破線は脳室面を示している。細胞分裂している細胞をリン酸化ヒストンH3に対する抗体で可視化した(赤)。細胞極性制御因子の突然変異体胚(b)では、脳室側からはずれて、より脳膜側で細胞分裂している(矢印)が、分化抑制因子の活性型mRNAを注入すると(c)、野生型胚(a)と同様に脳室側での細胞分裂に戻る。
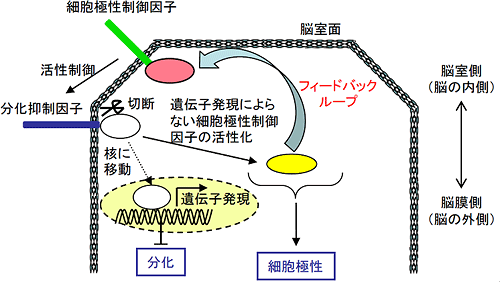
図3 細胞極性制御因子と分化抑制因子による神経幹細胞の分化と細胞極性維持の協調的制御の模式図
神経幹細胞の脳室面に局在する細胞極性制御因子によって、分化抑制因子の活性が制御される。分化抑制因子は、遺伝子発現制御を介して神経幹細胞を未分化な状態に保つ。さらに遺伝子発現制御を介さずに、細胞極性を維持する。これまでの知見から、細胞極性の維持は、正のフィードバックループを形成していると考えられる。神経幹細胞の細胞分裂位置は、分化抑制因子によるこれら2つの役割によって決められる。
