2011年1月27日
独立行政法人 理化学研究所
国立大学法人 東京大学
公立大学法人 横浜市立大学
ビフィズス菌の作る酢酸がO157感染を抑止することを発見
-善玉菌(プロバイオティクス)の作用機構の一端を解明-
ポイント
- ビフィズス菌の産生する酢酸が、腸の上皮細胞のO157に対する抵抗力を増強
- ビフィズス菌のゲノム解析から、酢酸産生亢進につながる新規遺伝子を発見
- 善玉菌(プロバイオティクス)による健康増進や予防医学への応用に期待
要旨
独立行政法人理化学研究所(野依良治理事長)と国立大学法人東京大学(浜田純一総長)、公立大学法人横浜市立大学(本多常高理事長)は、ビフィズス菌※1による腸管出血性大腸菌O157※2の感染抑止には、ビフィズス菌が産生する酢酸が腸管上皮細胞に作用することが非常に重要で、この作用がなければ感染に抵抗性を持たないことを、マウス実験で世界で初めて明らかにしました。理研免疫・アレルギー科学総合研究センター(谷口克センター長)免疫系構築研究チーム/横浜市立大学大学院生命ナノシステム科学研究科(荻原保成研究科長)免疫生物学研究室の大野博司チームリーダー/客員教授、福田真嗣研究員/客員研究員、東京大学大学院新領域創成科学研究科(大和裕幸研究科長)附属オーミクス情報センターの服部正平教授を中心とする共同研究グループ※3の研究成果です。
ヒト腸内常在細菌の一種であるビフィズス菌は、プロバイオティクス※4、いわゆる善玉菌の1つとして、私たちの体に良いといわれています。その一例として、無菌マウス※5に前もってビフィズス菌を投与しておくと、その後のO157による感染死を抑止できることが知られていました。しかし、その分子メカニズムは不明のままでした。今回、研究グループは、最新のマルチオーミクス手法※6、すなわちゲノミクス※7、トランスクリプトミクス※8、メタボロミクス※9を駆使した統合解析手法により、ビフィズス菌が産生する酢酸が腸粘膜上皮※10の抵抗力を増強することで、マウスがO157による感染死を免れることを明らかにしました。また、酢酸合成を亢進するビフィズス菌の遺伝子の同定にも成功しました。
この結果は、マルチオーミクス手法が複雑な宿主-腸内細菌相互作用の解析に効果的であることを証明するとともに、プロバイオティクスの作用メカニズムの一端を初めて明らかにしたものです。プロバイオティクスを健康増進や予防医学へ応用することにより、社会への還元が期待されます。
本研究成果は、科学雑誌『Nature』(1月27日号)に掲載されます。
背景
ヒトをはじめとする動物の腸内には、宿主である動物の体を構成する細胞の数よりもはるかに多い、100兆個にも及ぶ腸内常在細菌叢が存在するといわれています。腸内常在細菌叢と宿主細胞の相互作用は、宿主の健康や病的状態と密接に関係すると考えられており、腸内細菌叢の中には、ビフィズス菌などのように体に良いとされる菌もあります。その作用の1つとして、病原菌による感染を抑制する効果が知られていますが、肝心なその作用の分子メカニズムは不明のままでした。そこで研究グループは、ビフィズス菌が腸管出血性大腸菌O157によるマウス感染死を予防するという実験モデルを用いて、ビフィズス菌による感染死予防効果の分子メカニズムを明らかにすることに挑みました。
研究手法と成果
無菌マウスにO157を104個ほど経口感染させると、マウスは1週間ほどで感染死します。しかし、ある種のビフィズス菌(以下、予防株)をあらかじめ経口投与しておくと、マウスはその後のO157経口感染に抵抗性を持ち、感染死は起きません。一方、あらかじめ経口投与しても、その後のO157感染死を予防することができないビフィズス菌(以下、非予防株)も存在します(図1)。この時、マウスの腸内のO157の菌数や、O157が産生し感染死の直接の原因となるシガ毒素の量は、予防株投与群と非予防株投与群とで違いが見られません。このことから、予防株が直接O157の増殖やシガ毒素産生能を抑制するのではなく、宿主の腸管上皮へ作用することで、間接的にO157感染死を予防していると予想しました。実際、予防株投与群と非予防株投与群で、O157投与後のマウス腸粘膜上皮のトランスクリプトミクスを行い網羅的遺伝子発現を比較したところ、非予防株投与群では、予防株投与群と比較して2倍以上発現が上昇している遺伝子群の中に炎症の存在を示す遺伝子が多く含まれていました。
研究グループは、予防株と非予防株では、腸内で産生する代謝産物(低分子化合物)が異なり、その違いが感染死の予防効果の差となって現れているのではないかと考えました。そこで、ビフィズス菌投与直後(O157投与前)のマウス腸内容物(糞便)中の低分子化合物のメタボロミクスを行い、コンピュータで解析した結果、予防株投与群と非予防株投与群では代謝物産生パターンが大きく異なっていました(図2)。この代謝物産生パターンの違いを詳細に解析したところ、予防株投与群では非予防株投与群と比較して、ブドウ糖などの糖類の量が2分の1以下に減少していることが分かりました。ビフィズス菌は、糖を消費して短鎖脂肪酸※11を産生することから、マウス腸内容物中の短鎖脂肪酸の量を調べたところ、予防株投与群では非予防株投与群と比較して、短鎖脂肪酸の1つである酢酸の量が2倍近く高いことを突き止めました。酢酸は腸粘膜上皮の増殖促進や保護作用を持つとされています。ビフィズス菌を経口投与した後のマウスの腸粘膜上皮のトランスクリプトミクスを行ったところ、これを支持するように、予防株投与群では非予防株投与群と比較して、細胞のエネルギー代謝や抗炎症作用に関係する遺伝子群の発現が2~3倍上昇していました。
この予防株と非予防株における酢酸産生能の違いの原因を探るために、これらのビフィズス菌の全ゲノム配列を解読し、比較ゲノミクスを行いました。その結果、糖代謝に関連する遺伝子の中で、果糖トランスポーター※12遺伝子と予測される2つの遺伝子群が予防株だけに存在することを明らかにすることができました(図3)。予防株と非予防株をブドウ糖、あるいは果糖存在下で培養したところ、ブドウ糖存在下では予防株と非予防株で酢酸産生能に差はありませんでしたが、果糖の存在下では予防株だけが果糖を消費して酢酸を産生することができました。また、果糖トランスポーター遺伝子を破壊した予防株は、もはや感染死の予防効果を持ちませんでした。これらの結果から、同定した果糖トランスポーター遺伝子は、実際に果糖の取り込みに機能するトランスポーターを発現することが分かりました。
O157感染による腸粘膜上皮の炎症所見は、大腸下部で認められます。ブドウ糖が利用できる小腸や大腸上部では、非予防株のビフィズス菌も腸粘膜上皮の保護作用に十分な量の酢酸を産生できますが、ブドウ糖が枯渇する大腸下部では、果糖トランスポーター遺伝子を持つ予防株だけが、果糖から効率よく酢酸を産生し、腸粘膜上皮を保護するため、O157による炎症や感染死を予防できると考えられます(図4)。
今後の期待
今回の結果は、マルチオーミクス手法が複雑な宿主-細菌相互作用の解析に効果的であることを証明することになりました。今後は、無菌マウスのようなモデル系だけではなく、複雑な腸内細菌叢を持つ通常のマウスやヒトの解析に応用することにより、宿主-腸内細菌相互作用の全体像を明らかにしていくことが可能になります。また、プロバイオティクスの作用メカニズムを解析することで、より効果的なプロバイオティクスの開発につながり、健康増進や予防医学へ応用することで、社会への還元が期待されます。
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
免疫系構築研究チーム チームリーダー
公立大学法人横浜市立大学
大学院生命ナノシステム科学研究科
免疫生物学研究室 客員教授
大野 博司(おおの ひろし)
Tel: 045-503-7031 / Fax: 045-503-7068
大学院新領域創成科学研究科
附属オーミクス情報センター
教授 服部 正平(はっとり まさひら)
Tel: 04-7136-4070 / Fax: 04-7136-4084
お問い合わせ先
独立行政法人理化学研究所
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
公立大学法人横浜市立大学 研究推進センター
Tel: 045-787-2442 / Fax: 045-787-2025
国立大学法人東京大学
大学院新領域創成科学研究科 総務係 報道担当
Tel: 04-47136-4004 / Fax: 04-7136-4020
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.ビフィズス菌
ビフィドバクテリウム属( Bifidobacterium)の細菌の総称。ヒトなどの腸内に棲息する細菌の一種で、乳酸桿菌( Lactobacillus)などとともに乳酸菌と総称される。プロバイオティクスとしてヨーグルトなどの発酵乳製品や整腸剤として使用されており、いわゆる善玉菌の1つである。 - 2.O157
O157は大腸菌の血清型の1つであるが、一般的には腸管出血性大腸菌O157:H7のことを指す。O157は代表的な食中毒の原因菌の1つで、シガ毒素を産生する。その症状は軽度の下痢症から、毒素による腸粘膜上皮障害が起こると血便と激しい腹痛を伴う出血性大腸炎、さらに毒素が体内に入ると血球や腎尿細管細胞の破壊による溶血性尿毒症症候群、神経細胞障害による急性脳症などに及び、死に至ることもある。 - 3.共同研究グループ
理研免疫・アレルギー科学総合研究センター免疫系構築研究チーム/横浜市立大学大学院生命ナノシステム科学研究科免疫生物学研究室(大野博司、福田真嗣、長谷耕二、中西裕美子)、東京大学大学院新領域創成科学研究科(服部正平、大島健志朗)のほか、理研基幹研究所(Todd D. Taylor、籐英博)、理研植物科学研究センター(菊地淳)、東京大学大学院農学生命科学研究科(伊藤喜久治、吉村和敏)、大阪大学大学院医学系研究科(戸邉亨)、オーストラリアCSIRO Food and Nutritional Sciences(Julie M. Clarke、David L. Topping)、岐阜大学大学院農学研究科(鈴木徹)、麻布大学獣医学部(森田英利)の研究者各氏。 - 4.プロバイオティクス
人体に良い影響を与える微生物、あるいはそれらを含む食品や医薬品などを指す。Roy・Fuller(1989)による定義では、「腸内フローラのバランスを改善することによって宿主の健康に好影響を与える生きた微生物菌体」とされている。抗生物質(アンティバイオティクス)の使用が、一方では副作用や耐性菌出現の問題を有し、最近では多剤耐性菌の出現などの深刻な問題が話題になっているが、プロバイオティクスはアンティバイオティクスに対して提唱された用語。プロバイオティクスの増殖を促進する物質をプレバイオティクス、プロバイオティクスとプレバイオティクスの両者を混合したものをシンバイオティクスという。 - 5.無菌マウス
内部を無菌状態に保つことのできる特殊な飼育装置(アイソレーター)内で飼育したマウスのことで、腸内細菌や皮膚などの常在菌を含め、細菌や微生物をまったく持たない。 - 6.マルチオーミクス手法
オーミクス(omics)は「すべて・完全」という意味のギリシャ語の接尾辞「ome.オーム」と「学問」を意味する接尾辞「ics,イクス」を合成した造語であり、「研究対象+omics」として、ある研究対象の全体像の研究を表す。マルチオーミクス手法とは、ゲノミクス(genomics)、トランスクリプトミクス(transcriptomics)、メタボロミクス(metabolomics)などのさまざまなオーミクス手法を同時に適用することにより、ある組織、細胞などの状態を総合的に理解しようとする解析法を指す。 - 7.ゲノミクス
ゲノムとは、生物体に含まれる染色体もしくは遺伝子全体、言い換えれば生物の持つ遺伝情報としての全DNA配列を指す。従ってゲノミクスとは、全DNA配列情報について、系統的、網羅的に解析・研究することを意味する。 - 8.トランスクリプトミクス
トランスクリプトームは、ある生物、組織や細胞が発現するすべての遺伝子転写産物を表す。従ってトランスクリプトミクスは、ある組織や細胞が発現する遺伝子転写産物を網羅的に定量することを意味する。マイクロアレイを用いる方法や、次世代シーケンサーを用いた大量シーケンシングによる方法などがある。 - 9.メタボロミクス
メタボロームとは、ある組織やコンパートメント、細胞に含まれるすべての代謝産物、代謝中間体などの小分子全体を表す用語。メタボロミクスとは、このメタボロームを網羅的に測定・解析することを意味する。NMR(核磁気共鳴)装置を用いた方法、キャピラリー電気泳動やクロマトグラフィーと質量分析装置を組み合わせた方法などがある。 - 10.腸粘膜上皮
腸管や呼吸器などの体内外の境界となる組織は、粘膜上皮と呼ばれる種類の細胞層で覆われている。腸粘膜上皮は消化した栄養素の体内への吸収という機能と同時に、体内外の境界で、腸内細菌叢や、食物とともに口から入ってくる病原体を含む微生物などの異物の侵入を防ぐ物理的バリアーとしての役割を果たしている。 - 11.短鎖脂肪酸
一般式CnHmCOOHで表される長鎖炭化水素の一価のカルボン酸を脂肪酸といい、その一部で炭素数6以下のものを短鎖脂肪酸と呼ぶ。具体的には、酢酸、プロピオン酸、イソ酪酸、酪酸、イソ吉草酸、カプロン酸、乳酸、コハク酸を指す。 - 12.果糖トランスポーター
細菌や真核生物の細胞表面には、糖やアミノ酸などのさまざまな低分子化合物を特異的に取り込んだり汲み出したりするタンパク質があり、これらをトランスポーターと総称する。果糖トランスポーターは、果糖を特に強く認識し輸送するトランスポーターである。
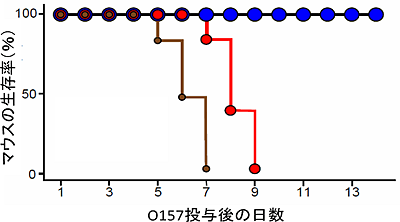
図1 O157投与後のマウスの生存曲線
無菌マウスにO157を単独(茶)、あるいはO157投与の1週間前に予防株(青)もしくは非予防株(赤)のビフィズス菌を108個、経口にて前投与し、その後の感染死の有無を経過観察した。非予防株投与群ではO157単独投与群と似た経過で、O157投与後7~9日で全個体が感染死したが、予防株投与群ではO157投与後14日まで全個体が生存した。
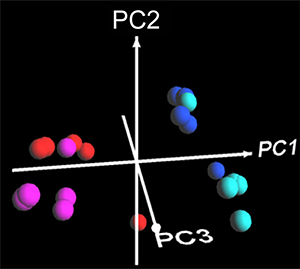
図2 マウス腸内容物(糞便)中の代謝産物の網羅的解析
マウス糞便抽出物中の低分子化合物をNMRにより網羅的に測定し、各個体の前代謝物測定値を1つのデータセットとして、多変量解析手法の1つである部分最小二乗法判別分析(partial least squares-discriminant analysis; PLS-DA)によりマウス個体間の代謝産物プロファイルの違いを解析した。その結果、2種類の予防株ビフィズス菌投与群(青色系)と非予防群(赤色系)の代謝物プロファイルは明らかに異なることが分かった。色調の違いは菌種の違いを、またそれぞれの球は各マウス個体のデータセットを表す。各ビフィズス菌について、5個体ずつ測定した。
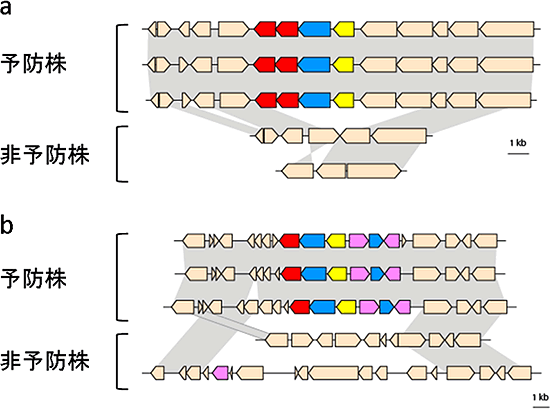
図3 2種類の果糖トランスポーター遺伝子(a・b)を含むゲノム領域の模式図
予防株に属するビフィズス菌3株、非予防株に属するビフィズス菌2株の果糖トランスポーターを含むゲノム領域の模式図。果糖トランスポーターのサブユニットの遺伝子(赤、青、黄色およびピンク)が、予防株だけに存在し、非予防株では欠損していることが分かる。
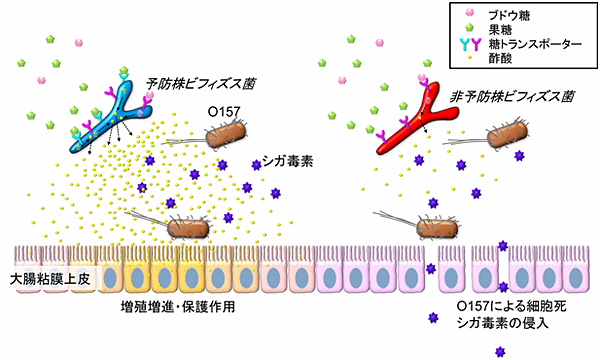
図4 予防株と非予防株ビフィズス菌によるO157感染死予防効果の違いの模式図
予防株(左)、非予防株(右)ともブドウ糖のトランスポーター(ピンクの糖トランスポーター)を持っているため、ブドウ糖が比較的豊富に存在する小腸~大腸上部では、両者ともにブドウ糖から十分量の酢酸を産生する。しかし、ブドウ糖がすでに消費されて枯渇状態にある大腸下部では、予防株(左)は大腸下部にも比較的豊富に存在する果糖を取り込むトランスポーター(水色の糖トランスポーター)を持っており、これによって果糖を利用して腸粘膜上皮の保護に十分な量の酢酸を産生するため、O157による炎症や感染死を予防する。一方、非予防株(右)は果糖トランスポーターを持たないため、十分量の酢酸を産生できず、O157により腸粘膜上皮が細胞死を起こし、毒素が体内に侵入することで、毒素によるマウスの感染死を引き起こす。
