2011年3月2日
独立行政法人 理化学研究所
喘息・花粉症の原因物質産生は、合成酵素の2つのアルギニン残基が鍵
-気管支喘息や花粉症の発症機序の理解に加え、新薬剤の開発に寄与-
ポイント
- ヒト由来膜タンパク質を用いて世界最高水準の1.9Å分解能で構造を解析
- ロイコトリエンC4合成酵素は、2つのアルギニン残基が協調して機能
- ロイコトリエンC4合成酵素の機能を原子レベルで初解析
要旨
独立行政法人理化学研究所(野依良治理事長)は、気管支喘息(ぜんそく)や花粉症の原因となる物質「システイニルロイコトリエン(Cys-LT)」を体内で産生する膜タンパク質「ロイコトリエンC4合成酵素(LTC4S)」の2つのアルギニン残基が協調して酵素機能を発揮することを発見し、「LTC4S」による酵素触媒反応の全貌の理解に世界で初めて踏み込みました。これは、理研放射光科学総合研究センター(石川哲也センター長)宮野構造生物物理研究室の齊野廣道特別研究員、吾郷日出夫専任研究員と、米国のハーバード大学ブリガム婦人病院の金岡禧秀助教授、K.フランク・オースティン(K. Frank Austen)教授らによる成果です。
研究グループは、大型放射光施設SPring-8※1を使い、ヒト由来の膜タンパク質のX線結晶構造解析で最高水準となる1.9Å(オングストローム)という高い分解能でLTC4Sの立体構造を解析しました。この結果から推測されたLTC4Sが機能する際に重要な役割を担うと考えられる部分を、タンパク質工学を使った生化学実験により解析した結果、この膜タンパク質の活性部位の両側に分かれて存在する2つのアルギニン残基が、協調して働くことで酵素機能を発揮することを初めて突き止めました。これは、LTC4Sが、LTC4産生に特化した高い特異性を備えた活性部位を持っていることを示し、類似した機能を持つタンパク質との差別化を考える上で重要な発見となりました。
これまでにCys-LTのCys-LT特異的受容体への結合を抑制する薬が、気管支喘息や花粉症の治療に有効であることが知られています。今回、Cys-LTを産生する膜タンパク質LTC4Sを特徴づける活性部位の構造を原子レベルで解明したことにより、これらの病気の発症機序の理解が一層進展しました。新たな作用機序を持ち、なおかつLTC4Sに対して高い選択性を持つ、すなわち副作用の少ない、花粉症や喘息などの慢性アレルギー疾患に対する抗炎症・抗アレルギー創薬につながる可能性が期待されます。本研究成果は、米国の科学雑誌『The Journal of Biological Chemistry』に近く掲載されます。
背景
生体防御の一環として働く炎症反応や免疫反応では、免疫系細胞である肥満細胞が重要な役割を担っています。肥満細胞が異物を認識すると、システイニルロイコトリエン(Cys-LT)を含むさまざまな情報伝達物質を放出します。細胞から放出されたCys-LTは、周辺の細胞の表面にある特異的な受容体タンパク質に結合して、平滑筋の収縮、粘液の分泌促進、毛細血管の透過性亢進などを誘導し、異物の排除に重要な炎症反応や免疫反応を開始させます。例えば風邪を引いた時の鼻水・鼻づまりなどは、このような生体防御反応の表れです。一方、過剰な生体防御反応は、逆に命を危険にさらす場合があります。蜂に刺された時に、呼吸不全や血圧低下が起こるアナフィラキシーショックなどが典型的な例です。また、Cys-LTの受容体タンパク質への結合を妨げる薬剤が、花粉症や気管支喘息の治療で有効であることが示すように、Cys-LTは、花粉症や気管支喘息の症状の発症に関わっています。Cys-LT代謝に関わるタンパク質の構造と機能の研究は、花粉症や気管支喘息発作を含めた生体防御反応を原子レベルで理解し、制御する方法の研究に不可欠です。
生体内でCys-LT産生の鍵となるタンパク質は、ロイコトリエンC4合成酵素(LTC4S)と呼ばれる膜タンパク質です。LTC4Sは、脂肪酸の一種であるロイコトリエンA4(LTA4)に、生体内の還元物質であるグルタチオン(GSH)を結合してロイコトリエンC4(LTC4)を合成します。Cys-LTは、このLTC4と、細胞外のペプチド分解酵素によってLTC4から作られるLTD4とLTE4の総称です。これは、LTC4、LTD4、LTE4のいずれも、分子内にGSH由来のシステイン残基を含むためです。研究グループは2007年に、LTC4Sの結晶構造解析に成功し、2つのLTC4S分子の間に作られるV字型の空間が、LTC4合成の活性部位であることなどを明らかにしましたが(2007年7月16日プレスリリース)、GSHとLTA4の結合を促進するアミノ酸残基を確定するには至っていませんでした。
研究手法
- (1)
LTC4Sの結晶構造解析
LTC4Sの活性部位の構造をより精密に検討するため、大型放射光施設SPring-8の理研構造ゲノムビームライン(BL26B2)と理研構造生物学Ⅱビームライン(BL44B2:現在は理研物質科学ビームラインと改称)を使って、LTC4Sの結晶構造を分解能1.9Å(オングストローム=10-10m)の精度で決定しました(図1)。1.9Å分解能は、ヒト由来膜タンパク質の結晶構造解析の精度として、現在の世界最高水準です。
- (2)
LTC4Sのアミノ酸置換体の酵素活性の解析
精度良く決定したLTC4Sの結晶構造の検討から、活性部位を挟んで、その両側に存在する2つのアルギニン残基が、LTA4とGSHの反応性を高める触媒残基として機能する反応機構が予想されました。これを検証するため、活性部位周辺のアルギニン残基を他のアミノ酸残基に置換した変異体LTC4Sの生化学実験を行いました。
研究成果
結晶構造解析の結果、150個のアミノ酸からできているLTC4S中の、31番目と104番目のアルギニン残基が、それぞれLTA4とGSHに作用し、LTA4とGSHの間の結合形成を促進している反応機構が予想されました。LTA4とGSHの間に結合を作るためには、マイナスの電荷を帯びて反応性が高まったGSHの硫黄(S)が、LTA4のエポキシ基※2が結合した炭素(C)を、定められた方向から立体特異的に攻撃することが必要です(図2)。通常生体内のGSHの硫黄は、水素(H)を1つ持ち、電気的に中性であるため反応性が低く、エポキシ基を攻撃することができません。しかし、LTC4Sの結晶構造解析結果は、104番目のアルギニン残基(Arg104)とGSHの硫黄の間の距離が3.2Åで、アルギニン残基が硫黄から水素イオン(H+)を奪い、GSHの硫黄がマイナスの電荷を帯びることで、反応を促進している可能性を示しました。この可能性を検証するため、Arg104を、水素イオンを奪う能力が無いアラニン残基やグルタミン残基で置換した変異体LTC4Sを作り、その酵素活性を測定しました。その結果、生体内の環境に近い中性の水溶液中では、変異体LTC4Sの酵素活性は天然型LTC4Sの酵素活性の2%程度と、非常に弱い活性しか示さないことが分かりました(図3)。この結果は、Arg104が、GSHから水素イオンを奪い反応を促進する「塩基触媒残基」であることを示しています。
活性化したGSHの硫黄の攻撃に伴って、LTA4のエポキシ基は次第にマイナスの電荷を帯び、そのままでは反応が妨げられてしまいます。結晶構造を使ったLTA4結合モデルの観察から、31番目のアルギニン残基(Arg31)が、水素イオンをエポキシ基に与え、反応の進行に伴ってエポキシ基が帯びるマイナスの電荷を中和することで、反応を促進している可能性を推察することができました(図1)。この可能性を検証するため、Arg31をほかのアミノ酸残基で置換した変異体LTC4Sを作り、その酵素活性を測定しました。水素イオンをエポキシ基に与える能力が無く、エポキシ基のマイナスの電荷を中和できないアラニン残基、グルタミン酸残基、ロイシン残基に置換した変異体LTC4Sの酵素活性は、Arg31を持つ天然型LTC4Sの酵素活性の数%程度と非常に弱くなりました。一方、部分的に中和できるグルタミン残基に置換した変異体LTC4Sでは、天然型LTC4Sの30%ほどの酵素活性を維持していました(図3)。すなわち、Arg31の位置にあるアミノ酸残基が、エポキシ基のマイナスの電荷を中和することができる場合は、LTC4を効率良く合成できることが分かりました。この結果は、Arg31が水素イオンをエポキシ基に与え、エポキシ基が帯びるマイナス荷電を中和して、反応を促進する「酸触媒残基」であることを示しています。
これらの結果から、LTC4Sの2つのアルギニン残基が、一方はGSH専用の塩基触媒残基として、もう一方はLTA4専用の酸触媒残基として、協調して機能するLTC4産生の触媒残基であることが判明しました。
今後の期待
研究グループは今回、LTA4とGSHからLTC4を合成する酵素として機能する、LTC4Sのアミノ酸残基を明らかにしました。LTC4Sの酵素としての機能の全貌を理解するためには、LTC4Sのさらなる研究が必要となります。例えば、現在解析できているGSHを結合したLTC4Sの結晶構造では、GSHはLTC4Sの活性部位の奥深くに埋め込まれているため、そのままの構造では、合成したLTC4がLTC4Sから離れることができず、新しくGSHがLTC4Sの活性部位に近づくこともできません。GSHの取り込みと生成物LTC4の放出に伴うLTC4Sの大きな構造変化が予想され、LTC4Sの機能の全貌の理解には、LTC4Sの立体構造がどう動いて変化するかを知る必要があります。
今回の研究で、Cys-LT産生の中心的触媒反応を明らかにすることができ、複雑なCys-LT産生の全貌理解に一歩踏み込んだことになりました。さらに、Cys-LTが関与する花粉症や気管支喘息発作を含めた生体防御反応の理解が進むと、これを制御する創薬の研究へとつながると期待できます。
発表者
理化学研究所
放射光科学総合研究センター 宮野構造生物物理研究室
専任研究員 吾郷 日出夫(あごう ひでお)
Tel: 0791-58-2815 / Fax: 0791-58-2816
お問い合わせ先
播磨研究推進部 馬越 元基(うまこしもとき)
Tel: 0791-58-0900 / Fax: 0791-58-0800
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.大型放射光施設(SPring-8)
兵庫県の播磨科学公園都市にある世界最高の放射光を生み出す理化学研究所の施設。放射光とは、光速に近い速度で加速した電子の進行方向を電磁石で変えたときに発生する、強力な電磁波(X線)のこと。SPring-8の名前はSuper Photon ring-8GeVに由来する。SPring-8では、この放射光を用いて、ナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究が行われている。 - 2.エポキシ基
炭素2つと酸素1つで作られた3員環エーテルをエポキシ基という。エポキシ基の3員環はひずみが大きく開裂しやすいため反応性に富み、さまざまな化学合成の中間体として用いられている。一般的には酸触媒で3員環が開裂し、反応が進行する。また通常のエーテルと異なり、塩基触媒でも反応が始まる。エポキシ基を持つLTA4は、細胞膜に由来する脂肪酸であるアラキドン酸に5-リポキシゲナーゼが酸素を付加し、生合成される。
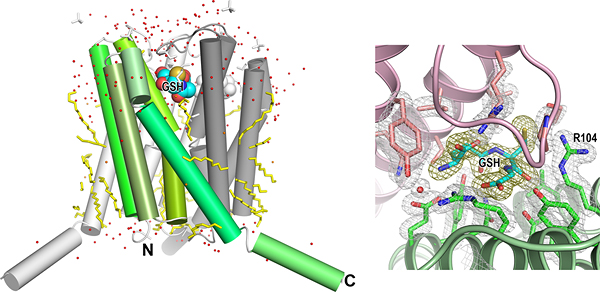
図1 X線結晶構造解析で決定したLTC4Sの三次元構造
- 左図:LTC4Sは、3つのLTC4S分子が会合してできた三量体分子が機能単位。緑のグラデーション、グレー、白の3色で3つのLTC4S分子を示した。隣り合う2つのLTC4Sの間に、LTA4と反応するGSHが結合している。今回の構造解析は、ヒト由来の膜タンパク質のX線結晶構造解析結果としては世界最高水準といえる1.9Å分解能という精度で決定した。そのため、LTC4Sの周りにある水分子(赤い小さな球)や、LTC4Sを安定化している界面活性剤分子の一部(黄色のスティック)の配置までも、よく観察できた。
- 右図:左図の分子を左上方から観察した図で、GSHとその周辺のアミノ酸残基について、X線結晶構造解析で計算した電子密度図を重ね合わせている。GSHの電子密度は金色で、その他の分子の電子密度は銀色で示した。解析の分解能が十分高いため、水分子を含め、精度の高い電子密度を計算できた。
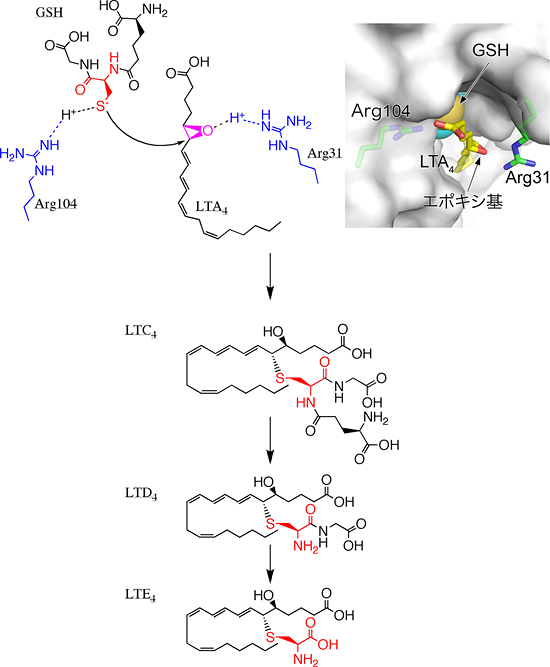
図2 Cys-LTの産生
- 右上図:X線結晶構造解析で解析した、LTC4SがLTC4を合成する場所である活性部位の構造に、計算上でLTA4とアルギニン31番(Arg31)の側鎖のモデルを配置した図。灰色の表面はLTC4Sの表面を表す。またX線結晶構造解析で決めたGSHは、原子を球で表現した球体モデルで表した。GSHとLTA4を結合するくぼみを含む活性部位の両側に、2つのアルギニン残基(Arg31とArg104)が配置し、各々GSHの硫黄(黄色の球)とLTA4のエポキシ基に隣接していることが分かる。
- 左上-下図:LTC4Sの触媒残基である2つのアルギニン残基(Arg31とArg104)を青、GSHのシステイン残基を赤、LTA4のエポキシ基をピンクで表す。LTC4Sの活性部位に、GSHとLTA4が結合すると、GSHの硫黄に結合していた水素は、プラスの電気を帯びながらArg104に移動し、GSHの硫黄はマイナスの電気を帯び、エポキシ基を攻撃できるようになる。また、Arg31は、プラスの電気を帯びた水素をLTA4のエポキシ基に与え、硫黄の攻撃に伴ってエポキシ基に生じるマイナスの電気を中和し、反応が進行するのを助ける。LTC4Sが産生したLTC4は、他の酵素によって順番に代謝されて、LTD4を経てLTE4へと変化する。
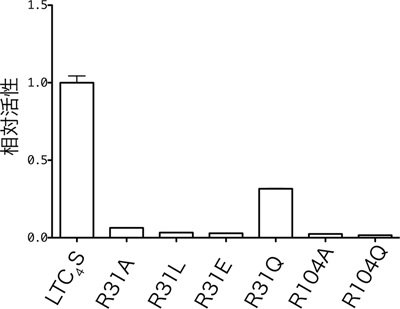
図3 LTC4Sと変異体LTC4Sの酵素活性の比較
31番目と104番目のアルギニン残基の各々を、他のアミノ酸に置き換えた変異体LTC4Sは、もとのLTC4Sに比べると酵素活性が低下した。R31A、R31L、R31E、R31Qは、それぞれ31番目のアルギニン残基をアラニン残基、ロイシン残基、グルタミン酸残基、グルタミン残基に置換したLTC4S、R104AとR104Qは、104番目のアルギニン残基をアラニン残基とグルタミン残基に置換したLTC4Sを表している。この結果は、LTC4Sが酵素活性を発揮する上で、31番目と104番目のアルギニン残基が大きな役割を担っていることを示している。
