2011年4月15日
独立行政法人 理化学研究所
国立大学法人 大阪大学
独立行政法人 科学技術振興機構
Bリンパ球から抗体産生細胞への分化を制御する仕組みを解明
-リン酸化酵素Erkが、抗体産生細胞への分化に必要不可欠-
ポイント
- 誘導的遺伝子ノックアウトマウスを活用し、免疫応答時のErkの働きを解明
- ErkによるElk1転写因子のリン酸化がBlimp-1転写因子の発現を誘導
- 抗体産生細胞を標的とした新たな免疫疾患治療への応用に期待
要旨
独立行政法人理化学研究所(野依良治理事長)と国立大学法人大阪大学(鷲田清一総長)、独立行政法人科学技術振興機構(北澤宏一理事長:JST)は、免疫機能を発揮するBリンパ球※1が抗体産生細胞※2に分化するために必要なシグナルを、リン酸化酵素※3Erkが伝達することを世界で初めて解明しました。これは、理研免疫・アレルギー科学総合研究センター(谷口克センター長)分化制御研究グループ(黒崎知博グループディレクター)の保田朋波流元研究員と米谷耕平基礎科学特別研究員ら、大阪大学免疫学フロンティア研究センター(審良静男拠点長)分化制御研究室の黒崎知博特任教授を中心とする共同研究グループの成果です。
Bリンパ球は、生体を脅かす細菌やウイルスなどの抗原に遭遇すると、抗体産生細胞へと分化して抗原特異的抗体を産生し、生体防御機能を発揮します。しかし、このBリンパ球から抗体産生細胞へ分化する仕組みは謎のままでした。研究グループは、リン酸化酵素Erkに注目し、この酵素を免疫応答時に誘導的に欠損させる遺伝学的手法を用いて、抗体産生細胞への分化におけるErkの役割を解析しました。その結果、ErkがBlimp-1という転写因子※4の発現を誘導し、抗体産生細胞へと分化させるのに必須のリン酸化酵素であることを初めて明らかにしました。また、ErkがElk1と呼ばれる転写因子をリン酸化させBlimp-1の発現を誘導するという仕組みも突き止めました。本研究の成果は、抗体が原因となるアレルギー疾患や自己免疫疾患の治療法につながると期待されます。
本研究成果は、米国の科学雑誌『Science Signaling』(4月19日号)に掲載されます。本研究は、JST 戦略的創造研究推進事業 チーム型研究(CREST)「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」研究領域(菅村和夫研究総括)における研究課題「液性免疫制御による新しい治療法の開発」(研究代表者:黒崎知博)の一環として行われました。
背景
私たちの体は、細菌やウイルスといった外敵(抗原)から、免疫応答という生体防御機能を発揮することによって守られています。免疫応答は、抗原を捕捉したBリンパ球が、CD40受容体※5やIL-4、IL-21といったサイトカインの受容体からTリンパ球※6の分泌するCD40リガンドやサイトカインの刺激を受けて抗体産生細胞へと分化し、抗体※7を作り出すことによって引き起こされます。
近年、花粉症をはじめとしたアレルギー疾患は、国民病と呼ばれるほど広まっていますが、これらも抗体産生細胞によって作り出された抗体が過剰な免疫応答を引き起こすことが主な原因となっています。そのため、抗体を作り出す仕組み、すなわちBリンパ球が抗体産生細胞へと分化する仕組みを理解することは、アレルギー疾患の治療法を見いだす上でも重要となります。
しかし、どのような仕組みでBリンパ球が抗体産生細胞に分化するのか、その詳細なメカニズムは不明のままでした。研究グループは、Bリンパ球の増殖や生存に関わるリン酸化酵素Erkが、Bリンパ球の分化にも関与すると考え、抗体産生細胞への分化における機能の解明に挑みました。
研究手法と成果
研究グループはまず、リン酸化酵素Erkが抗体産生細胞への分化に必要であるかどうかを検証するために、Erkノックアウトマウス(KOマウス)を利用することを考えました。しかし、通常のErk KOマウスでは、Bリンパ球ができ上がる過程で未熟なBリンパ球が増殖できず、成熟したBリンパ球を産生できないという異常が発生してしまうために、免疫応答時のErkの役割を正しく解析することができません。
そこで研究グループは、免疫応答が起きた後でErkを欠損させることが可能な誘導的遺伝子KOマウスシステムの1つ「Cγ1-creノックインマウス※8」を利用することにしました。このシステムを利用して作製したErk/Cγ1-cre KOマウスは、免疫応答が起きるまでは野生型マウスと何ら変わりませんが、人為的に免疫応答を引き起こすとErkをコードする遺伝子の発現が阻害されるため、免疫応答時のErkの機能を調べることが可能となります。抗原投与により免疫応答を引き起こすと、野生型マウスではBリンパ球が抗原特異的な抗体産生細胞へと分化し、抗原と反応するIgG1型の抗体を血液中に放出しますが、Erk/Cγ1-cre KOマウスでは、IgG1型の抗体を作り出す抗体産生細胞が顕著に減少し、産生する抗体量も著しく低下しました(図1)。この結果は、Bリンパ球が抗体産生細胞に分化する過程で、リン酸化酵素Erkが必要であることを示しています。
さらに、ErkがどのようにBリンパ球から抗体産生細胞に分化する仕組みに関与しているのかを明らかにするために、野生型マウスとErk/Cγ1-cre KOマウスから採取したBリンパ球をCD40刺激の抗CD40抗体やサイトカインのIL-4を添加した試験管内で培養し、抗体産生細胞への分化を観察しました。その結果、野生型マウスでは日数がたつにつれ抗体産生細胞への分化に必要とされる転写因子Blimp-1の発現量が増加するのに対し、Erk/Cγ1-cre KOマウスではBlimp-1が発現しないことが分かりました(図2)。逆に、Blimp-1遺伝子をErk/Cγ1-cre KOマウスのBリンパ球に導入すると、抗体産生細胞への分化が回復したことから(図3)、Erk/Cγ1-cre KOマウスで抗体産生細胞への分化が阻害されていたのは、Blimp-1が正常に発現しないためであることを確認することができました。
より詳細なメカニズムを解明するために、Erkの標的分子の1つであるElk1という転写因子を調べると、抗CD40抗体とサイトカインIL-4の刺激により、野生型マウスではElk1がリン酸化される一方、Erk/Cγ1-cre KOマウスではそのリン酸化が減弱しており、Elk1のリン酸化にErkが必要であることが判明しました(図4)。また、分子生物学的手法を用いてElk1がErkによってリン酸化されないように操作すると、Blimp-1の発現が低下し、抗体産生細胞の数が減少しました(図5)。
これらの結果から、Bリンパ球が抗原を捕捉しTリンパ球からの補助を受けると、ErkがElk1をリン酸化しBlimp-1の発現を誘導することによって抗体産生細胞への分化を誘導することが分かりました。
今後の期待
研究グループは今回、免疫応答特異的な誘導的遺伝子KOマウスシステムを用いることで、従来はリンパ球の発生段階で異常が現れたために解析が困難であった免疫応答以降の特定遺伝子の機能を、任意のタイミングで免疫応答を引き起こして解析することが可能であることを示しました。このため、この手法を用いることにより、今まで不明であった免疫応答後の多くの遺伝子の機能が明らかになると期待できます。
また、Bリンパ球が抗体産生細胞へと分化する仕組みを明らかにすることができたことで、アレルギーを引き起こすIgE抗体や、自己免疫疾患の原因となる自己抗体を産生するBリンパ球を標的として抗体産生をブロックし、アレルギー疾患や自己免疫疾患を抑制する新たな創薬開発へつながると注目されます。
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
分化制御研究グループ グループディレクター
国立大学法人大阪大学
免疫学フロンティア研究センター
分化制御研究室 特任教授
黒崎 知博(くろさき ともひろ)
Tel: 045-503-7019 / Fax: 045-503-7018
お問い合わせ先
独立行政法人理化学研究所
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
(JSTの事業に関すること)
独立行政法人科学技術振興機構
イノベーション推進本部 研究領域総合運営部
河村 昌哉(かわむら まさや)
Tel: 03-3512-3531 / Fax: 03-3222-2066
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.Bリンパ球
免疫細胞の一種。B細胞抗原受容体と呼ばれるタンパク質を細胞表面に出し、抗原を認識する。一般的には異なるBリンパ球は異なる抗原を認識する。その数は106個(百万種類)以上となり、細胞外からのあらゆる病原体やウイルスに対応することができる。Bリンパ球は、細菌やウイルスを排除するための抗体を作り出す細胞、抗体産生細胞に分化する。 - 2.抗体産生細胞
抗体を作り出すことに特化した細胞で、Bリンパ球が抗原に出会った後に分化してできる。形質細胞やプラズマ細胞とも呼ばれる。 - 3.リン酸化酵素
基質となるタンパク質にリン酸基を付加する酵素。リン酸基が付いたり外れたりすることで、基質はスイッチがオンになったりオフになったりして細胞内で信号を伝達する。Erkはさまざまなタンパク質を基質とし、細胞の増殖や分化を制御することが知られている。 - 4.転写因子
遺伝子の発現を調節するタンパク質。DNA上に存在する遺伝子の発現を制御する領域に結合し、DNAがRNAへ転写される時期や量を調節する。 - 5.CD40受容体
Bリンパ球や単球が細胞表面に持つ受容体の1つ。Tリンパ球が発現するCD40リガンドから活性化刺激を受け取り、Bリンパ球の増殖や分化に働く。 - 6.Tリンパ球
免疫細胞の一種。直接ほかの細胞と接触したり、サイトカインと呼ばれる液性因子を分泌して、Bリンパ球やほかの免疫細胞の分化や機能を調節する。 - 7.抗体
Bリンパ球から分化した抗体産生細胞が細胞外に分泌する「B細胞抗原受容体」。免疫グロブリン(Ig)とも呼ばれる。細菌やウイルスを直接破壊したり、不活性化させる機能を持つ。抗体にはIgM、IgG、IgA、IgE、IgDといったクラスがあり、それぞれは同じ抗原を認識しながら異なる働きを持つ。IgEはアレルギーの原因となる。 - 8.Cγ1-creノックインマウス
Bリンパ球が外来抗原によって活性化し、IgG1型の抗体を作り出す前駆細胞に分化するとCreと呼ばれるタンパク質を発現するように遺伝子工学的手法で作製したマウス。Cγ1-creノックインマウスと標的遺伝子のノックアウトマウスを交配すると、免疫応答時にその遺伝子が発現しないノックアウトマウスを作製することができる。
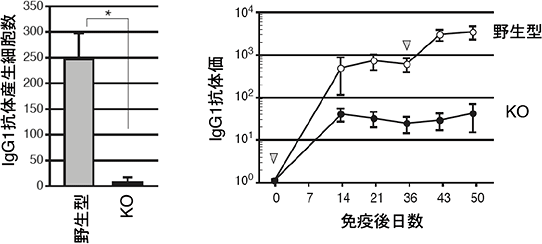
図1 Erk/Cγ1-cre KOマウスの抗体産生能
野生型マウスとErk/Cγ1-cre KOマウスに抗原を投与し、産生したIgG1型抗体産生細胞数と血清中の抗体量を測定した。Erk/Cγ1-cre KOマウスの抗体産生細胞の数は野生型と比べて顕著に減少し(左図)、血液中に分泌した抗体量もErk/Cγ1-cre KOマウス(●)では野生型マウス(○)に比べて減少した(右図)。この結果は、Erkが抗体産生細胞への分化に必要であることを示している。
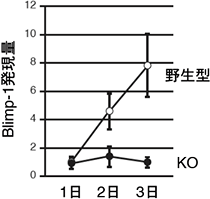
図2 CD40刺激、IL-4添加後のBlimp1の発現量
野生型マウス(○)とErk/Cγ1-cre KOマウス(●)からBリンパ球を精製し、抗CD40抗体、IL-4を添加した試験管内で培養した。野生型マウスでは日数がたつにつれBlimp-1の発現量が増加するが、Erk/Cγ1-cre KOマウスでは発現しなかった。このことから、ErkがBlimp-1の発現を誘導するのに必須であることが分かった。
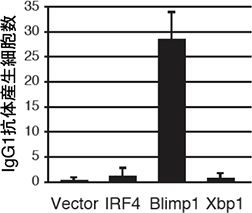
図3 Blimp-1導入によるErk /Cγ1-creKOマウスの機能回復
Erk/Cγ1-cre KOマウスのBリンパ球にさまざまな遺伝子を導入し、図2と同様の刺激を与えて試験管内で培養した。何も導入しない細胞(Vector)、もしくは他の遺伝子(IRF4、Xbp1)を導入した細胞では抗体産生細胞数が低下したままだが、Blimp-1遺伝子を導入した細胞は抗体産生細胞数が増加し、Erk/Cγ1-cre KOマウスの抗体産生細胞への分化機能が回復したことが分かる。
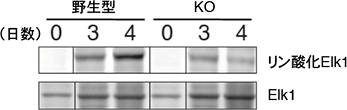
図4 CD40刺激、IL-4添加後のElk1のリン酸化
細胞に図2と同様の刺激を与えて試験管内で培養し、Elk1のリン酸化の程度を測定した。野生型は日数がたつとElk1のリン酸化が見られたが、Erk/Cγ1-cre KOマウスではその程度が低かった。この結果は、ErkがElk1のリン酸化に必要であることを示している。
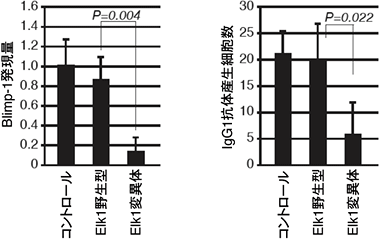
図5 Elk1変異体による抗体産生細胞分化への影響
Erkによってリン酸化されないように遺伝子操作をしたElk1遺伝子を導入すると(Elk1変異体)、野生型のElk1遺伝子を導入した時と比べてBlimp-1の発現量が減少し、抗体産生細胞数も減少した。コントロールは何も導入していない野生型細胞を表す。これらの実験から、リン酸化されたElk1がBlimp-1を発現させ抗体産生細胞への分化を誘導することが分かった。
