2011年4月26日
独立行政法人 理化学研究所
亜鉛トランスポーター複合体による亜鉛要求性酵素の活性化機構を解明
-亜鉛トランスポーターにタンパク質を安定化させる新たな機能-
ポイント
- 亜鉛トランスポーターは、亜鉛要求性酵素の安定化と活性化の2段階で制御
- 亜鉛トランスポーターが、タンパク質の安定性を制御していることを初めて発見
- 低フォスファターゼ症などの治療方法の開発などに大きく貢献
要旨
独立行政法人理化学研究所(野依良治理事長)は、生命活動に必須なミネラルの1つである亜鉛を細胞内に輸送する亜鉛トランスポーター※1が、タンパク質を細胞内分解から防ぎ、安定化させる機能を持つことを明らかにしました。これは理研分子イメージング科学研究センター(渡辺恭良センター長)複数分子イメージング研究チーム(榎本秀一チームリーダー)の福中彩子研究員と、京都大学生命科学研究科の神戸大朋准教授らとの共同研究による成果です。
ヒトの体で働くタンパク質の約10%は、亜鉛と結合する構造を持っており、免疫や神経機能、糖尿病やがん転移など、さまざまな生命現象に関わっています。亜鉛と結合することで活性化する酵素は亜鉛要求性酵素と呼ばれ、低フォスファターゼ症※2の発症に関わる組織非特異的アルカリフォスファターゼ(TNAP)※3などが知られています。研究グループはこれまでに、TNAPの活性化には亜鉛トランスポーターが必要であることを明らかにしてきました。今回、さまざまな亜鉛トランスポーターの変異体を用いてTNAPの活性と挙動を観察した結果、亜鉛トランスポーターが、まずTNAPを安定化し、ついでTNAPに亜鉛を供給することによって活性化する、という2段階の制御を行っていることを突き止めました。これにより、亜鉛トランスポーターが単に亜鉛要求性酵素に対して亜鉛を輸送するだけではなく、亜鉛要求性酵素そのものの安定化も制御していることが判明しました。これらの発見は、疾患と関与するほかの亜鉛要求性酵素への亜鉛供給メカニズムの解明や治療方法の開発に、大きく貢献するものと考えられます。
本研究成果は、米国の科学雑誌『The Journal of Biological Chemistry』(5月6日号:オンライン版4月29日付け)に掲載されます。
背景
生命活動の維持には、タンパク質や炭水化物などの生体分子のほかに、微量の金属元素が必要です。亜鉛はその1つで、欠乏すると味覚・嗅覚の異常、免疫機能や生殖機能の低下が起こります。亜鉛は、タンパク質の立体構造を維持する役割のほか、多様な酵素の活性補因子としても機能しており、亜鉛と結合して初めて酵素活性が現れる酵素を亜鉛要求性酵素と呼んでいます。研究グループは、細胞外に分泌される亜鉛要求性酵素である組織非特異的アルカリフォスファターゼ(TNAP)に着目し、この酵素の活性化には分泌経路※4に局在する亜鉛トランスポーター複合体(ZnT5/ZnT6ヘテロ複合体及びZnT7ホモ複合体)が必要であることを突き止めていました。しかし、その活性化機構の詳細は不明なままでした。
研究手法
研究グループはこれまでに、相同組み換え効率が高く遺伝子破壊実験を容易に実施できるDT40細胞※5を用いて、亜鉛トランスポーター複合体(ZnT5/ZnT6ヘテロ複合体及びZnT7ホモ複合体)の3つの遺伝子ZnT5、ZnT6、ZnT7を欠損させた、三重欠損株を作製していました。この三重欠損株ではTNAP活性が完全に消失しますが(図1右上)、欠損させた遺伝子のうちZnT5/ZnT6またはZnT7を導入し亜鉛トランスポーター複合体を強制発現させると、TNAPの活性を回復させることができます。今回、亜鉛トランスポーター複合体によるTNAPの活性化の機序をさらに明らかにするために、三重欠損株に、亜鉛トランスポーターの変異体を発現させたり、亜鉛そのものを強制導入した時のTNAPの活性と挙動を観察しました。
研究成果
三重欠損株でTNAP活性が消失する原因が亜鉛不足によるものかを調べるため、まず亜鉛そのものを強制導入し、分泌経路内に十分量の亜鉛を存在させましたが、TNAPの活性は回復しませんでした。また、ZnT5、ZnT6、ZnT7以外の亜鉛トランスポーターを過剰発現させて亜鉛の取り込みを促進させても同様の結果となり、このことからZnT5、ZnT6、ZnT7にはTNAPに亜鉛を供給する以外の役割があることが推測できました。
そこで三重欠損株におけるTNAPの挙動を詳しく調べたところ、ZnT5、ZnT6、ZnT7が存在しないとTNAPが速やかに分解されてしまうことが判明しました(図1右下)。ZnT5/ZnT6へテロ複合体については、ZnT5遺伝子に変異があると亜鉛輸送能が失われることがこれまでの研究で分かっています。この変異型亜鉛トランスポーター複合体を発現させた三重欠損株では、TNAPは活性化しないものの、タンパク質は安定して存在していました。これらのことから亜鉛トランスポーター複合体は、亜鉛の輸送とは関係なくTNAPタンパク質の安定性を制御しており、TNAPの活性化プロセスは、亜鉛トランスポーター複合体によるタンパク質の安定化と、その後の亜鉛の供給による活性化の2段階の制御によって行われることが分かりました(図2)。
今後の期待
TNAPは細胞外のカルシウム沈着に関わっており、TNAPを不安定にする遺伝子変異は低フォスファターゼ症の原因となることが分かっています。TNAPの安定化に亜鉛トランスポーターが関わっていることを示した発見は、低フォスファターゼ症の治療方法を開発する視点からも重要な成果となります。またTNAPと同様に分泌経路で活性化される亜鉛要求性酵素には、マトリックスプロテアーゼやアンジオテンシン変換酵素など、疾患に関連するものが多くあります。この成果は、これらの亜鉛供給メカニズムの解明や治療方法の開発にもつながると期待できます。
発表者
理化学研究所
分子イメージング科学研究センター
複数分子イメージング研究チーム
チームリーダー 榎本 秀一(えのもと しゅういち)
研究員 福中 彩子(ふくなか あやこ)
Tel: 078-304-7193 / Fax: 078-304-7191
国立大学法人京都大学
生命科学研究科統合生命科学専攻
准教授 神戸 大朋(かんべ たいほう)
Tel: 075-753-6273 / Fax: 075-753-6274
お問い合わせ先
独立行政法人理化学研究所
分子イメージング科学研究センター
広報・サイエンスコミュニケーター
山岸 敦(やまぎし あつし)
Tel: 078-304-7111 / Fax:078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.亜鉛トランスポーター
生体内の亜鉛の恒常性維持を担うトランスポーター。哺乳類においては20種類以上存在することが知られている。亜鉛トランスポーターは、その構造的特徴と亜鉛の輸送の方向性から、ZIPとZnTトランスポーターに分類され、ZnTトランスポーターは細胞質から細胞外もしくは細胞内小器官に亜鉛を輸送する。 - 2.低フォスファターゼ症
骨系統疾患の1つで、骨の石灰化異常や血清ALPの異常低値などを特徴とする遺伝性疾患。通常、常染色体劣性遺伝の形式をとる。組織非特異的アルカリフォスファターゼ(TNAP)の突然変異により引き起こされ、患者の骨の形成部位では、無機ピロリン酸が分解されないために、骨の石灰化が阻害されると考えられている。 - 3.組織非特異的アルカリフォスファターゼ(TNAP)
アルカリフォスファターゼ(ALP)には4つのアイソザイム(同じ反応を触媒するが、遺伝子が異なる酵素)が存在する。組織非特異的アルカリフォスファターゼ(TNAP)はその中の1つで、さまざまな細胞に広く発現していることが知られている。アルカリフォスファターゼは、活性に亜鉛を必要とする亜鉛要求性酵素である。 - 4.分泌経路
小胞体からゴルジ体を経て細胞膜に至る経路。 - 5.DT40細胞
ニワトリBリンパ球由来の培養細胞。相同DNA組み換え効率が比較的高いため、遺伝子破壊実験を容易に行うことができる。 - 6.
f
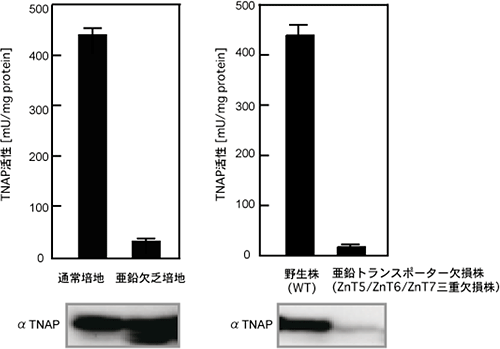
図1 TNAP酵素活性(棒グラフ)及びTNAPの発現量(電気泳動のバンド)
- 左: 野生型細胞を通常培地と亜鉛欠乏下で培養した場合
- 右: 野生型細胞とZnT5/ZnT6/ZnT7三重欠損株を通常の培地で培養した場合
亜鉛欠乏下の野生型細胞では酵素活性を失ったTNAPが存在しているのに対し(左下)、ZnT5/ZnT6/ZnT7三重欠損株ではTNAPが安定に発現できない(右下)。すなわち、亜鉛トランスポーターZnT5、ZnT6、ZnT7が、亜鉛が関与しない方法でTNAPを安定化していることが明らかとなった。
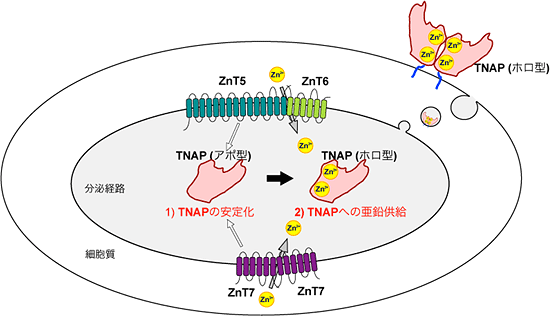
図2 亜鉛トランスポーター複合体によるTNAPの2段階活性化モデル
分泌経路で、亜鉛トランスポーター複合体はTNAPを安定化した後、亜鉛を供給し、活性化する。アポ型は不活性型を、ホロ型は活性化型を意味する。
