2011年6月17日
独立行政法人 理化学研究所
脳内炎症の発症の仕組みを解く酵素COX-1のライブイメージングに成功
―COX-1を選択的に認識するPETプローブを開発―
ポイント
- 脳内炎症過程におけるCOX-1の機能亢進をライブイメージングにより初めて確認
- 注目されることの少なかったCOX-1が脳内炎症の発生過程で重要な働き
- 脳疾患の病状解明、診断、治療など幅広い応用へ期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、神経組織の炎症や変性に関わる酵素Cyclooxygenase(COX)※1-1を標的とする新しいPETプローブ※2を開発し、脳内炎症過程の初期にCOX-1の機能が亢進している様子を生体脳で可視化すること(ライブイメージング)に世界で初めて成功しました。これは、理研分子イメージング科学研究センター(渡辺恭良センター長)分子プローブ機能評価研究チームの尾上浩隆チームリーダー、宿里充穂リサーチアソシエイトと分子イメージング標識化学研究チーム(土居久志チームリーダー)の高島好聖リサーチアソシエイト(現客員研究員)らによる研究成果です。
炎症原因物質の生成酵素であるCOXは、炎症性疾患の診断や治療薬開発の標的として注目されてきました。COXには、正常時にも一定量発現しているCOX-1と、免疫反応や炎症刺激によって誘導されるCOX-2の2つのタイプが知られています。しかし、COXが神経変性疾患※3の発症に具体的にどう関わるかについては不明のままでした。
今回研究グループは、COX-1に対して強い阻害効果を示す薬剤ケトプロフェンの誘導体を放射性核種である炭素11(11C)で標識し、新規PETプローブ(11C-ケトプロフェンメチルエステル;11C-KTP-Me)を開発しました。次に、COX-1、COX-2それぞれの遺伝子を欠損した遺伝子改変マウスを使って、このPETプローブが脳内においてCOX-1を特異的に認識することを証明しました。また、脳内炎症を起こしたラットでは、炎症領域と一致して11C-KTP-Meの集積が特異的に増加することをPET画像で観察しました。このラットを細胞レベルで詳しく見ると、炎症反応によって活性化された免疫担当細胞であるマイクログリア※4が、COX-1の発現を伴って増加していることも明らかとなりました。
今回の成果により、COX-1が脳内炎症過程において重要な働きをすることが証明できました。COX-1のPETイメージング技術は、脳内炎症の程度、進行度を評価するための新たなバイオマーカー※5として活用することができ、脳内炎症が深く関与すると考えられている神経変性疾患のアルツハイマー型認知症やパーキンソン病などの病状解明、診断、治療などに貢献することが期待されます。
本研究成果は、文部科学省委託事業『分子イメージング研究戦略推進プログラム』および『分子イメージング研究プログラム』により実施され、科学雑誌『The Journal of Nuclear Medicine』(7月号)に掲載されます。
背景
少子高齢化社会を迎えた現代において、老化とともに発症、進行することの多いアルツハイマー型認知症やパーキンソン病などの神経変性疾患は、患者数が増加の一途をたどり、その予防、診断、治療法開発は急務となっています。しかし、多くの神経変性疾患には、根本的な治療法が存在しないのが現状です。その主な原因として、病状発症の仕組みがいまだに明らかになっていないことが挙げられます。
神経変性疾患の多くは、脳内の炎症が原因で起こっていることが報告されています。Cyclooxygenase(サイクロオキシゲナーゼ;COX)は、炎症原因物質であるプロスタグランジンの生成酵素として炎症の発現、調節に重要な役割を担い、神経変性疾患にも深く関与すると考えられています。このCOXには恒常的に細胞内に発現しているCOX-1と、サイトカインなどの刺激によって発現が誘導されるCOX-2の2つのタイプが存在することが知られています。しかし、COXが神経変性疾患の発症に具体的にどう関わるかについては、まだ詳しく分かっていません。
これまで研究グループは、神経変性疾患の診断や治療への応用を目的とし、分子イメージング※6を用いて生体内におけるCOXの機能を非侵襲的に測定できるCOXイメージング用PETプローブの開発を進めてきました(Takashima-Hirano M et al.,Chemistry-A European Journal 16 (14), 4250-8)。具体的には、COX阻害活性を持つ非ステロイド性抗炎症薬(NSAIDs)※7に放射性核種である炭素11(11C)を組み込み、PETを利用して、生体内のCOXの分布や活性の変化を確認してきました。これまでに、10種類以上のNSAIDsとその誘導体を利用したPETプローブの評価を行った結果、11Cケトプロフェンメチルエステル(11C-KTP-Me)が脳内炎症を特異的に認識することを報告しています。
本研究では、まず、11C-KTP-Meが生体内において、どちらのCOXタイプを特異的に認識するのかを明らかにし、脳内炎症過程に関与するCOXの分布、活性の時間変化、細胞の由来について追跡しました。
研究手法と成果
研究グループは、11C-KTP-MeがPETプローブとして、どちらのCOXタイプを特異的に認識するかを明らかにするために、COX-1とCOX-2をそれぞれ欠損させた遺伝子改変マウスを用い、脳内集積の違いを検証しました。その結果、11C-KTP-Meの集積は、COX-1欠損マウスだけで減少し、COX-2欠損マウスでは変化しないことを確認しました。このことは、11C-KTP-MeがPETプローブとしてCOX-1を特異的に認識することを示します。
次に、脳内炎症を引き起こす薬剤リポポリサッカライド(LPS)をラットの脳内に局所注入し、脳内炎症過程における11C-KTP-Me 集積の変化をPETイメージングにより観察しました。その結果、11C-KTP-Meの集積は、LPS注入後の早い段階でのみ注入部位周辺で増加しており、COX-1の機能が脳内炎症の初期反応に関係して亢進している可能性を示しました(図1)。
さらに、細胞レベルの詳細な観察を免疫染色で行い、COX発現細胞の同定や、炎症反応に伴って変化する他の脳内細胞との関係性についても検討しました。その結果、脳内ではマイクログリアが活性化し、それがCOX-1だけを発現していることが明らかになりました(図2)。また、正常状態でCOX-1とCOX-2の両方を発現していた神経細胞では、LPSを注入しても発現パターンに変化は認められませんでした。COX-1を発現する活性化マイクログリアの増加と11C-KTP-Me集積の経時変化とがほぼ一致していたことからも、11C-KTP-Meは活性化マイクログリアに発現するCOX-1の亢進を特異的に認識していることが分かりました。(図3)。
今後の期待
これまで、COXの2つのタイプのうち、炎症に関係するのはCOX-2であると考えられていました。しかし今回、脳内炎症反応の主役とも考えられるマイクログリアでは、COX-2よりもむしろCOX-1が重要な働きをする可能性を示したことは、驚くべき発見です。また、COX-1のPETイメージング技術を確立したことで、これまで捉えることのできなかった生体内でのCOX-1のモニタリングを可能にし、さまざまな炎症性疾患でのCOXの機能について研究を前進させると期待されます。さらに、COX-1を新たな脳内炎症のマーカーとして神経変性疾患の診断に応用することや、治療薬開発の標的として利用できる可能性があります。
今後研究グループは、アルツハイマー型認知症やパーキンソン病などの神経変性疾患の発症にCOX-1がどのように関わるかを明らかにし、11C-KTP-Meをこれらの病気の診断薬として臨床応用するための研究を進めていきます。
発表者
理化学研究所
分子イメージング科学研究センター
分子プローブ機能評価研究チーム
チームリーダー 尾上 浩隆(おのえ ひろたか)
Tel: 078-304-7121 / Fax: 078-304-7123
お問い合わせ先
分子イメージング科学研究センター
広報・サイエンスコミュニケーター
山岸 敦(やまぎし あつし)
Tel: 078-304-7111 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.Cyclooxygenase(COX)
アラキドン酸からプロスタグランジンを生成する酵素。プロスタグランジンは、発熱や炎症、痛みの原因となることから、COXの働きがこれらの症状を調節していると考えられている。主にCOX-1とCOX-2の2つのタイプが知られている。COX-1は全身の組織に広く存在することから恒常型、COX-2は炎症に伴って発現することから誘導型と称されることが多い。ただし、脳内ではCOX-1、COX-2ともに発現することが確認されている。 - 2.PETプローブ
陽電子放出断層画像法(Positron Emission Tomography; PET)は、ごく微量の放射線を出す放射性核種を薬などの分子に組み込み、そこから出る放射線を測定することでその分子の体内分布を見る方法。PETで用いる陽電子を放出する11Cや18Fなどを組み込んだ薬剤をPETプローブという。生体内に投与して生じる消滅ガンマ線を計測することで、PETプローブの分布や動きを外から捉えることができる。 - 3.神経変性疾患
神経組織の変性を伴う病気で、異常なタンパク質の凝集などを伴い、神経細胞が損傷するために起きると考えられている。アルツハイマー型認知症やパーキンソン病、プリオン病、筋萎縮性側索硬化症などが知られている。 - 4.マイクログリア
脳や脊髄など、中枢神経系に存在する神経細胞以外の部分(グリア)を構成する細胞の一種。中枢神経系における免疫担当細胞であると考えられ、神経細胞の損傷、細菌や毒素などの外部刺激を素早く探知して活性化されることが知られている。活性化マイクログリアは、障害細胞の除去を行う貪食作用を示すが、その効果は神経に対して善玉にも悪玉にも働く場合がある。 - 5.バイオマーカー
病気の状態や変化、または治療の効果を客観的・定量的に判定するための指標。コレステロール値や血圧などの数値情報のほか、PET画像をイメージング・バイオマーカーとして用いることもある。 - 6.分子イメージング
生物が生きた状態のまま、生体内の遺伝子やタンパク質などのさまざまな分子の挙動を非侵襲的に観察する技術。PETはその代表的な手法の1つ。 - 7.非ステロイド性抗炎症薬(NSAIDs)
解熱、鎮痛、抗炎症効果を示すステロイド以外の薬剤を示し、一般医薬品として広く知られているアスピリンやイブプロフェン、インドメタシン、ジクロフェナクなどが代表的である。これらの薬理作用は、COX阻害に基づくことが明らかとなっており、COX-1、COX-2に対する阻害活性が異なるさまざまな薬剤が存在する。疫学調査では、NSAIDsを常用している患者には、アルツハイマー病やパーキンソン病のリスクが低いことが報告されるなど、炎症以外に神経変性疾患との関わりについても注目されている。
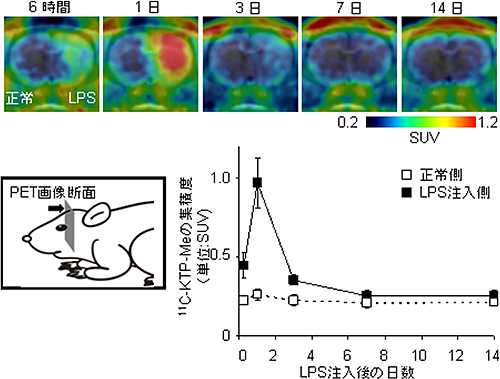
図1 LPS脳内注入ラットのPETイメージングによる経時的な11C-KTP-Me集積の変化
11C-KTP-Meの脳内集積は、LPS注入直後の6時間後から注入領域の周辺で増加し、1日後には正常側にくらべて約4倍にまで上昇したが、3日目以降はもとのレベルにまで低下した。
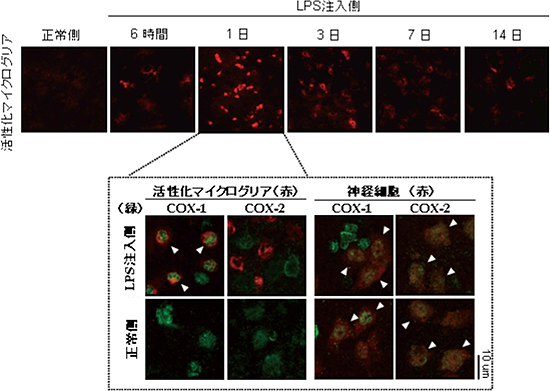
図2 LPS注入後のマイクログリアの活性化と細胞特異的なCOX発現パターン
- (上)活性化マイクログリアのマーカー(OX-42抗体)を用いた免疫染色像では、LPS注入直後の6時間後で活性化マイクログリアの存在が確認され、1日後では発現量、染色強度ともに増強し、活性化のピークを示した。
- (下)矢印は、細胞特異的マーカー(赤)とCOX(緑)が共発現している細胞を示す。LPS注入1日後において、活性化マイクログリア(OX-42抗体)ではCOX-1を発現しているが、COX-2を発現していないことが分かった。一方、神経細胞(NeuN抗体)では、LPS注入1日後も正常状態と同様にCOX-1、COX-2を発現していた。
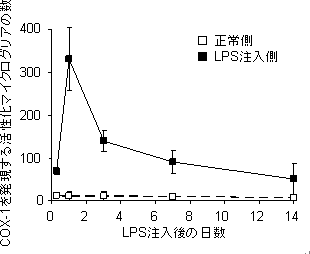
図3 LPS注入後のCOX-1を発現する活性化マイクログリア細胞数の経時変化
免疫染色の顕微視野(0.4mm2)内において、COX-1とOX-42を共に発現する細胞を数えることで、COX1を発現する活性化マイクログリアの細胞数を計測した。LPS注入直後の6時間後から増加し、1日後にピークを示して減少するという経時変化は、図1に示した11C-KTP-Meの集積変化とほぼ同じである。
