2011年8月1日
独立行政法人 理化学研究所
炎症性腸疾患に関わる腸管粘膜の防御機構を解明
-AP-1B欠損マウスが特定疾患の1つであるクローン病のモデル動物に-
ポイント
- 腸管上皮細胞に選択的に発現するAP-1Bが、生体防御機能の発揮に重要
- AP-1Bによるサイトカイン受容体の細胞内輸送が、腸管上皮細胞の機能発揮に必要
- クローン病の新たな発症メカニズム解明に期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、クローン病※1などに代表される炎症性腸疾患は、AP-1B※2というタンパク質が腸管上皮細胞で正常に発現しないために、腸管粘膜の生体防御機能が働かなくなって発症することを発見しました。これは免疫・アレルギー科学総合研究センター(谷口克センター長)免疫系構築研究チーム(大野博司チームリーダー)の長谷耕二上級研究員(独立行政法人科学技術振興機構さきがけ兼務)、横浜市立大学大学院生命ナノシステム科学研究科を中心とする共同研究グループ※3による研究成果です。
私たちの腸管粘膜は、食べ物に含まれる細菌やウイルス、さらには100兆個もの腸内常在細菌叢などの異物に常にさらされています。その最前線に位置する腸管上皮細胞は、栄養素などの吸収だけでなく、これら外来異物に対する生体防御機能をも担っていますが、その詳しい仕組みは分かっていませんでした。上皮細胞の細胞膜は、腸管内腔に面する側と体内に面する側に明確に区別されます。このうち体内側の細胞膜には、リンパ球をはじめとするさまざまな免疫細胞との相互作用に重要な役割を担うタンパク質が多く存在します。
研究グループは、腸管や腎臓、肺などの上皮細胞だけに発現するタンパク質輸送因子AP-1Bに着目しました。このAP-1Bは、上皮細胞の腸管粘膜側から体内側の細胞膜へとタンパク質を運びます。AP-1B遺伝子を欠損させたマウスや上皮細胞株を用いた実験から、AP-1Bは免疫細胞との相互作用に重要なサイトカイン※4受容体の正常な輸送に必要であることや、この正常な輸送が行われない場合、免疫細胞との相互作用により誘導される抗菌ペプチド※5群の産生量が減ることを見いだしました。抗菌ペプチドは腸管の生体防御に大変重要であり、その減少は炎症性腸疾患の1つであるクローン病の発症と深く関与しています。実際、AP-1B欠損マウスはクローン病と似た病態を示し、さらに、クローン病の上皮細胞ではAP-1Bの発現量が減少していることが分かりました。今回の研究から、AP-1B欠損マウスは、いまだ発症原因に不明な点の多いクローン病の新たな研究モデルとして役立つことが期待されます。
本研究成果は、消化器学で最も権威のあるアメリカ消化器学会発行の専門誌『Gastroenterology』8月号に掲載されます。
背景
細菌やウイルスなどの異物と接する生体の内外の境界は、皮膚や粘膜によって保護されています。体表面を覆う皮膚は、重層する表皮細胞や角質層によって比較的堅牢な防壁を形成して、異物の侵入を食い止めています。一方、腸管や腎臓、唾液腺、肺、気道などの粘膜の多くは、単層の粘膜上皮細胞で覆われているだけで、脆弱な防御機能しか持ち合わせていません。さらに、粘膜の中でも特に腸管粘膜は、その主たる機能である栄養や水分の吸収効率を高めるために、約400m2にも及ぶとされる広い表面積を持ち、食物抗原や、食物とともに摂取される外来微生物、100兆個にも及ぶ腸内常在細菌叢などの異物に常にさらされています。
このような危険にさらされている腸管粘膜の最前線に位置する腸管上皮細胞は、栄養素などの吸収を担うだけではなく、外来の異物に対する生体防御機能をも担うことが知られています。腸管上皮細胞の細胞膜は、腸管内腔側と体内側とに明確に区別されます。腸管内腔側には栄養素の終末消化を行う種々の酵素や栄養素の取り込みを行うトランスポーターなどが存在します。一方、体内側には上皮細胞同士の相互作用を担う分子、リンパ球などの免疫細胞との相互作用に重要な分子が多く存在します。しかし、これら分子の局在がどのように制御されているかについては不明な点が多く、また、その局在の制御が腸管粘膜での生体防御機能上どれほど重要なのか、という点に関しても未知な部分が多い状況でした。
研究手法と成果
研究グループは、さまざまな上皮細胞で発現するタンパク質輸送因子AP-1Bに着目して、AP-1B遺伝子を全身または腸管上皮細胞だけで欠損させたマウス(AP-1B欠損マウス)を作製しました。その表現型を病理学的、免疫学的に詳細に解析した結果、腸管粘膜や粘膜下に慢性炎症を発症し、ヒトのクローン病と似た病態を示すことが分かりました。また大腸の上皮細胞の遺伝子発現を解析すると、AP-1B欠損マウスの大腸上皮細胞では、ディフェンシンなどの抗菌ペプチドの産生が、野生型のマウスの上皮細胞と比較して著しく減少していることを見いだしました。さらに、腸管内腔に存在する分泌型IgA(Immunoglobulin A)※6の量を測定すると、AP-1B欠損マウスの分泌型IgAレベルは野生型と比較して有意に低いことが分かりました(図1)。
次に、AP-1B欠損マウスを用いて、AP-1Bによるタンパク質の輸送を細胞生物学的に解析しました。その結果、AP-1B遺伝子を欠損させると、抗菌ペプチドの産生誘導に重要ないくつかのタンパク質(サイトカイン受容体)を、上皮細胞の体内側の細胞膜に正常に運べなくなることが分かりました(図2)。また、AP-1B遺伝子を欠損させた腸管上皮細胞株を用いた実験系でも、いくつかのサイトカイン受容体に加えて、分泌型IgAを腸管内腔側へ輸送するために重要な多量体免疫グロブリン受容体(pIgR)を、体内側の細胞膜に正常に運ぶことができなくなりました。これらの結果は、AP-1Bを欠損した上皮細胞が、体内側直下に存在するリンパ球などが産生するサイトカイン(情報)を正常に受け取れなくなって、ディフェンシンなどの抗菌ペプチドの産生誘導が減弱したり、形質細胞※7が産生した二量体IgAをpIgRが受け取れなくなって、分泌型IgAを腸管内腔側に正常に輸送できなくなることを示唆します。
こうした腸管粘膜の防御機能の欠陥によって、AP-1B欠損マウスの腸管粘膜へは腸内細菌が侵入し、最終的にクローン病に似た慢性的な炎症像を示すことが判明しました(図3、図4)。また、クローン病患者の腸管粘膜を調べたところ、AP-1B遺伝子の発現が、健常人の腸管粘膜と比べて低いことが分かりました。
今後の期待
クローン病は消化管の慢性炎症ですが、その発症原因の全貌は今のところ明らかになっておらず、現在の医学では根治が不可能です。近年になると、日本人のクローン病患者数は年々増加の一途をたどっており、根本的な治療方法の開発が望まれています。今回の研究により、AP-1B欠損マウスはクローン病と似た病態を示し、さらに、クローン病の腸管粘膜ではAP-1B遺伝子の発現が減少していたことから、AP-1B遺伝子の発現異常がクローン病の発症に関与している可能性が高まりました。従って、AP-1B欠損マウスをモデル動物として研究を進めることにより、クローン病の発症機序の解明や、さらにはそこで得られた知見を基にした新たな治療方法の開発にも役立つことが期待されます。
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
免疫系構築研究チーム 上級研究員
長谷 耕ニ(はせ こうじ)
Tel: 045-503-7032 / Fax: 045-503-7068
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.クローン病
炎症性腸疾患の1つであり、主として口腔から肛門までの全消化管に、非連続性の慢性炎症を生じる原因不明の疾患。根治することはなく、厚生労働省より特定疾患に指定されており、発症のメカニズムは正確には解明されていない。遺伝的な素因、免疫系の異常のほか、腸内の細菌叢、食習慣が複合的に関与している。欧米における患者数が圧倒的に多いが、日本人においても患者数が増加しており、食生活の欧米化が関与していると考えられている。 - 2.AP-1B
Adaptor protein 1Bの略。Adaptor proteinは全部で6種類存在し、ヘテロ4量体からなる複合体タンパク質である。その中でもAP-1Bは上皮細胞だけで発現するサブユニットμ1Bを構成要素としているため、上皮細胞内だけに存在する。上皮細胞内ではリサイクリングエンドソームと呼ばれる細胞小器官に局在し、その場で膜タンパク質を捕捉すると同時にタンパク質輸送小胞の形成を助ける。AP-1Bによって捕捉された膜タンパク質は、上皮細胞の体内に面する側の細胞膜へと輸送される。 - 3.共同研究グループ
理研RCAI免疫系構築研究チーム/横浜市立大学大学院生命ナノシステム科学研究科免疫生物学研究室(大野博司、高橋大輔、海老澤昌史、加藤完、福田真嗣)、理研RCAI免疫系構築研究チーム(長谷耕二、木村俊介、伊達康博、大前ますみ、尾畑佑樹)のほか、科学技術振興機構さきがけ(長谷耕ニ)、千葉大学医学部(横須賀収、勝野達郎、佐藤徹、万代恭史)、福島県立医科大学医学部(和栗聡)、国立国際医療センター研究所(土肥多惠子、河村由紀)、イェール(Yale)大学医学部(中津史)の研究者各氏。 - 4.サイトカイン
細胞同士の情報伝達にかかわるさまざまな生理活性を持つタンパク質の総称。炎症性サイトカインは、体内への異物の侵入を受け産生されるサイトカインで、生体防御に関与する多種類の細胞に働き、炎症反応を引き起こす。 - 5.抗菌ペプチド
抗菌活性を持つ数十個のアミノ酸から成る短いペプチドの総称。上皮細胞をはじめ、免疫系の細胞によっても産生され、腸管内腔側などの粘膜面には大量に存在して生体防御機構の一翼を担っている。ディフェンシンやリゾチームなどさまざまな種類が存在し、異なった抗菌スペクトルを持つ。最もよく研究が進んでいるディフェンシンの抗菌機序は、陽性に荷電したディフェンシン分子が、負に荷電した細菌の細胞膜に貫入することで、細胞膜に穴を開けるなどして細菌を殺すことによる。 - 6.分泌型IgA (Immunoglobulin A)
IgAは免疫グロブリン(IgA、IgD、IgE、IgG、IgM)の中でも粘膜面に最も大量に存在し、かつ体内で最も多く産生される種類の抗体である。粘膜に存在する形質細胞より主に二量体として産生され、上皮細胞の細胞膜に存在する多量体免疫グロブリン受容体(pIgR)によって捕捉されて上皮細胞経由で腸管内腔に分泌される。分泌される際には、その末端に分泌片が付加されるため、腸管内腔に豊富に存在するタンパク質分解酵素による分解を免れる。IgAの分泌は、抗菌ペプチドの産生と並んで粘膜面における生体防御機能の中でも主要な位置を占める。 - 7.形質細胞
B細胞が最終分化した細胞。免疫グロブリンを活発に産生し分泌する。
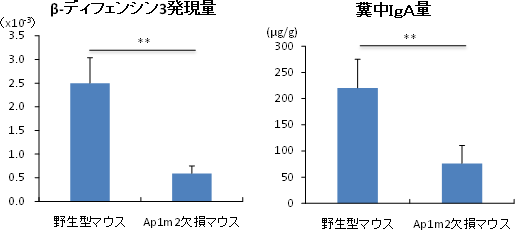
図1 野生型マウスとAP-1B欠損マウスの比較
- 左図:AP-1B欠損マウスの大腸上皮細胞におけるβ-ディフェンシン3の発現量は、野生型マウス(対照群)に比べて4分の1以下に低下していた。
- 右図:AP-1B欠損マウスの糞中の分泌型IgA含量は、野生型マウスに比べて3分の1程度まで低下していた。
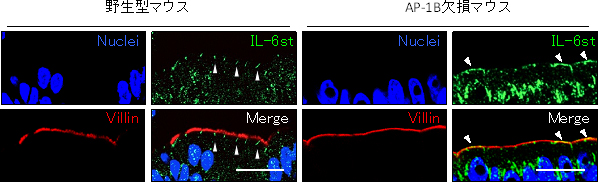
図2 AP-1B欠損マウスの上皮細胞での種々の受容体の様子
野生型及びAP-1B欠損マウスの遠位結腸部位の切片を作製し、サイトカイン受容体の1つIL-6stを識別する抗IL-6st抗体、微絨毛に存在するVillinを識別する抗Villin抗体で免疫染色を行った。青は核を示し、Villinは腸管内腔側を示している。IL-6stは、野生型マウスの上皮細胞では体内側の細胞膜に局在する(縦の筋状に観察される)のに対し、AP-1B欠損マウスの上皮細胞では腸管内腔側の細胞膜に局在していた(一部は縦の筋状に観察される)。
スケールバーは20μm。
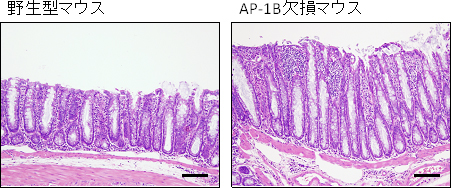
図3 AP-1B欠損マウスはクローン病に類似した大腸炎を発症する
野生型及びAP-1B欠損マウスの遠位結腸部位の切片を作製し、ヘマトキシリン・エオジンで染色したもの。AP-1B欠損マウスでは、濃い青色で示すリンパ球が粘膜や粘膜下層に大量に浸潤してきている。また上皮細胞の構造が破綻して陰窩も伸長するなど、大腸炎の病理症状を示す。
スケールバーは100μm。
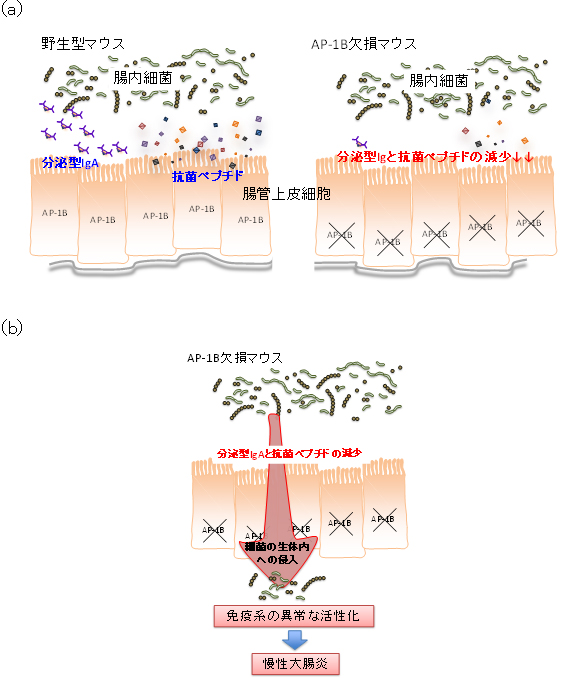
図4 AP-1B欠損マウスにおける大腸炎発症モデル
- (a)
- 野生型マウス:ディフェンシンなどの抗菌ペプチドの産生に重要なサイトカインの刺激が、上皮細胞の体内側の細胞膜に存在する受容体を介して伝わることで、正常に抗菌ペプチドが産生する。また形質細胞が産生した二量体IgAは、上皮細胞の体内側の細胞膜に存在するpIgRによって捕捉され、分泌型IgAとして腸管内腔側に運ばれる。こうした生体防御機能が正常に働くことで粘膜表面は守られる。
- AP-1B欠損マウス:サイトカイン受容体が、上皮細胞の体内側の細胞膜に正常に運ばれないため、サイトカインの刺激が正常に伝わらず、ディフェンシンなどの発現が減少していると考えられる。また、pIgRも正常に運ばれないため、形質細胞数は多いにもかかわらず、分泌型IgAの腸管内腔側への輸送量は減少している。
- (b) AP-1B欠損マウスでは、上皮細胞の生体防御機能が破綻し、細菌が粘膜内に浸潤しやすくなる。細菌が侵入した結果、粘膜免疫系の細胞が活性化し、また新たに炎症性細胞が呼び寄せられ炎症を引き起こす。最終的には慢性の大腸炎へと至る。
