ポイント
- ジャガイモ疫病菌の免疫抑制タンパク質AVR3aの立体構造を世界で初解明
- AVR3aの脂質結合領域が植物の免疫を抑制するカギ
- 免疫抑制タンパク質の活性を抑える薬剤の開発や抵抗性作物の作出を促進
要旨
独立行政法人理化学研究所(野依良治理事長)は、ジャガイモの生産に被害を与えるジャガイモ疫病菌の分泌物である植物免疫抑制タンパク質「AVR3a」の立体構造を、世界で初めて解明することに成功しました。これは、理研植物科学研究センター(篠崎一雄センター長)植物免疫研究グループの白須賢グループディレクターと八丈野孝研究員、理研生命分子システム基盤研究領域(横山茂之領域長)NMRパイプライン高度化研究チームの木川隆則チームリーダー、英国 セインズベリーラボラトリー(The Sainsbury Laboratory)※1のソフィアン カムン(Sophien Kamoun)プロジェクトリーダーらによる共同研究の成果です。
国際連合食糧農業機関(FAO)と経済協力開発機構(OECD)は、食料価格の高騰が今後も続く見通しから、食料安全保障が世界規模の課題であると警鐘を鳴らしています。小麦などの穀物に対してジャガイモは、世界中で年間約1億トンも消費されるほど主要な作物であるにも関わらず、比較的安定した価格を維持し、厳しい気象条件でも育つため、安定供給が可能な作物として改めて注目されています。とくに発展途上国では栽培、消費ともに急速に増加しています。しかし、ジャガイモ疫病菌による年間被害額は世界中で67億ドル(オランダのワーゲニンゲン大学の統計より)にも達し、今後さらに深刻な問題となることが予想されます。
研究グループは、ジャガイモ疫病菌が分泌して病害を引き起こす免疫抑制タンパク質AVR3aの立体構造を世界で初めて解明し、この立体構造データを基に、疫病菌の種間を超えて保存されている特徴的な表面構造を発見、植物の免疫を抑制するのに必須な構造であることを突き止めました。病原菌が分泌する免疫抑制タンパク質の立体構造を明らかにしたことで、病原性を失わせるような薬剤の開発や抵抗性を持つジャガイモ品種の作出が進み、病害克服の突破口になると期待されます。
本研究成果は、米国科学アカデミー紀要『Proceedings of the National Academy of Sciences of the United States of America: PNAS』のオンライン版(8月1日付け:日本時間8月2日)に掲載されます。
背景
ジャガイモ疫病菌(Phytophthora infestans)は、1840年代にヨーロッパ全域でジャガイモを壊滅的に枯らした植物病原菌で、特にアイルランドで歴史的な大飢饉を引き起こしたことで知られています。アイルランドでの餓死者は100万人以上にものぼり、約200万人がアメリカへ移住したといわれています。「植物の破壊者」という意味の学名Phytophthoraからも、その脅威をうかがい知ることができます。現在ではジャガイモ栽培は全世界に広まっており、この病害を克服することは人類にとって積年の課題となっています。
一般的に植物は、病原菌が近づくとそれを認識して「植物免疫」※2と呼ばれる免疫反応を引き起こして防御します。ジャガイモの場合は、ジャガイモ疫病菌由来のINF1というタンパク質を認識して免疫反応を引き起こします。ところがジャガイモ疫病菌は、これに対抗してAVR3aというタンパク質を分泌して免疫反応を抑制します。この免疫反応を抑制する分子機構が分かると、この病害を克服する手立てが得られると考えられますが、その機構はこれまでほとんど不明のままでした。このため本研究グループはAVR3aの立体構造の解明に挑みました。
研究手法と成果
本研究グループは、ダイズやナス科、ウリ科作物に感染する疫病菌のホモログ※3の中から、近縁種の灰色疫病菌(Phytophthora capsici)が分泌するAVR3a4がNMR測定※4に適していることを見いだし、立体構造解析を行いました。そのデータを基にジャガイモ疫病菌のAVR3aの立体構造を得ることに成功しました。構造解析の結果AVR3aは、植物細胞の中に入り込むためのRXLRドメイン※5が特定の構造をとっておらず、エフェクタードメインと呼ばれる本体の部分は4つのαヘリックスが束になった構造をしていることが分かりました(図1)。また、植物免疫反応の制御因子であるCMPG1※6を機能不全にするのに必要なC末端チロシンを含む部分が、エフェクタードメインから突き出た尻尾のようなかたちをしているということも分かりました(図1)。
さらに、このエフェクタードメインの表面電荷分布を解析したところ、正電荷を帯びた特徴的な領域が存在することを発見しました(図2)。この正電荷の領域は、疫病菌のホモログ間で高度に保存されていることから、重要な機能を持つのではないかという推測のもと、生化学的手法により詳細に解析しました。その結果、この領域が、植物細胞の膜脂質であるホスファチジルイノシトールリン酸※7との結合に必須であることが分かりました。一方、RXLRドメインは、この脂質の結合に必要ないことも分かりました。
アミノ酸置換法によりこの領域内の正電荷アミノ酸であるリシンを負電荷アミノ酸であるグルタミン酸に変化させた変異体AVR3aは、この脂質に結合できなくなりINF1の認識後に引き起こされる植物免疫反応を抑制することができませんでした。そこで、この脂質とAVR3aの安定性との関係を調べるために、この脂質を減らす酵素であるホスファチジルイノシトール5-キナーゼを過剰発現させた時のAVR3aの安定性を調べました。すると、本来脂質に結合できるはずの野生型AVR3aの安定性が低下しました。これらの結果から、AVR3aは植物細胞内でホスファチジルイノシトールリン酸に結合することにより安定性を保ち、CMPG1に結合してその働きを阻害することで、植物免疫を抑制していると考えられました。
今後の期待
今回、AVR3aが植物免疫を抑制するために、膜脂質との結合が必要なことが分かりました。AVR3aのホモログは、ダイズやナス科、ウリ科作物に病害をもたらす病原菌にも見つかっています。まだ植物免疫の仕組みについて詳細に解明されていませんが、今回の研究成果により全容解明に向けて一歩前進することができました。また、膜脂質への結合を阻害する薬剤など、広範な病原菌の防除に役立つ創薬の研究や、抵抗性作物の作出に大きく貢献すると期待されます。
発表者
理化学研究所
植物科学研究センター 植物免疫研究グループ
グループディレクター 白須 賢(しらす けん)
Tel: 045-503-9574 / Fax: 045-503-9573
研究員 八丈野 孝(やえの たかし)
Tel: 045-503-9444 / Fax: 045-503-9573
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.セインズベリーラボラトリー(The Sainsbury Laboratory)
英国のGatsby財団による基金で運営され、植物と微生物の相互作用の分野で世界をリードする研究所で、2010年に理研と共同研究協定を結んでいる。 - 2.植物免疫
植物は動物のような獲得免疫は持っていないが、自然免疫と類似した免疫システムを持つ。外来生物に由来する分子を受容体タンパク質が認識して免疫反応を誘導する。 - 3.ホモログ
生物種を超えて類似したDNA配列を持つ遺伝子のこと。多くの場合、ホモログ同士は類似した機能を持つ。 - 4.NMR測定
核磁気共鳴(nuclear magnetic resonance)測定は、原子と原子のつながりを分析することができ、X線結晶解析法と並んでタンパク質の立体構造解析に有効な手法として用いられている。NMR測定を行うためには、タンパク質が大量合成できること、可溶性であること、きちんと折りたたまれている構造であることが条件である。 - 5.ドメイン
タンパク質は、多数連結して鎖のようにつながったアミノ酸が折りたたまれて螺旋構造(αヘリックス)や平面構造(βシート)をとることで形成された高分子化合物である。これらの構造の特定の組み合わせがまとまった領域をドメインと呼び、多くの場合、特定の機能をもつ。 - 6.CMPG1
ジャガイモやトマトなどで同定された、タンパク質分解に関わる酵素。植物に特徴的なU-boxと呼ばれるドメインをもつユビキチンE3リガーゼで、シロイヌナズナのPUB20のホモログである。INF1認識後のシグナル伝達に関与すると考えられており、AVR3aのC末端チロシンと結合し安定化されると機能不全になることが知られている。 - 7.ホスファチジルイノシトールリン酸
生体膜を構成している脂質の1つで、ホスファチジルイノシトールのイノシトール環の3、4あるいは5位の水酸基にリン酸を1つ持つ。AVR3aはこの3種すべてに結合する。
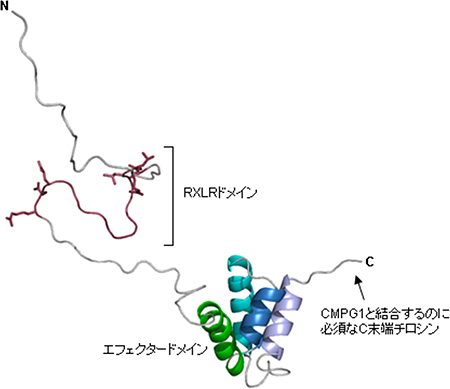
図1 AVR3aの立体構造
RXLRドメインは特定の構造をとっておらず、エフェクタードメインは4つのαヘリックスが束になった構造をしている。CMPG1と結合するのに必要なC末端チロシンはエフェクタードメインから突き出た尻尾のような構造をしている。
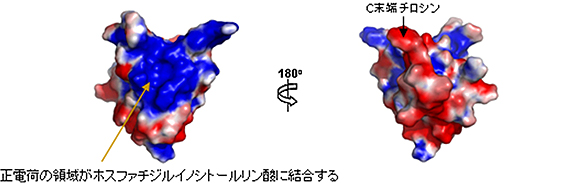
図2 AVR3aのエフェクタードメインの表面電荷分布
特徴的な正電荷領域がホスファチジルイノシトールリン酸との結合に必須である。この領域の正電荷アミノ酸を負電荷のアミノ酸に変異させるとこの脂質に結合できなくなり、AVR3aの安定性が植物細胞内で下がってしまう。
