2011年11月22日
独立行政法人 理化学研究所
DNA修復酵素「MutL」の機能制御に必要な重要箇所を発見
―遺伝性のがんであるリンチ症候群の発症メカニズム解明に新たな知見―
ポイント
- MutLが担う損傷したDNAを切断する機能の制御機構に必要な重要箇所を発見
- MutLの制御機構解明によって遺伝性のがんであるリンチ症候群発症の原因が判明
- DNAの損傷を修復するミスマッチ修復系のメカニズム解明に新たな知見
要旨
独立行政法人理化学研究所(野依良治理事長)は、DNAの損傷を修復して細胞ががんになることを防ぐ酵素「MutL」の、機能制御に重要な箇所を新しく発見しました。これは、理研放射光科学総合研究センター(石川哲也センター長)放射光システム生物学研究グループの飯野均特別研究員、倉光成紀グループディレクターらの研究成果です。
生命の遺伝情報であるDNAの損傷は、がん、老化、細胞死の原因になります。DNAは、紫外線や放射線などの外的要因によって絶えず損傷していますが、細胞分裂する際にDNAが複製エラーを起こすといった内的要因によっても損傷しています。さまざまな種類のDNA損傷に対応するため、生物はDNA修復機構※1を備えています。その中の1つである「ミスマッチ修復系※2」と呼ばれる機構は、DNAの複製エラーで生じる損傷を修復します。ところが、これが機能しなくなると、最も頻度の高い遺伝性のがんの1つで、大腸や子宮内膜、卵巣、胃など多臓器へのがんの発症リスクを高めるリンチ症候群※3になることが知られています。
このミスマッチ修復系の中で中心的な働きをする酵素MutLは、損傷したDNAを切断する役割を担っていますが、正常なDNAを切断してしまうことがないように、適切な箇所、適切な場合だけで働くように制御されていると考えられています。MutLの仕組みについては、これまで主に大腸菌やヒトの酵素を用いた研究が進められてきましたが、「大腸菌とヒトではMutLの機能が異なる」、「ヒトの酵素は不安定で実験に不向きである」、などの問題がありました。
研究グループは、ヒトと基本的な機能が同じで、かつ安定で実験に向いている超好熱性細菌のMutLを用いて、重水素交換法と質量分析法を組み合わせた手法※4により、MutLが機能制御の際にどのように構造変化しているかを分析しました。その結果、制御に関係する領域を特定し、さらに変異体実験により、この領域周辺に制御の鍵となる重要箇所を発見しました。また、この箇所に遺伝子変異が入るとミスマッチ修復系が働かなくなり、リンチ症候群の原因の1つになることを見いだしました。
今後、ミスマッチ修復系の仕組みのさらなる解明によって、リンチ症候群の新しい予防法や治療法の発見が期待できます。また、DNA修復は基本的生命現象の1つなので、全生物の基盤的仕組みをより深く理解できるようになると期待されます。
本研究成果は、米国の科学雑誌『The Journal of Biological Chemistry』(12月9日号)に掲載されるに先立ち、オンライン版(12月2日付け:日本時間12月3日)に掲載されます。
背景
DNAは、紫外線や放射線などの外的要因によって絶えず損傷を受け、配列が書き換えられてしまう可能性にさらされています。また、生物が生命活動を続ける限り避けられない内的要因によってもDNAは傷つきます。例えば、細胞は細胞分裂のたびにDNAを複製していきますが、その複製能は完全ではなく、複製エラーを起こすことがあります。そのため生物は、これらさまざまな種類のDNA損傷を修復できるDNA修復機構を備えています。中でも、ミスマッチ修復系はDNA複製のエラーで生じる損傷を修復しており、これが機能しなくなると、最も頻度の高い遺伝性のがんの1つ、リンチ症候群になることが知られています。リンチ症候群は大腸や子宮内膜、卵巣、胃など多臓器でのがんの発症リスクを高める遺伝性疾患で、全大腸がんのうち5~8%の原因になっていると推定されています(Lynch and Chapelle (1999) J. Med. Genet. 36, 801-818)。
DNAは相補的2本鎖構造※5によりその遺伝情報を保っていますが、複製エラーが起こると、遺伝子配列にミスマッチな部分ができます(図1)。ミスマッチ修復系には、DNAのミスマッチ部分を見つけ、どちらが正しい配列か判別し、エラー配列を持つDNAだけを切断して、正しい配列のDNAを相補鎖に合わせて合成する、という複数の能力が必要になります。そのため、複数種類の酵素が協調して働く巧妙なメカニズムが存在すると考えられています。「MutL」はミスマッチ修復系の中で中心的な役割を担っている酵素で、ミスマッチを見つける酵素や正しい配列を判別する酵素と相互作用しながら、エラー配列を持つDNAだけを切断していると考えられています(図2)。通常は正常なDNAを切断してしまわないように抑制され、適切な場合だけ働くように制御される必要がありますが、その仕組みはよく分かっていません。これまでMutLやミスマッチ修復系の研究は、主に大腸菌やヒトの酵素を用いて進められていました。しかし、大腸菌のミスマッチ修復系は、他の生物とはMutLの機能が異なるという問題があり、一方、ヒトの酵素は不安定で壊れやすく生化学的な実験に向いていない、という問題がありました。
そこで研究グループは、全生物の共通祖先に近いといわれ、1998年にゲノム解析が終了した超好熱性細菌アクイフェックス※6のMutLの機能解析に挑みました。アクイフェックスのMutLは、ヒトと基本的な機能が同じで、かつ安定していて壊れにくく、生化学的な実験に向いているという利点があります。
研究手法と成果
MutLは2分子が結合した形をとる酵素で、1分子の中に「ATP※7が結合する部分を持つATP結合ドメイン※8」と「DNAを切断する役割を担うエンドヌクレアーゼドメイン」の2つのドメインがあり、エンドヌクレアーゼドメインを介して2分子が結合していることが分かっています(図3)。これまでに研究グループは、ATP結合ドメインがATPの結合をスイッチにしてエンドヌクレアーゼドメインのDNA切断活性を制御していること、すなわち、「ATPが結合しているとDNA切断活性が抑制され、ATPが外れたとき(外れているとき)、逆にDNA切断活性が促進されること」、「ATP結合に伴ってATP結合ドメインの形が構造変化していること」、「エンドヌクレアーゼドメインには亜鉛結合部分があり、この部分がATP結合ドメインとの仲介に必要なこと」、を明らかにしてきました(Iino H., et al. (2011) Bioscience Reports 31, 309-322)(図3)。
研究グループは、MutLにATPが結合することによってDNA切断活性が制御される仕組みをさらに詳細に知るため、重水素交換法と質量分析法を組み合わせた手法を用いて、ATP結合が引き起こす構造変化が2つのドメイン間の接触をどのように変化させるか解析しました。その結果、機能に関わると思われる新規領域の特定に成功しました(図4のA、B)。さらに、ATP結合ドメイン中の領域(図4のA)の周辺と、エンドヌクレアーゼドメイン中の領域(図4のB)の一部に、ヒトを含めた他種生物のMutLが共通に持っている推定機能箇所をそれぞれ発見しました。これら2つの推定機能箇所は、ATP結合ドメインとの仲介に必要であるとされる亜鉛結合部分(図3 黄緑)と、DNA切断活性部分(図3 水色)に近接しており、これまでに研究グループが明らかにしてきた知見を裏付ける結果となりました。
次に、2箇所の推定機能箇所を欠いた、もしくは異なる種類のアミノ酸に置換したMutL変異体を作製して評価したところ、ATP結合ドメインが持っているはずの制御機能やエンドヌクレアーゼドメインが持っているはずのDNA切断活性が失われることを確認しました。興味深いことに、MutLの2分子は、エンドヌクレアーゼドメイン中の推定機能箇所で交差しながら結合していたことから、DNA切断活性を発揮するためには、2分子が結合する必要があることが判明しました(図4の丸囲み)。このことは、どのようにしてMutLが2本鎖DNAのうちエラー配列を持つDNAだけを切るのか、というミスマッチ修復系メカニズムの本質と関わりがある可能性があります。また、実際にリンチ症候群の原因になった遺伝子異常箇所と照らし合わせたところ、この推定機能箇所(図4のB)に生じた遺伝子異常がリンチ症候群の原因の1つであることが分かりました。つまり、この箇所の異常はMutLのDNA切断活性を失わせ、DNA修復系を機能不全に導き、結果的にリンチ症候群を引き起こすといえます。
今後の期待
MutLの活性制御機構で重要な役割を持つ箇所が明らかになったので、今後は、MutLが具体的にどのようにエラー配列を持つDNAに結合して切断するのかについて、分子機構レベルで解明することを目指します。また、ミスマッチ修復系で協調して働くMutL以外の複数酵素とどのように関係しているのかを明らかにし、ミスマッチ修復系のシステム全体を解明していきます。その研究の過程で、リンチ症候群の新しい予防法や治療法の発見が期待できます。DNA修復機構は全生物が共通に持っているシステムで、生命現象の根幹の1つに位置します。このシステム全体を解明することによって、原初の生命からヒトまでを含めた全生物の基盤的な仕組みをより深く理解できるようになると期待できます。
原論文情報
- Tatsuya Yamamoto*, Hitoshi Iino*, Kwang Kim, Seiki Kuramitsu, and Kenji Fukui (*equal contribution), “Evidence for the ATP-dependent structural rearrangement of the nuclease catalytic site of the DNA mismatch endonuclease MutL.”, The Journal of Biological Chemistry, 2011, 286, 42337-42348 doi/10.1074/jbc.M111.277335
発表者
理化学研究所
放射光科学研究センター
放射光システム生物学研究グループ
特別研究員
飯野 均(いいの ひとし)
Tel: 0791-58-2891 / Fax: 0791-58-2892
Tel: 0791-58-0900 / Fax: 0791-58-0800
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.DNA修復機構
DNAは紫外線や放射線の照射といった外的要因や、複製エラーや活性酸素といった内的要因により、絶えず損傷を受けている。しかし、生物はこれらの損傷を元通りに修復するさまざまなDNA修復機構を備えており、この機構には多くのDNA修復タンパク質(酵素)が関わっている。ミスマッチ修復系はそのうちの1つ。 - 2.ミスマッチ修復系
DNA修復機構の1つ。DNAは相補的2本鎖構造をとっており、そのため自己複製能がある。DNAが複製される際、2本鎖のらせんが解かれ、それぞれの1本鎖DNAには、新たな相補的塩基が結合して、2組の新しい2本鎖DNAが形成される。しかしこの複製は完全ではなく、まれに相補的ではない塩基の組み合わせ(ミスマッチ)を含む2本鎖DNAが生じてしまう。ミスマッチ修復系は、このミスマッチを見つけ出し、除去して修復する。 - 3.リンチ症候群
大腸、子宮内膜、卵巣、胃など多臓器へのがんの発症リスクを高める遺伝性疾患。主に大腸への発がんリスクを高め、全大腸がんのうち5~8%の原因になっていると推定されている(Lynch and Chapelle (1999) J. Med. Genet. 36, 801-818)。リンチ症候群による発がんは、遺伝性非ポリポーシス大腸がんとして、1966年にヘンリー・リンチによって報告された。これは、最も頻度の高い遺伝性のがんの1つとして知られている。近年の分子生物学の進歩により、DNAミスマッチ修復酵素の変異が原因であることが判明した。 - 4.重水素交換法と質量分析法を組み合わせた手法
重水素とは水素の安定同位体であり、水素と同じ化学的性質を持ちながら、約2倍の質量を持つ。重水素で構成された水(重水)の中にMutLを浸すと、MutLの構成要素である水素が時間とともにに重水素に交換される。このとき、MutLの表面は交換率が高いが、内部やドメイン同士が接触している部分は交換率が低い。このMutLをバラバラの断片に切ってから、断片ごとに原子レベルの重さまで量る(質量分析)と、断片の重さは重水素の交換率を反映するので、MutLの状態を推測することができる。 - 5.相補的2本鎖構造
DNAは2本の鎖がらせん状に絡み合った構造をとっており、この中には生命の設計図といえる遺伝子情報が、アデニン(A)、グアニン(G)、シトシン(C)、チミン(T)という4種類の塩基により、1次元的に書き込まれている。2本の鎖は「ポジ」と「ネガ」の関係、すなわち、片方が決まれば、もう片方も自ずと決まるという「相補的関係」にある。4種類の塩基が2本鎖の接着面にあり、Aに対してはT、Cに対してはGが対合するため、この関係が実現する。 - 6.超好熱性細菌アクイフェックス
シチリア島から発見された、85~95℃という極限環境で生育できる細菌。DNA分子系統解析によれば、熱水中で生きている細菌(好熱菌)は全生物の共通祖先に近い位置にあり、特にアクイフェックスは真性細菌の中で最古のグループに属する。そのため、生命の基本的特徴が凝縮されていると考えられている。 - 7.ATP
アデノシン三リン酸。地球上の全生物共通の「生体のエネルギー通貨」と呼ばれ、生体内で用いられるエネルギーのほとんどはATPによって媒介される。ATPはアデノシンにリン酸が3分子結合しており、リン酸の結合が外れるときにエネルギーを放出する。1分子のリン酸が外れたATPは、ADPとなり、再びリン酸が付加されるとATPになる。 - 8.ドメイン
酵素などのタンパク質は約20種類のアミノ酸が直鎖状に連結した高分子化合物であり、そのアミノ酸配列によってタンパク質の種類ごとに決まった形をとる。局所的にはヘリックス(らせん)構造や、シート構造、ループ(ひも)構造になる。それらがまとまってひと固まりになった単位を、ドメインと呼ぶ。MutLは1分子の中に2つのドメインを持つタンパク質である。
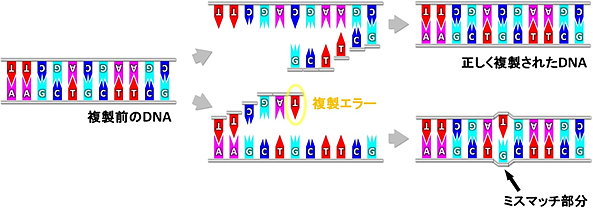
図1 DNAの複製エラーによってミスマッチ部分が生じる仕組み
正常なDNAは相補的2本鎖構造をとっており、アデニン(A)、グアニン(G)、シトシン(C)、チミン(T)の4種類の塩基は相補的塩基対(A-T、G-C)を形成している。しかし、DNAの複製エラーによって、相補的ではない(ミスマッチな)塩基対(例:G-T)が生じる場合がある。これを除去し修復するのがミスマッチ修復系である。
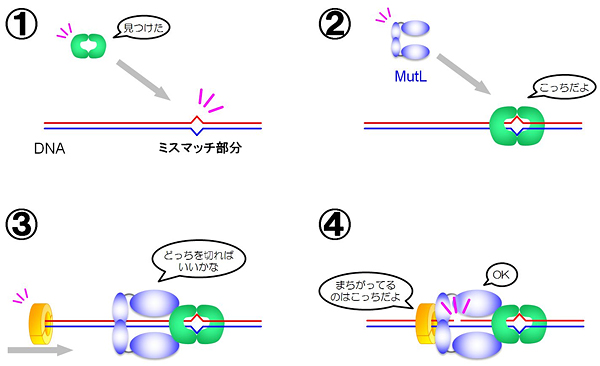
図2 ミスマッチ修復系におけるMutLの働き
MutL(青)は、DNA上のミスマッチ部分を見つける酵素(緑)と、2本鎖DNAのうちどちらがエラー配列なのか認識する酵素(黄)と連携しながら、エラー配列のDNAだけを切断する。MutLのDNA切断活性は、通常は抑制されているが、適切な場合(④の状況)にのみ機能を発揮するように調節されていると考えられている。
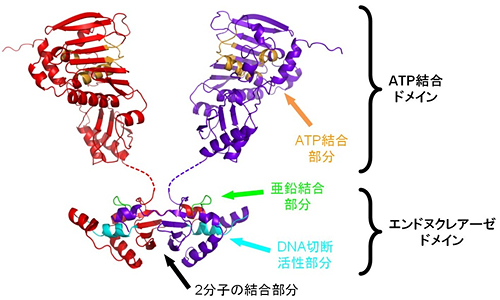
図3 MutLの分子構造モデル
MutLは1分子中にATP結合ドメインとエンドヌクレアーゼドメインをもち、2分子(赤と紫)がエンドヌクレアーゼドメインを介して結合した形をとっている。ATP結合部分(オレンジ)にATPが結合したり、外れたりすると、ATP結合ドメイン全体の形が変わり、亜鉛結合部分(黄緑)を介してDNA切断活性部分(水色)を制御すると考えられている。
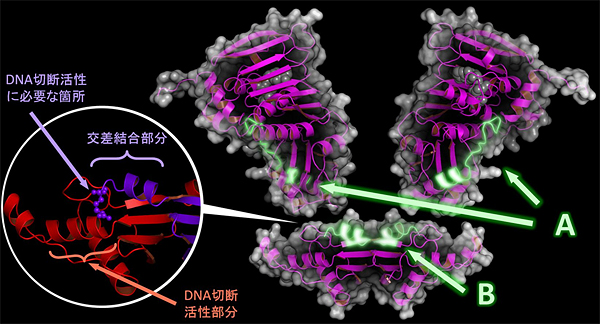
図4 MutLのドメイン間接触領域
- A:ATP結合ドメイン中のエンドヌクレアーゼドメインとの接触領域。
- B:エンドヌクレアーゼドメイン中のATP結合ドメインとの接触領域。
- 丸囲み:MutL 2分子(赤と紫)が交差しながらエンドヌクレアーゼドメイン中で結合した部分。DNA切断活性に必要な箇所(紫)とDNA切断活性部分(赤)が機能する位置関係になるためには、MutL 2分子が結合している必要がある。
