2011年12月7日
独立行政法人 理化学研究所
記憶や学習の能力にグリア細胞が直接関与
-生きたマウスでグリア細胞がシナプス可塑性に影響を与えることを初めて確認-
ポイント
- 大脳皮質でのシナプス可塑性の誘導中に、グリア細胞のカルシウム濃度が上昇
- グリア細胞の活動に伴って、長期記憶に必須のアミノ酸(D-セリン)が上昇
- グリア細胞を標的にしたアルツハイマー病の新しい治療法開拓に期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、生きたままのマウスを使って、神経細胞とともに脳を構成しているグリア細胞※1の一種であるアストロサイト※2が、神経細胞間の接点であるシナプスでの情報伝達効率を調節し、記憶や学習に影響を及ぼす「シナプス可塑性※3」に関与することを発見しました。これは、理研脳科学総合研究センター(利根川進センター長)神経グリア回路研究チームの高田則雄研究員、三嶋恒子研究員、平瀬肇チームリーダー、発生神経生物研究チームの御子柴克彦チームリーダーらの研究グループによる成果です。
脳は神経細胞とグリア細胞、血管とで構成されています。グリア細胞はヒトの脳細胞の約半数を占め、大脳皮質※4で最も数が多い細胞がアストロサイトです。アストロサイトは、神経細胞への栄養補給など補助的役割だけを担うと考えられてきましたが、近年、シナプス可塑性へも関与する可能性が示唆されています。しかし、これまでの研究はいずれも脳切片※5などを用いていたため、生きたままの動物の脳では、アストロサイトとシナプス可塑性の関係は全く不明でした。
研究グループは、生きたままのマウスの大脳皮質にシナプス可塑性を誘導することに成功し、このときの大脳皮質にあるアストロサイトの活動を、2光子励起顕微鏡※6を用いてリアルタイムで観察しました。その結果、シナプス可塑性の誘導中に、アストロサイト内のカルシウム濃度が顕著に上昇することを発見しました。細胞内のカルシウム濃度は、通常、細胞外と比べて低く保たれており、この濃度が上昇することで多くの生理的反応が生じることが知られています。アストロサイトの場合には、細胞内カルシウム濃度の変動が、細胞活動の指標となります。また、細胞外のアミノ酸の量を測定できる微小透析法で調べたところ、この細胞内カルシウムの上昇に伴って、アストロサイトが放出するとされているアミノ酸の一種(D-セリン※7)の量が、細胞外で増加することも見いだしました。一方、アストロサイト内のカルシウム濃度の上昇を欠損させた遺伝子改変マウスでは、シナプス可塑性は生じず、細胞外のD-セリンの量も増加しませんでした。
今回、生きたままの動物の脳を用いて、これまで脇役とされてきたグリア細胞が、記憶や学習に直接関与する可能性を世界で初めて示したことになります。今後、アルツハイマー病などの記憶障害において、グリア細胞活動を標的とした全く新しい治療法の開発が期待できます。
本研究成果は、米国の科学雑誌『Journal of Neuroscience』(12月7日号)に掲載されます。
背景
アストロサイトは、脳構造の維持とともに、脳内の代謝や神経細胞外環境を維持する支持細胞と考えられてきました。しかし近年、神経細胞と同様に神経伝達物質を受け取ったり、種々の伝達物質を放出したりすることが分かってきたため、シナプス可塑性にも関与する可能性が指摘されるようになっています。2010年には、脳切片を用いた実験で、シナプス可塑性がアストロサイトの細胞内カルシウムの応答に依存するとの報告がありました(Henneberger et al. Nature 2010)。しかしその1カ月半後には、同じく脳切片を用いた実験で、シナプス可塑性とアストロサイトの細胞内カルシウムの応答は無関係であるとの報告があり(Agulhon et al. Science 2010)、これら相反する結果の理由は未解明のままです。こうした2つの報告はどちらも脳切片を用いた実験であるため、本来の神経活動が消失しているだけでなく、神経繊維切断による炎症反応でアストロサイトの生理的性質が変化している可能性があります。このため、生きたままの動物の脳を用いたアストロサイトとシナプス可塑性の関係解明が望まれていました。
目の奥(前脳基底部)に存在するマイネルト基底核※8は記憶の形成に重要な役割を果たしていると考えられており、アルツハイマー病の患者では顕著な変性や脱落を示します。そこで研究グループは、マイネルト基底核の活性化と、記憶の形成に重要な大脳皮質でのシナプス可塑性との関係に、アストロサイトが関わると予想し、その検証に挑みました。
研究手法と成果
まず研究グループは、生きたままのマウスの大脳皮質に、シナプス可塑性を誘導する手法の確立に成功しました。具体的には、ラットやネコでの報告を参考に、麻酔したマウスのヒゲには圧縮空気を、マイネルト基底核には電気刺激を、5分間100回“同時刺激”しました。その結果、同時刺激後には、脳波の応答の大きさが平均24%増大し、大脳皮質でのシナプス可塑性の誘導に成功しました(図1)。次に、“同時刺激”でシナプス可塑性を誘導している最中に、アストロサイトが活動しているかどうかを検証しました。麻酔したマウスの大脳皮質にあるアストロサイトのカルシウム応答を、2光子顕微鏡で観察しながら“同時刺激”を行ったところ、観察視野に存在するアストロサイトの半数以上で細胞内カルシウムの濃度が上昇することを発見しました。
このカルシウム濃度の上昇がシナプス可塑性に関与しているのか、または単なる副産物であるのか検証するために、アストロサイトのカルシウム応答を消失させた遺伝子改変マウス(IP3R2-KOマウス※9)に“同時刺激”を行いました。すると、マイネルト基底核を刺激した時の脳波の応答は正常でしたが、シナプス可塑性が生じないことを見いだしました。これらの結果から、アストロサイト内のカルシウム濃度の上昇がシナプス可塑性に重要な働きをしていることが分かりました。
さらに、このカルシウム濃度上昇によるシナプス可塑性誘導の分子機構を解明するため、半透膜のついた微小管を麻酔したマウスの大脳皮質へ挿入して、細胞外のアミノ酸の量を計測しました(微小透析法)。その結果、マイネルト基底核の電気刺激によって、アミノ酸の一種であるD-セリンの量が5%上昇しました。一方、IP3R2-KOマウスではD-セリン量は増加しないことを確認しました。D-セリンは記憶形成に必須とされているNMDA受容体※10へ結合し、シナプス可塑性を誘導することが知られています。このことから、アストロサイト内のカルシウム濃度の上昇に伴って、細胞外D-セリン濃度が上昇するというメカニズムが、シナプス可塑性誘導の分子機構であると示唆されました。
今後の期待
これまで、マイネルト基底核は、大脳皮質の神経細胞へ直接作用してシナプス可塑性を誘導すると考えられてきました。しかし今回、脳切片ではなく生きたままの動物を用いて、アストロサイトがシナプス可塑性に関与することを示したことから、マイネルト基底核は、アストロサイトを活性化して大脳皮質のシナプス可塑性を誘導することが分かりました(図2)。
今回の発見を足がかりに、今後、脳の記憶や学習形成についてアストロサイトを含めたメカニズムの理解が深まると期待できます。また、アルツハイマー病などにおける記憶障害は神経細胞を対象として研究されてきましたが、アストロサイトのカルシウム応答を標的とした全く新しい治療方法の開拓にもつながると期待できます。
原論文情報
- Norio Takata, Tsuneko Mishima, Chihiro Hisatsune, Terumi Nagai, Etsuko Ebisui, Katsuhiko Mikoshiba, and Hajime Hirase
“Astrocyte Calcium Signaling Transforms Cholinergic Modulation to Cortical Plasticity In Vivo”,The Journal of Neuroscience,Dec 14, 2011
発表者
理化学研究所
脳科学総合研究センター 回路機能メカニズムコア 神経グリア回路研究チーム
チームリーダー 平瀬 肇(ひらせ はじめ)
Tel: 048-467-6918 / Fax: 048-467-9652
お問い合わせ先
脳科学研究推進部
Tel: 048-467-9757 / Fax: 048-462-4914
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.グリア細胞
神経系を構築する細胞のうち、神経細胞ではない細胞の総称。アストロサイトやオリゴデンドロサイト、ミクログリアなどの細胞に分類される。 - 2.アストロサイト
中枢神経系に存在するグリア細胞の1つ。多数の微小突起を持ち、形態が星状(アストロ)に見えることからアストロサイトの名称を持つ。ヒトの脳では神経細胞の1.4倍の数のアストロサイトが存在する。アストロサイトの微小突起は、神経細胞同士の接点であるシナプスに接触している。1つのアストロサイトは10万以上のシナプスと接触しており、ラットの大脳皮質では9割以上のシナプスがアストロサイトと接触している。 - 3.シナプス可塑性
神経細胞間の接点(シナプス)での情報伝達効率が長期的に変化する能力のこと。シナプスにおいて、情報を伝達する側の神経細胞の構造物を前シナプスと呼び、情報を受容する側の神経細胞の構造物を後シナプスと呼ぶ。 - 4.大脳皮質
大脳の表面を覆う、神経細胞の細胞体が多く存在している灰白色をした層(灰白質)のこと。ヒトの場合は厚さ数ミリメートル。これとは別に、神経線維(軸索)が密に存在する脳の部位を白質という。 - 5.脳切片
動物の脳を摘出して薄く切ったもの。厚さは0.3~0.4mmが一般的。酸素や栄養素を含 んだ人工脳脊髄液に浸しておくことで、脳細胞の活動を数時間以上維持できる。ただし多数の神経繊維が切断されており、血流も消失しているため、生体内の環境を保った観察が困難である。 - 6.2光子励起顕微鏡
励起光の波長が長く(近赤外光)散乱しにくいので、生体試料の深い部位にある蛍光分子を励起できる。さらに、蛍光分子から放射される蛍光を効率よく回収する仕組みになっており、生体試料の深部観察に適している。 - 7.D-セリン
アミノ酸の一種。長期記憶の形成に必須とされているNMDA受容体の活性化には、D-セリンの結合が不可欠であることが知られている。NMDA受容体は神経細胞の後シナプスなどに存在する。 - 8.マイネルト基底核
脳底部(前脳基底部)に存在する神経核で、神経情報伝達物質の一種であるアセチルコリンを含む神経細胞が散在している。この神経核の神経細胞は大脳皮質の広範囲に投射繊維を送っている。ラットでは大脳皮質におけるアセチルコリンの8割はマイネルト基底核の神経細胞由来とされている。 - 9.IP3R2-KOマウス
イノシトール三リン酸(IP3)の受容体のうち、アストロサイトだけに存在すると考えられているIP3受容体2型を欠損させたマウス。IP3は代表的な細胞内情報伝達物質であり、細胞内のカルシウム貯蔵庫である小胞体に存在するIP3受容体に結合することで、小胞体から細胞質へのカルシウムの放出を促進する。 - 10.NMDA受容体
グルタミン酸受容体の一種。グルタミン酸と結合して、カルシウムやナトリウム、カリウムなどの陽イオンを透過させるイオンチャンネル共役型受容体である。記憶や学習に深く関わる受容体であることが知られている。
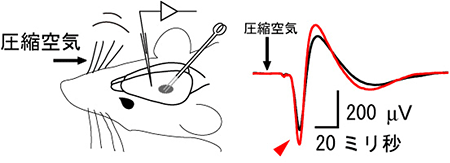
図1 シナプス可塑性の誘導法
マウスのヒゲへ圧縮空気を吹き付けて刺激すると同時に、マイネルト基底核へ電気刺激することを繰り返すと、大脳皮質の神経細胞応答が増大する。右図はヒゲ刺激時の脳波の例。“同時刺激”の前(黒線)から後(赤線)で、脳波応答の大きさが平均24%増大した(赤色矢頭)。
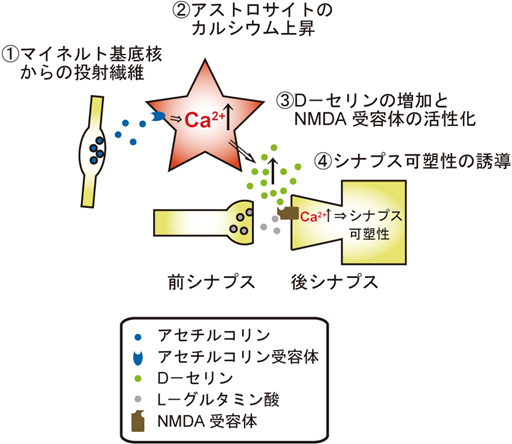
図2 シナプス可塑性にアストロサイトが関与する経路
①マイネルト基底核から放出されたアセチルコリンは、②アストロサイト(赤色)を刺激してカルシウム(Ca2+)上昇を引き起こし、③細胞外D-セリン濃度を上昇させてNMDA受容体へ結合するD-セリンを増やし、④NMDA受容体を活性化させてシナプス可塑性を誘導する。
