2012年4月4日
独立行政法人 理化学研究所
喫煙によって慢性閉塞性肺気腫の発症が早まるメカニズムを解明
-コアフコース糖鎖の減少による肺胞破壊をマウスを用いて確認-
ポイント
- 喫煙がコアフコース糖鎖を作り出す酵素「Fut8」の合成・活性を低下
- コアフコース糖鎖の減少がタンパク質分解酵素の過剰活性化による肺胞破壊を引き起こす
- COPDの予防、早期診断、治療薬の開発の知見として期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、喫煙によりコアフコース糖鎖※1の修飾が阻害されることで肺胞壁が破壊され、慢性閉塞性肺気腫(COPD)の発症が早まることを明らかにしました。これは、理研基幹研究所(玉尾皓平所長)ケミカルバイオロジー領域疾患糖鎖研究チーム/阪大産研-理研アライアンスラボの谷口直之チームリーダー、高叢笑研究員と、群馬大学医学部附属病院呼吸器・アレルギー内科の前野敏孝講師との共同研究による成果です。
COPDは、酸素と二酸化炭素を交換する肺胞が破壊される肺気腫と慢性気管支炎の総称で、気道閉塞による呼吸困難を引き起こします。ウイルスや細菌に感染すると急激に症状が悪化し、死亡率が非常に高くなります。わが国を含め世界的に患者数が多く、その治療法の開発が喫緊の課題となっています。COPD発症には喫煙などの外的要因とさまざまな遺伝的要因が関係していると考えられています。これまでに研究グループは、コアフコース糖鎖を欠損したマウスを用いた実験で、コアフコース糖鎖の減少がCOPD発症の要因の1つであることを見いだしていましたが、喫煙との関係については不明でした。
研究グループは、喫煙とコアフコース糖鎖の減少の関係を明らかにするために、Fut8ヘテロ欠損マウス※2に喫煙させ、経過を観察しました。その結果、正常なマウスに比べて2倍早くCOPDを発症することを見いだしました。さらに、喫煙によりこのマウスの肺組織ではコアフコース糖鎖が減少し、それがタンパク質を分解する酵素のMMP※3を異常に活性化して、肺胞壁を破壊していることが分かりました。
これらのことは、喫煙によってコアフコース糖鎖の合成阻害が進み、COPD発症を早めて症状を悪化させていることを示しています。今後、Fut8ヘテロ欠損マウスを用いて喫煙によって発症するCOPDの病態を調べることで、ヒトに対するCOPDの予防、早期診断、治療薬の開発につながるものとして期待できます。
本研究成果は、米国の科学雑誌『The Journal of Biological Chemistry』オンライン版(3月20日付け:日本時間3月21日)に掲載されました。
背景
慢性閉塞性肺疾患(COPD)は、肺気腫と慢性気管支炎の総称で、気道閉塞による呼吸困難を引き起こします。通常、酸素と二酸化炭素を交換する肺の肺胞構造は、肺胞壁成分の合成とその分解を担うマトリックスメタロプロテアーゼ(MMP)の制御によって維持されますが、喫煙などによりMMPが異常活性化すると肺胞壁が破壊され、COPDが発症することが知られています。日本ではヘビースモーカーの2割が発症し、530万人を越える潜在的患者がいるといわれています(出典:順天堂大学医学部福地義之助客員教授らによるNippon COPD Epidemiology (NICE)study、2001年)。また、ウイルスや細菌の感染により症状が悪化すると死亡率も15%に達します(出典:Eur. Respir. J. 37: 508-515,2011)。1997年の世界保健機関(WHO)の報告では、COPDは全世界の死亡原因の4位であり、2020年には3位になると予測され、予防、発症、症状悪化の抑制、治療薬の開発が社会的喫緊の課題です。COPDの発症は、喫煙などの外的要因とさまざまな遺伝的要因が関係していると考えられています。
1996年に研究グループは、世界にさきがけて転移酵素Fut8の精製、遺伝子クローニングに成功しました。Fut8はN型糖鎖の基部にフコースを付け、コアフコース構造を作る酵素です(図1)。このFut8を欠損したマウスを解析したところ、コアフコース糖鎖を完全に失うと肺気腫を発症することから、コアフコース糖鎖の減少が肺気腫発症の要因となることを報告しています。しかし、喫煙とどのように関連するかは不明でした。
研究手法と成果
喫煙とコアフコース糖鎖修飾障害の関係を明らかにするために、コアフコース糖鎖を作る酵素Fut8の能力を半分にしたFut8ヘテロ欠損マウスを作りました。そして、喫煙装置※4を使って実験用タバコを1日4本週6日、3カ月間喫煙させました。その結果、喫煙正常マウスと比べて喫煙Fut8ヘテロ欠損マウスの肺ではFut8の合成や酵素活性が約50%に低下しており、喫煙後2週間の肺で2倍以上のMMPの活性化が起こり、3カ月後には肺胞の構造が破壊されることを観察しました(図2)。これにより、Fut8ヘテロ欠損マウスに喫煙させると喫煙正常マウスより2倍早く肺気腫を発症することが明らかになりました。さらに、喫煙時のFut8ヘテロ欠損マウス肺細胞の遺伝子発現やシグナル伝達経路を解析しました。正常マウスの肺細胞では、TGF-β※5という分子が受容体に結合し、MMPの発現をおさえて肺胞壁の破壊を防いでいるのに対し、Fut8ヘテロ欠損マウスでは、コアフコース糖鎖の減少によってTGF-βなどの機能が阻害され、MMPが過剰に産生・活性化につながり、肺胞構造の破壊を引き起こすことが分かりました。
今後の期待
現在、COPDの治療法は、気管支拡張剤やステロイド剤の投与といった対症療法だけで、根本的な治療法は存在しません。今回の成果は、喫煙によるCOPD発症のメカニズムを分子レベルで詳細に解明し、根本治療を目指す新しい治療戦略の構築に貢献するものです。また、Fut8ヘテロ欠損マウスは、喫煙によるCOPD発症を短期間に観察できることから、COPDの病態解析に非常に有用なモデル動物となります。
今後、COPDの疾患メカニズムのさらなる解明や治療薬開発が加速されるものと期待できます。
原論文情報
- Congxiao Gao, Toshitaka Maeno, Fumi Ota, Manabu Ueno, Hiroaki Korekane, Shinji Takamatsu, Ken Shirato, Akio Matsumoto, Satoshi Kobayashi, Keiichi Yoshida, Shinobu Kitazume, Kazuaki Ohtsubo Tomoko Betsuyaku, Naoyuki Taniguchi. “Sensitivity of heterozygous α1, 6-fucosyltransferase knock out mice to cigarette smoke-induced emphysema: Implication of aberrant TGF-β signaling and MMP gene expression.” (2012) The Journal of Biological Chemistry. doi:10.1074/jbc.M111.315333
発表者
理化学研究所
基幹研究所・ケミカルバイオロジー研究領域
システム糖鎖生物学研究グループ・疾患糖鎖研究チーム
チームリーダー 谷口 直之(たにぐち なおゆき)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.コアフコース糖鎖
タンパク質のアスパラギン残基上に形成される糖鎖(N型糖鎖)の基部にフコースが結合した構造で、タンパク質の機能制御に重要である事が知られている。 - 2.Fut8ヘテロ欠損マウス
1対あるFut8遺伝子のうち片方の対立遺伝子が遺伝子ターゲティングにより破壊された遺伝子型を持つマウス。Fut8は、コアフコース単糖をN型糖鎖の基部に付加することでコアフコース構造を作り出す糖転移酵素。このマウスは正常マウスに比べてコアフコース糖鎖を半分しか作ることができない。 - 3.MMP
マトリックスメタロプロテアーゼ。細胞外基質の分解・代謝を担うタンパク質分解酵素の一群の総称。 - 4.喫煙装置
喫煙実験はマウス専用の喫煙装置を用い、実験用のタバコ(フィルターの無いケンタッキー銘柄の実験タバコ, 2R4F, 1本1g、ニコチン19.66mg、タール8.91mg)を用いて行った。本研究は標準的マウス喫煙プロトコールに従って行われた。 - 5.TGF-β
Transforming growth factor-βの略。細胞の増殖や分化を制御する因子であり、細胞外基質成分の産生を促進することが知られている。
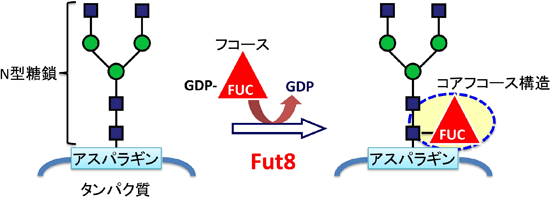
図1 糖転移酵素Fut8によって形成されるコアフコース糖鎖構造
タンパク質のアスパラギン残基上に形成されるN型糖鎖の基部に糖転移酵素Fut8によってGDP(グアノシン二リン酸)フコースからフコースが転移され、コアフコース構造が形成される。
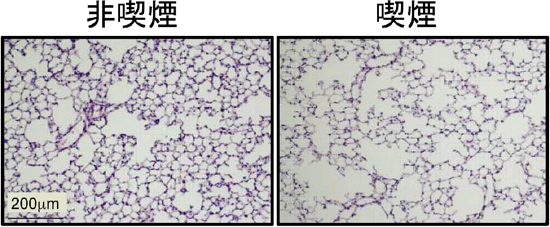
図2 3カ月後の喫煙による肺胞構造の比較
Fut8ヘテロ欠損マウスに3カ月間喫煙させると、肺胞構造が破壊される。
