2012年6月20日
独立行政法人 理化学研究所
特定の糖鎖構造を持つタンパク質だけを可視化する技術を開発
-糖鎖構造の違いでタンパク質の動態変化を見る技術の基盤確立へ一歩-
ポイント
- 従来の常識を覆す脂質二重膜の厚さを越えたエネルギー移動によるFRET検出に成功
- 糖鎖構造の違いで細胞への取り込み速度が異なることを観察
- 糖鎖が関わる多数の疾患の発症メカニズム解明や治療法開発にも寄与する可視化技術
要旨
理化学研究所(野依良治理事長)は、目的とするタンパク質のうち特定の糖鎖構造を持つものだけを検出し可視化できる蛍光イメージング技術を開発しました。これは、理研基幹研究所(玉尾皓平所長)糖鎖代謝学研究チームの鈴木匡チームリーダー、芳賀淑美訪問研究員(日本学術振興会特別研究員)、佐甲細胞情報研究室の佐甲靖志主任研究員、日比野佳代研究員、伊藤細胞制御化学研究室の伊藤幸成主任研究員、疾患糖鎖研究チームの谷口直之チームリーダーらの共同研究グループによる成果です。
タンパク質は、機能を発揮するためにさまざまな翻訳後修飾※1を受けますが、糖鎖修飾(付加)もそのうちの1つです。糖鎖は、タンパク質の立体構造や安定性、水溶性などの性質に大きな影響を及ぼすだけでなく、糖鎖構造の違いがタンパク質の輸送や細胞表面における安定性に関わっている例がさまざまな疾患で報告されています。しかし、糖鎖は生体内で多様な構造で存在するため解析が難しく、「糖鎖構造が変わるとなぜ病気になるのか」など、原因から結果までの全貌を解明することは困難でした。こうした理由から、特定の糖鎖構造を持ったものだけを検出し、細胞内でどのような動きをするのかを可視化する技術が求められていました。
共同研究グループは、2型糖尿病に関わることが知られているGLUT4という膜タンパク質と、単糖の一種であるシアル酸という糖のそれぞれに、2つの異なる蛍光物質を結合させました。GLUT4にシアル酸が付加されて、2つの蛍光物質が接近したときに発せられるFRET(蛍光共鳴エネルギー移動)※2のシグナルを検出することで、シアル酸が付加した糖鎖を持つGLUT4だけを区別することに成功しました。さらに、シアル酸の付加がGLUT4に及ぼす影響を調べるために細胞内への取り込みを観察したところ、シアル酸を持つものは持たないものと比べて取り込み速度が遅いことが分かりました。
今回開発した可視化技術を用いることで、特定の糖鎖を持つタンパク質の細胞内での動きや役割を多角的に調べることができます。また、糖鎖が疾患に深く関与していることから、発症のメカニズムの解明や治療法の開発にも寄与すると期待できます。
本研究成果は、英国の科学雑誌『Nature Communications』オンライン版(6月19日付け:日本時間6月20日)に掲載されます。
背景
生体内で働くタンパク質の大部分は、糖鎖修飾(付加)を受けています。糖鎖は多くの生命現象に関わっており、糖鎖修飾の違いによってタンパク質の機能変異が生じることが知られているほどの重要な因子です。これまで、糖鎖の機能を明らかにするために、糖鎖関連遺伝子を欠損させる手法や糖転移酵素の阻害剤が用いられてきました。しかし、それらの方法では細胞が持つ全てのタンパク質の糖鎖構造が変化してしまい、観察できた現象が真に目的のタンパク質が持つ糖鎖の変化だけに因るかどうかを明らかにすることは不可能でした。一方で、特定の糖鎖構造を持つタンパク質の挙動を生きた細胞内で解析する技術も未だ確立していませんでした。
GFP(緑色蛍光タンパク質)※3をはじめとする蛍光タンパク質技術は、目的のタンパク質を可視化することで生命現象の解析に大きな飛躍をもたらしました。基礎的な細胞生物学研究への貢献はもちろん、癌細胞の追跡からアルツハイマー病に侵された神経細胞の病態の観察にいたるまで、その応用技術は医学にも広く用いられています。共同研究グループは、特定の糖鎖を持つタンパク質においても、GFPのような主流の可視化技術を確立するために基盤技術の研究に取り組みました。
研究手法と成果
共同研究グループは、モデルタンパク質として、2型糖尿病に関わるグルコース輸送体である膜タンパク質「GLUT4」に注目しました。GLUT4は細胞内で1ヶ所の糖鎖付加を受けます。そして一部のGLUT4の糖鎖末端にはシアル酸が付加されることが知られています。通常GLUT4は、細胞内の特殊な小胞に蓄積しており、インスリンの刺激に応答して細胞膜へ輸送され、血中のグルコースを細胞内に取り込みます。2011年、鈴木チームリーダーらは、糖鎖構造の変化や糖鎖を欠損したGLUT4はインスリン応答経路を通らないことを発見し、GLUT4が持つ糖鎖の構造が正しい応答経路を通るための目印となっている可能性を示しました。(2011年7月19日プレスリリース)
このGLUT4の働きに関わる特定の糖鎖構造を調べるために、FRET(蛍光共鳴エネルギー移動)を利用した可視化技術を試みました。FRETは、細胞内で起こるタンパク質間の相互作用などを分子レベルで検出するのに有効な手段として知られています。通常、2つのタンパク質に別々の蛍光物質を結合し、それらのタンパク質が接近するとある蛍光物質(ドナー)からもうひとつの蛍光物質(アクセプター)へ励起エネルギーが移動することでシグナルが検出できます。共同研究グループは、この原理を応用して、GLUT4に特定の糖鎖構造が結合した時にFRETのシグナルが検出できるような工夫をしました(図1)。
まず、GFP(ドナー)を結合させたGLUT4を生きた動物細胞※4に発現させました。次にアジド基というタグをつけたシアル酸を細胞内に取り込ませ、そのシアル酸にGFPとは別の蛍光物質(アクセプター)を結合させます。動物細胞内では、タグ付きのシアル酸が通常のシアル酸(タグは付いていない)と同じようにGLUT4の糖鎖の生合成経路に用いられ、タグ付きシアル酸を持つGLUT4が出来上がります。次にFRETのシグナルの検出を行ったところ、2つの蛍光物質がGLUT4上に揃ったことを意味するシグナルを検出することができました。つまり、シアル酸を持つGLUT4だけを区別して可視化することに成功しました。
GLUT4に結合しているGFP(ドナー)は細胞内側に、蛍光物質(アクセプター)は細胞外側にあり、その間には約3nmの脂質二重膜が存在しています。これまで脂質二重膜を挟んだFRETシグナルの検出は難しいと考えられていましたが、研究グループはFRETが起こりえる距離が最大10nmであることに着目しました。今回の研究成果から、脂質二重膜を越えて励起エネルギーが移動できることが実証できました。これは驚くべき結果でした。
さらに、シアル酸の付加がGLUT4に及ぼす影響を調べるために細胞内への取り込みを観察したところ、シアル酸を持つGLUT4は持たないものと比べて取り込み速度に違いがあることが分かりました(図2)。このように本研究によって特定の糖鎖を持つタンパク質の挙動解析を初めて実現することが出来ました。
今後の期待
糖鎖構造の変異が、癌をはじめとしたさまざまな疾患に密接に関係していることは広く知られています。そのような疾患に関わるタンパク質とその糖鎖の構造が、「いつ」「どこで」「どれくらい」ダイナミックに変化して、それらがそのタンパク質の局在や機能にどのような役割を果たしているのかを知ることは、発症や症状の悪化などの過程を明らかにする上で重要と考えられます。本研究により、特定の糖鎖構造を持つタンパク質のリアルタイム解析が可能になりました。糖鎖変異によるタンパク質の機能や局在変化のメカニズムが解明されれば、さまざまな疾患の予防や治療法の開発に役立つことが期待できます。また、本技術を用いて、特定の糖鎖構造を持ったタンパク質の動態を変化させる薬剤のスクリーニングへの展開も期待できます。
原論文情報
- Yoshimi Haga, Kumiko Ishii, Kayo Hibino, Yasushi Sako, Yukishige Ito, Naoyuki Taniguchi and Tadashi Suzuki. “Visualizing specific protein glycoforms by transmembrane fluorescence resonance energy transfer” Nature Communications, 2012, doi:10.1038/ncomms1906.
発表者
理化学研究所
基幹研究所 ケミカルバイオロジー研究領域
システム糖鎖生物学研究グループ
糖鎖代謝学研究チーム
チームリーダー 鈴木 匡(すずき ただし)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.翻訳後修飾
タンパク質はDNAの情報を基に生合成(翻訳)された後、生体内の多くの酵素によってリン酸化、糖鎖付加、脂質付加、メチル化、アセチル化などを受ける。これらの修飾によってタンパク質の機能や活性が調節されている。 - 2.FRET(蛍光共鳴エネルギー移動)
Fluorescence Resonance Energy Transferの略。ドナーとアクセプターの2つの蛍光物質が十分に近接すると、ドナーからアクセプターへ励起エネルギーが移動する現象。細胞内で起こるタンパク質の相互作用や分子レベルの事象を検出するのに用いられる。 - 3.GFP(緑色蛍光タンパク質)
Green Fluorescent Proteinの略。下村脩博士が1960年にオワンクラゲから見つけた分子量約27kDaの蛍光タンパク質。生きた細胞内で、特定の場所や機能しているタンパク質を発光させることができる。2008年、下村博士ら3博士が、「緑色蛍光タンパク質(GFP)の発見と発光機構の解明」によってノーベル化学賞を授与された。 - 4.動物細胞
今回実験で用いたのは、主にヒト子宮頸癌由来の細胞(HeLa細胞)とCHO(Chinese Hamster Ovary)細胞。
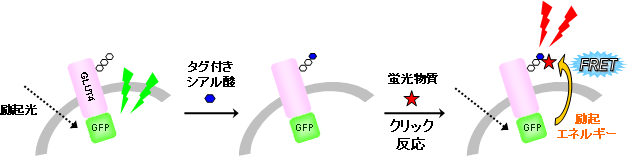
図1 特定の糖鎖構造を持つタンパク質の可視化
まずGFP(ドナー)をGLUT4に結合させて細胞内に発現させる。GLUT4-GFPを発現させた細胞にアジド基というタグのついたシアル酸を取り込ませた後、そのタグに蛍光物質(アクセプター)を結合させた。特定の糖(この場合ではシアル酸)を持っていない場合にはGFPのシグナルしか検出できないが、特定の糖で修飾されていた場合、FRETシグナルが検出される。
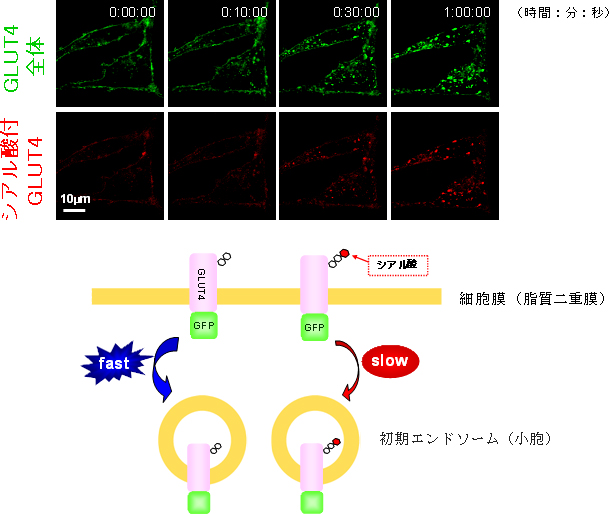
図2 GLUT4の細胞内取り込みは糖鎖構造によって変化する
- 上図:GLUT4(緑)およびシアル酸を持つGLUT4(赤)の、細胞内への取り込みを観察した共焦点画像。シアル酸を持つGLUT4(赤)は、GLUT4(緑)より遅れてシグナルが増えたため、GLUT4(緑)よりも細胞内への取り込み速度が遅いことが示唆された。
- 下図:今回観察した結果の模式図。シアル酸を持つGLUT4の細胞内への取り込み速度は、シアル酸を持たないGLUT4に比べて遅いことが示唆された。
