ポイント
- GPRC5B遺伝子欠損マウスは肥らず、2型糖尿病発症が抑制される
- GPRC5Bは細胞膜に存在し、脂質代謝に関わる情報伝達システムを制御する
- 肥満による2型糖尿病の発症機構の理解および新治療法の開発に期待
要旨
理化学研究所(野依良治理事長)は、脂肪細胞表面に局在するGタンパク質共役受容体(GPCR)※1の一種であるGPRC5B※1が、肥満による2型糖尿病※2の発症において極めて重要な役割を果たすことを発見しました。これは、理研脳科学総合研究センター(利根川進センター長)神経膜機能研究チームのYeon-Jeong Kim(キム ヨンジョン)研究員、平林義雄チームリーダーらの研究チームによる成果です。
肥満は2型糖尿病の主な危険因子であり、脂肪組織の慢性炎症※3が引き金となって血液中のブドウ糖(グルコース)の量が上昇し、2型糖尿病が発症します。一方、近年になってヒトゲノムの解析技術が進み、SNPなどの塩基配列と疾患の関係について明らかになってきています。過去に研究チームは、ショウジョウバエでグルコース応答細胞膜受容体として同定されたBOSS遺伝子が、ヒトにおいてはGPRC5B遺伝子として保存され、肥満に関係していることを発見しました。しかし、その機能は未だ解明されていません。
今回、このGPRC5Bの機能を探るため、GPRC5Bタンパク質複合体を精製し、GPRC5Bに結合する因子を同定しました。その結果、GPRC5Bは細胞内外シグナル発信の基地となる脂質ラフト※4という細胞膜上の特別な領域に局在し、細胞内外シグナルの伝達に重要な役割を担うチロシンリン酸化酵素Fyn※5と結合してその酵素活性を制御することを見いだしました。一方、GPRC5Bは脂肪組織と中枢神経系に高い発現を示していました。さらに、研究チームはGPRC5Bの機能や肥満との関連性を探るため、GPRC5B遺伝子欠損マウスを作製しました。野生型マウスとGPRC5B遺伝子欠損マウスに高脂肪食を与えたところ、野生型マウスは劇的に肥って2型糖尿病を発症したのに対し、GPRC5B遺伝子欠損マウスは肥らず、血糖値も正常な値を示すこと、脂肪組織の慢性炎症も見られないことが分かりました。これらの結果は、エネルギーの消費と蓄積のバランスが崩れることでGPRC5BによるFynの酵素活性の持続が脂肪細胞の慢性炎症を引き起こす根本的なメカニズムであることを示します。この成果は、肥満による2型糖尿病の発症機構の理解と新たな治療法の開発に役立つと期待できます。
本研究成果は、米国の科学雑誌『Science Signaling』に掲載されるに先立ち、オンライン版(11月20日付け:日本時間11月21日)に掲載されます。
背景
生体エネルギーの元となる脂肪は、食物から摂取したり体内で炭水化物から合成したりして主に脂肪組織に蓄積されています。蓄積された脂肪は、さまざまな分解経路を経てエネルギーに変換され、生物はそれを利用して生命を維持しています。脂肪の蓄積と消費のバランスを制御することは、ヒトも含め生命体の健全性を維持するうえで重要です。食物の過剰な摂取や枯渇による蓄積-消費バランスの破綻は、さまざまな病気の発症につながります。特に近年になって、糖尿病、高脂血症、高血圧症などの疾病リスクを高める肥満は増加の一途をたどっており、早急な予防対策が求められています。肥満の分子メカニズムを理解するためには、組織間で制御されているエネルギー代謝を調節する仕組みを調べることが重要です。しかし、この仕組みは複雑で容易に明らかにすることは困難です。
最近の研究により、細胞膜上の構造がエネルギー代謝制御に深く関係していることが分かってきています。2008年に研究チームは、ヒトからショウジョウバエまで共通して保存されているGタンパク質共役受容体(GPCR)の一種であるBOSS/GPRC5Bを発見し、その機能を詳細に解析しました。BOSS/GPRC5B遺伝子は、ショウジョウバエでは複眼形成過程に関わるSvenless遺伝子に関連する因子として中枢神経細胞に発現していましたが、それだけではなく脂肪体(脂肪組織)にも発現していて、体全体のエネルギーバランスの維持に関わる膜機能分子であることを発見しました(2008年9月23日プレスリリース)。
今回、研究チームは、GPRC5Bが関わる詳細なエネルギー代謝制御機構の理解を目指して、その機能やそれに関わる因子など解明に挑みました。
研究手法と成果
研究チームは、ヒト胎児腎細胞由来の培養細胞を用いて、GPRC5Bと結合する因子を含んだタンパク質複合体を分離精製し、分子ふるいクロマトグラフィー※6で解析しました。その結果、GPRC5Bは、細胞膜上で細胞内外シグナル発信の基地となる領域(脂質ラフト)に存在するタンパク質(カベオリン‐1)と一緒に脂質ラフトに局在することが分かりました。脂質ラフトは細胞外との情報伝達に使われる受容体や酵素が密集している通路です。さらに、情報伝達に重要な役割を担うチロシンリン酸化酵素の一種であるFynとも結合することを見いだしました(図1A)。また、GPRC5BとFynの結合が、Fynのリン酸化酵素活性に影響するかどうか調べるために、Fynと結合しないGPRC5B変異遺伝子を作製しました。正常のGPRC5BとFynの酵素活性を比較すると、GPRC5B変異遺伝子ではFynの酵素活性は低下しました(図1B)。これらのことから、GPRC5Bは脂質ラフトでFynの酵素活性制御に必要な因子であることが分かりました。
一方、ゲノムワイド関連解析※7において、GPRC5Bは肥満と関連していることが報告されていました(Speliotes et al., Nature Genetics 2010)。GPRC5Bの機能と肥満および2型糖尿病との関連性を探るため、研究チームはGPRC5B遺伝子欠損マウスを作製しました。野生型マウスとGPRC5B遺伝子欠損マウスに高脂肪食を与えたところ、野生型マウスは劇的に肥って2型糖尿病を発症したのに対し、GPRC5B遺伝子欠損マウスは肥りませんでした(図2A)。次に、これらのマウスにグルコースとインスリンを与え、時間ごとに血中のグルコース量を測定しました。正常な野生型マウスだと血中のグルコース濃度は速やかに一定量まで下がり保たれますが、糖尿病を発症した野生型マウスでは、インスリン感受性が低下する(効かない)ためグルコースの血中濃度はなかなか下がりません。ところが、GPRC5B遺伝子欠損マウスはインスリン感受性が高く、肥満による2型糖尿病の発症が抑制されていることが分かりました(図2B)。肥満は2型糖尿病の主な原因であり、脂肪組織の慢性炎症が一般的な所見として知られていて、肥満と慢性炎症の相関関係は以前より注目されていました。近年、脂肪組織の慢性炎症を活性化する新しい因子としては、自然免疫やガンに関係したタンパク質リン酸化酵素IKKε※8が注目されています。野生型マウスとGPRC5B遺伝子欠損マウスに高脂肪食を与える実験でIKKεの発現量の推移を調べてみると、野生型マウスの脂肪組織ではIKKε発現量が増加しますが、GPRC5B遺伝子欠損マウスの脂肪組織では低い発現量のままでした。(図3A)。また、脂肪組織の慢性炎症の有無を判断する指標因子も同じく上昇しませんでした(図3B)。過去の研究によりIKKε遺伝子欠損マウスは、体内の基礎代謝量が上昇することによって抗肥満であることが知られていましたが、同様にGPRC5B遺伝子欠損マウスでも基礎代謝量が上昇することで肥満を抑制することが分かりました。(図3C)
さらに研究チームは、GPRC5Bによる情報伝達システムがどのようにして肥満による慢性炎症を制御するのかを探る目的でマウス胎児線維芽細胞由来の培養細胞を用いた解析に着手しました。GPRC5B遺伝子を発現させた細胞はIKKεの発現が上昇しました。ところが、Fynと結合しないGPRC5B変異遺伝子を発現させるとIKKεの発現には変動がありませんでした(図4)。
これらのことから、GPRC5BによるFynの酵素活性がIKKεを主軸とする慢性炎症の引き金となる情報伝達システムであることが分かりました(図5)。
今後の期待
細胞膜上の脂質ラフトに局在するGPRC5Bは、Fynと結合してその酵素活性を制御し、生物が生き残るために大切なエネルギーを上手に蓄積する装置であり、そしてそれらの情報伝達システムが肥満や2型糖尿病の発症に重要な役割を果たしていることが解明されました。肥満による脂肪組織の慢性炎症は2型糖尿病の治療標的となる重要な生命現象であるため、本研究の成果が新しい治療戦略の開発に役立つことが期待できます。
原論文情報
- Yeon-Jeong Kim, Takamitsu Sano, Takuji Nabetani, Yoshimi Asano, Yoshio Hirabayashi
"GPRC5B Activates Obesity-Associated Inflammatory Signaling in Adipocytes"
Science Signaling, 2012 DOI :10.1126/scisignal.2003149
発表者
理化学研究所
脳科学総合研究センター 疾患メカニズムコア 神経膜機能研究チーム
チームリーダー 平林 義雄(ひらばやし よしお)
お問い合わせ先
脳科学研究推進部
Tel: 048-467-9757 / Fax: 048-462-4914
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.Gタンパク質共役受容体(GPCR)、GPRC5B
GPCRは、細胞外側のリガンド結合部位と細胞膜内の7回膜貫通ヘリックスドメインからなる特徴的な共通構造を持ち、全タンパク質中最大のスーパーファミリーを形成している。細胞外の神経伝達物質やホルモンを受容してそのシグナルを細胞内に伝えており、その時Gタンパク質(large G protein)を介してシグナル伝達が行われる。多くの疾患に関与しているため、市販薬の一部がGPCRを標的としている。このGPCRの機構に関する研究が2012年ノーベル化学賞受賞となった。GPRC5Bは、その構造からGPCRの一種として分類されている。2008年に理研脳科学総合研究センター平林ユニットリーダー(当時)らが、エネルギー恒常性維持にかかわるグルコース応答細胞膜受容体としてショウジョウバエから発見した。 - 2.2型糖尿病
糖尿病はインスリン作用の不足により、慢性的に高血糖が持続する病気。正しく治療されないと、さまざまな臓器が侵され合併症をきたす。糖尿病に特有の糖尿病網膜症、腎症、神経障害といった細小血管症に加え、全身の太い血管にも動脈硬化が進みやすくなり、心筋梗塞や脳梗塞を引き起こす。なかでも2型糖尿病は、インスリン分泌低下とインスリン抵抗性(インスリンの働きが悪くなること)が合わさることによって血糖値が上昇し糖尿病になるタイプ。発症には、遺伝因子(家系)と環境因子(過食、肥満、運動不足などの生活習慣)の両者が深く関わっていることが知られている。 - 3.脂肪組織の慢性炎症
肥満により肥大化した脂肪細胞は、免疫応答に関わる情報伝達物質の1つであるストレス性サイトカインを分泌する。分泌されたサイトカインによって白血球の一種であるマクロファージが呼び込まれ、脂肪組織は極めて弱い炎症状態に陥る。この慢性炎症は2型糖尿病発症の引き金となるため、創薬の標的とされている。 - 4.脂質ラフト
細胞膜上は均一な構造ではなく、脂質分子とタンパク質が、不均一に混在している。なかでもスフィンゴ脂質とコレステロールに富む細胞膜上の部分を脂質ラフトと呼ぶ。この構造体には、情報伝達システムに使われている受容体や酵素が密集しており、情報発信の基地として機能している。 - 5.Fyn
Srcファミリーチロシンキナーゼ(タンパク質リン酸化酵素)の一種。脂質ラフトに存在する代表的な酵素であり、タンパク質相互作用により、その酵素活性が制御される。細胞の増殖および情報伝達システムに重要な役割を担っている。 - 6.分子ふるいクロマトグラフィー
タンパク質や合成高分子などの分子の大きさ(分子量)に基づいて物質を分離、分析する手法 - 7.ゲノムワイド関連解析
遺伝子多型を用いて疾患と関連する遺伝子を見つける方法の1つ。ある疾患の患者(ケース)とその疾患にかかっていない被験者(対照群)の間で、多型の頻度に差があるかどうかを統計的に検定して調べる。ヒトゲノム全体を網羅するような45万~100万カ所のSNPを用いて、ゲノム全体から疾患と関連する領域・遺伝子を発見する。 - 8.IKKε
リン酸化酵素セリンスレオニンキナーゼの種類の1つ。IKKファミリーにはIKKα、IKKβ、IKKε、TBK1の4種類があり、NF-κB(エヌエフカッパービーキナーゼ)の活性化を誘導する。近年、IKKε及びTBK1は脂肪組織の慢性炎症に関わり、肥満関連遺伝子の発現を調節することが明らかとなった。
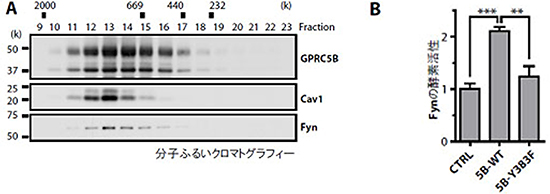
図1 GPRC5BはFynと結合し、Fynの活性を上昇させる
- (A) 分子篩(ふるい)クロマトグラフィーによるGPRC5Bタンパク質複合体の分離・精製。GPRC5Bタンパク質複合体は、カベオリンー1(Cav1)とFynで構成されることが分かった。
- (B) Fynと結合する野生型(正常の)GPRC5B(5B-WT)を発現した細胞ではFynの活性上昇が見られるが、Fynと結合しないGPRC5B変異遺伝子(5B-Y383F)を発現する細胞では、Fynの活性上昇が見られない。
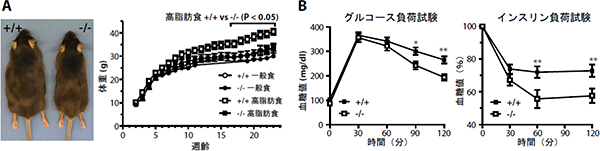
図2 GPRC5B遺伝子欠損マウスは肥らず、高いインスリン感受性を示す
- (A) 高脂肪食および一般食を食べさせ、体重の変動を測定した。高脂肪食投与により、野生型マウス(+/+)は肥るが、GPRC5B遺伝子欠損マウス(-/-)は肥らない。また、一般食投与の場合は両者に大きな差は見られなかった。
- (B) 高脂肪食を与えたマウスにグルコースおよびインスリンを投与して、時間ごとに血液中のグルコースの量を測定した。(グルコース負荷試験とインスリン負荷試験) 左:正常な野生型マウスだとインスリン分泌され働くことで細胞中にグルコースが取り込まれ血中グルコース濃度(血糖値)が速やかに一定量まで下がる。しかし、高脂肪食を与えた野生型マウス(+/+)は、肥満のためインスリンが働かないため血糖値は下がり難くなり、糖尿病を発症する。今回、GPRC5B遺伝子欠損マウス(-/-)ではいずれも血糖値がさがり、インスリン感受性が高く、肥満による糖尿病発症が抑制されていることが分かった。
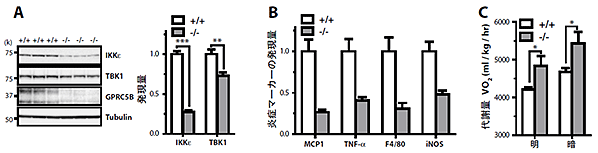
図3 肥満による脂肪組織の慢性炎症と代謝量
- (A) 慢性炎症に中心的な役割を担うIKKεの発現量を比較した。高脂肪食により野生型マウス(+/+)の脂肪組織ではIKKε発現量が増加するが、GPRC5B遺伝子欠損マウス(-/-)の脂肪組織では低い発現量を示した。なお、TBK1はコントロールとして用いている。
- (B) 脂肪組織での慢性炎症の指標となる遺伝子(MCP1、TNF-α、F4/80、iNOS)の発現は、野生型マウス(+/+)に比べGPRC5B遺伝子欠損マウス(-/-)は低い水準を示した。
- (C) IKKε遺伝子欠損マウスのように、GPRC5B遺伝子欠損マウス(-/-)の代謝量は明暗いずれの場合も野生型マウス(+/+)に比べ高い。マウスは夜行性のため夜に活動することから暗の状態のほうが代謝量が高い。
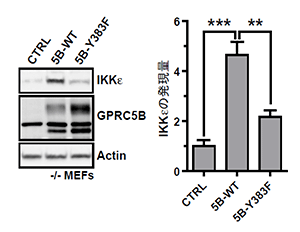
図4 GPRC5BとFynの結合はIKKεの発現を上昇させる
GPRC5B遺伝子欠損細胞にGPRC5B遺伝子(5B-WT)を発現させるとIKKεの発現量が増える。しかし、Fynと結合しない変異GPRC5B遺伝子(5B-Y383F)を発現させると、IKKεの発現量は増えない。
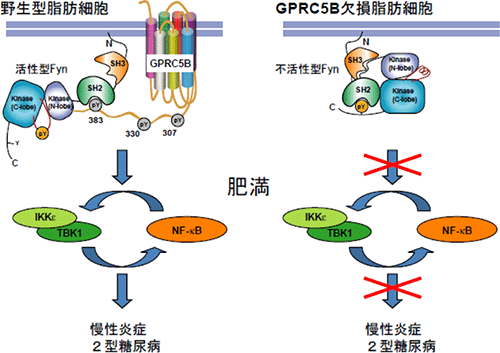
図5 GPRC5Bによる脂肪組織慢性炎症の制御機構
GPRC5Bは細胞膜上の脂質ラフトに存在し、Fynの酵素活性を制御することで生物が生きるために大切なエネルギーの蓄積を促す装置であり、Fynの酵素活性がIKKεを主軸とする慢性炎症の引き金となる情報伝達システムであることが示された。
