2012年12月18日
独立行政法人理化学研究所
TDP-43タンパク質の安定化が神経難病ALSの発症時期のカギ
-遺伝性ALS患者81人の臨床情報と生化学的特性の相関を解析-
ポイント
- ALS発症年齢とTDP-43タンパク質の半減期が相関することを発見
- TDP-43タンパク質の安定化が運動神経細胞の細胞死を誘導
- 安定化が及ぼす病態変化の理解が進み、ALS発症メカニズムの解明に期待
要旨
理化学研究所(野依良治理事長)は、脳や脊髄の病巣に蓄積するTDP-43タンパク質※1の安定化が、全身の筋肉まひを起こす神経変性疾患「筋萎縮性側索硬化症(ALS)」の発症時期を決定する要因であることを明らかにしました。理研脳科学総合研究センター(利根川進センター長)運動ニューロン変性研究チームの山中宏二チームリーダー、渡辺祥司研究員(現 同志社大学高等研究教育機構 助教)らによる成果です。
神経変性疾患の1つで、全身の進行性の筋肉まひを引き起こすALSには、非遺伝性と遺伝性があり、90%が非遺伝性です。ALS発症の原因は不明のままで、発症メカニズムの解明と有効な治療法の開発が望まれています。近年、ALSの病巣にTDP-43タンパク質が異常に蓄積することや、TDP-43遺伝子の変異が30種類以上あることが発見され、病態解明の手がかりを得ました。しかし、これらがどのようにして疾患の発症につながるのかについては未解明でした。
研究チームは、変異TDP-43遺伝子を持つ遺伝性ALS患者81人の臨床情報を解析しました。その結果、ALSの発症年齢が早い患者ほど変異TDP-43タンパク質の半減期※2は長くなり、変異TDP-43タンパク質が安定化することを見いだしました。さらに、TDP-43タンパク質を任意に安定化させることが可能な細胞モデルを作り、解析したところ、TDP-43タンパク質の安定化により、ALS患者の病巣で見られるTDP-43タンパク質の生化学的特徴であるタンパク質の切断や不溶化を再現し、細胞毒性を招くことが分かりました。
今回、遺伝性ALSについての知見を得ましたが、ALSの90%を占める非遺伝性ALSにおいても、TDP-43タンパク質の安定化が、ALS発症に関わる重要な要因である可能性が考えられます。今後、この細胞モデルを用いて、TDP-43タンパク質の安定化が引き起こす運動神経変性に至る機序を解明することにより、ALSの発症メカニズムの解明が進むことが期待できます。
この成果は、JST戦略的創造研究推進事業チーム型研究(CREST)の研究領域「精神・神経疾患の分子病態理解に基づく診断・治療に向けた新技術の創出」における研究課題「孤発性ALSのモデル動物作成を通じた分子標的治療開発」(研究代表者:祖父江元名古屋大学教授)、文部科学省新学術領域研究「脳内環境」の支援を受けて行われました。なお、米国の生化学・分子生物学会誌『The Journal of Biological Chemistry』に2013年2月号に掲載されるに先立ち、12月12日(日本時間12月13日)にオンライン版に掲載されました。
背景
筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis; ALS)は、全身の筋肉を支配する運動神経細胞を侵し、呼吸筋を含む全身の進行性の筋肉まひを引き起こす原因不明の神経変性疾患です。ALSの約90%は非遺伝性、残りの約10%が遺伝性で、わが国では約8,500人のALS患者がいると推定されています(出典:公益財団法人難病情報センター)が、有効な治療法は見つかっていません。患者の苦痛に加え、長期にわたって負担の重い介護を必要とするため、原因の解明と治療法の開発が求められています。
主に細胞内の核に分布するTDP-43タンパク質は、細胞質と核との間を往来して、DNAからmRNAを経てタンパク質を合成する転写・翻訳制御やスプライシング制御など多面的なRNA制御を行うと考えられています。近年、ほぼ全てのALSの病巣から、TDP-43タンパク質が核から細胞質へ脱出して異常に凝集・不溶化し、蓄積することが発見されています。さらに、非遺伝性や遺伝性ALSの一部からTDP-43遺伝子の変異が30種類以上見つかっていることから、遺伝的な背景の有無に関わりなく、TDP-43タンパク質の機能異常がALSの病態に関与していることが示唆されます(図1)。従って、アルツハイマー病におけるアミロイドβタンパク質やパーキンソン病におけるαシヌクレインタンパク質の病的蓄積と同様に、ALSの病巣におけるTDP-43タンパク質の異常蓄積は、非常に重要な要因と考えられます。しかし、TDP-43遺伝子の異常がどのようにALS発症に関わっているのか、その詳細については不明でした。
研究手法と成果
研究チームは、変異TDP-43タンパク質の生化学的特徴と、TDP-43遺伝子の変異を持つ遺伝性ALS患者の発症年齢※3、罹病期間(疾患の進行)※3のいずれが相関するのかを明らかにするため、19種類のTDP-43遺伝子変異を持つ合計81人の遺伝性ALS患者について臨床情報を収集しました。一方で、マウス神経の培養細胞に正常(野生型)と変異TDP-43タンパク質を発現させ、タンパク質の細胞内分布、凝集能、タンパク質の半減期を比較・検討し、これらの生化学的特徴とALSの発症年齢または罹病期間との関連を調べたところ、以下のことが明らかになりました。
1)TDP-43タンパク質の半減期はALSの発症時期を決める要因と判明
変異TDP-43タンパク質は、野生型より細胞質に移行しやすく、高い凝集能を持つ傾向があると分かりましたが、これらと発症年齢や罹病期間との相関はありませんでした。また、比較的患者数の多い7種類の変異TDP-43タンパク質の半減期を、パルス-チェイス法※4により測定しました(図2)。その結果、全ての変異TDP-43タンパク質の半減期が顕著に長くなったため、変異TDP-43遺伝子がタンパク質の安定化を引き起こすと分かりました。さらに重要なことは、タンパク質半減期が長くなってタンパク質がより安定化する変異TDP-43遺伝子を持つ患者ほど、早期にALSを発症すると判明しました。
2)TDP-43タンパク質を自在に安定化させる新たな細胞モデルの作製と解析
TDP-43タンパク質の安定化が、ALSの発症時期に関わることに着目し、低分子化合物(Shield1※5)でタンパク質の安定性を制御できるタグ(DDタグ※5)を利用して、TDP-43タンパク質の異常蓄積を再現するマウスの神経細胞モデル(DD-TDP-43)を作製しました(図3-A)。Shield1の添加により、TDP-43タンパク質を安定化させると、時間に依存してTDP-43タンパク質の切断が見られ、界面活性剤(Sarkosyl)に溶けない凝集体の増加も見られました(図3-B)。これらの現象は、ALS患者の病巣で見られるTDP-43タンパク質の生化学的特徴を再現しています。TDP-43タンパク質の安定化・蓄積により、顕著に神経細胞の細胞死が誘導されました(図3-C)。
また、安定化したTDP-43タンパク質は、切断されたり、不溶化したりするだけではなく、TDP-43タンパク質自身のmRNAを分解してタンパク質の異常な蓄積を防ぐ機能(mRNAの負の制御能)が低下することが判明しました。さらに、細胞内の主要なタンパク質分解装置であるプロテアソーム※6の活性を、安定化したTDP-43タンパク質が顕著に阻害すると分かりました(図4)。
以上から、遺伝性ALS患者の臨床情報とTDP-43タンパク質の生化学的特性の相関を検討し、TDP-43タンパク質の安定化がALSの発症時期を決定する要因であることが分かりました。そして、安定化したTDP-43タンパク質は、半減期の延長、自己mRNAの負の制御能の低下、およびプロテアソーム活性の低下を引き起こすことが判明しました。その結果、慢性的に細胞内で蓄積しやすい環境が誘導され、TDP-43タンパク質が蓄積すると運動神経細胞に対して毒性を発揮し、運動神経細胞に細胞死を誘導すると分かりました(図5)。
今後の期待
今回の知見は、遺伝性ALSだけでなく非遺伝性ALSの発症にも極めて重要な要因であることが示唆されます。今後、開発した細胞モデルを利用してTDP-43タンパク質の安定化により運動神経細胞死にいたる詳しい機序を理解し、ALS発症メカニズムの解明や治療薬の開発が進展することが期待できます。
原論文情報
- Shoji Watanabe, Kumi Kaneko, and Koji Yamanaka.
"Accelerated disease onset with stabilized familial Amyotrophic Lateral Sclerosis (ALS)-linked TDP-43 mutations"
The Journal of Biological Chemistry,2012,doi:10.1074/jbc.M112.433615
発表者
理化学研究所
脳科学総合研究センター 疾患メカニズムコア 運動ニューロン変性研究チーム
チームリーダー 山中 宏二(やまなか こうじ)
お問い合わせ先
脳科学研究推進部
Tel: 048-467-9757 / Fax: 048-462-4914
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.
TDP-43タンパク質
414つのアミノ酸からなり、多くの組織・細胞で恒常的に発現するRNA結合タンパク質である。細胞内では主として核に存在するが、核外や核内移行シグナルをアミノ酸配列に有しているため、核と細胞質との間を往来している。翻訳制御やスプライシング制御などをはじめとする多面的なRNA制御を行なうと考えられている。2006年にTDP-43タンパク質がALSや前頭側頭葉変性症の病巣に異常蓄積することが判明し、後にTDP-43遺伝子の変異が一部の遺伝性ALSでみられることから、TDP-43タンパク質の異常が、ALSの発症に関わる重要な因子であると考えられている。 - 2.タンパク質の半減期
タンパク質は、合成と分解を繰り返し、常に新しいものに置換されている。生体内の代謝により、合成されたタンパク質の半分の量が入れ替わる時間を半減期という。 - 3.発症年齢、罹病期間(疾患の進行)
発症年齢はALSの症状を示し始めた年齢で、罹病期間は発症時期から死亡までの年数。いずれも臨床情報に準ずる。 - 4.パルス-チェイス法
タンパク質の半減期を調べるために用いられる実験法。細胞試料を任意の時間だけメチオニン類似体で標識(パルス)し、標識された目的タンパク質を追跡する(チェイス)。 - 5.Shield1、DDタグ
Shield1とは、膜透過性の低分子リガンド(分子量750Da)。DDタグを融合した標的タンパク質と結合すると安定化し、細胞内に蓄積する。DDタグとは、分子量12kDaのFK506結合タンパク質(FKBP12)の一部。通常時は非常に不安定であり、細胞内での半減期は15~30分とされている。Shield1の結合により安定化し、細胞内に蓄積する。 - 6.プロテアソーム
細胞質や核内に分布しているタンパク質を分解する巨大な酵素複合体。ポリユビキチン鎖により標識された変性タンパク質を選択的に分解する。しかし、大きなタンパク質複合体や凝集したタンパク質などは分解できない。
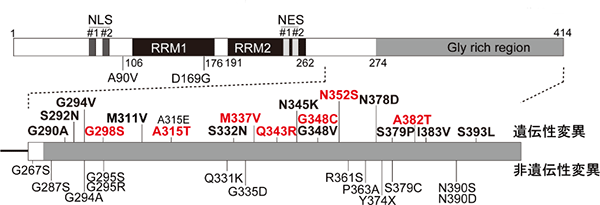
図1 TDP-43タンパク質の構造とALS患者における変異
- 上: TDP-43タンパク質は、414つのアミノ酸からなり、多くの組織・細胞で恒常的に発現している。2つの核内移行シグナル(NLS #1, #2)および核外移行シグナル(NES #1, #2)の両方を持ち、核と細胞質との間を往来している。また、2つのRNA結合領域(RRM1, 2)と、グリシン(Gly)が多数並ぶ1つのグリシンリッチドメイン(Gly rich region)を有しており、翻訳制御やスプライシング制御などのRNA制御を行なうと考えられている。
- 下: ALS患者にみられるTDP-43タンパク質変異は、タンパク質のC末端のグリシンリッチドメイン(274~414アミノ酸)に集中している。特に、G298S、A315T、M337V、Q343R、G348C、N352S、A382Tの7種の変異TDP-43タンパク質を持つ遺伝性ALS患者数が比較的多い(赤字)
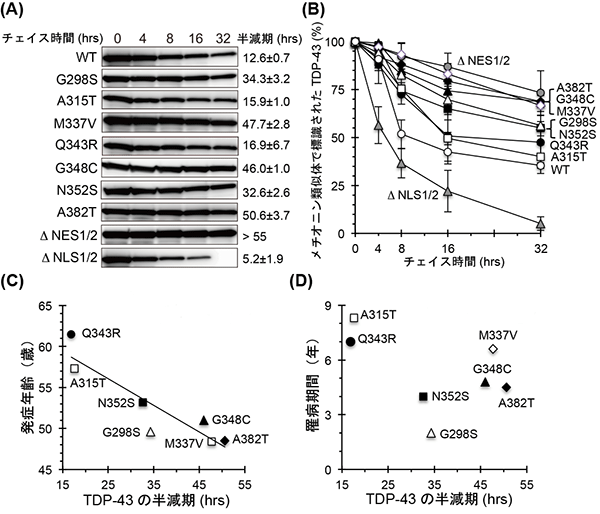
図2 TDP-43タンパク質の半減期はALSの発症時期と相関する
野生型(WT)、比較的患者数の多い7種の変異TDP-43タンパク質(G298S、A315T、M337V、Q343R、G348C、N352S、A382T)、核外・核内移行シグナルを破壊した変異体(NES1/2、NLS1/2)それぞれを、マウス神経細胞内で一過的に発現させ、パルス-チェイス法で半減期を決定した(A、B)。その結果、全ての変異TDP-43タンパク質の半減期が、顕著に長くなった。変異TDP-43タンパク質の半減期と、発症年齢(C)または罹病期間(D)との相関を調べた。その結果、半減期と発症年齢に負の相関(右肩下がりのグラフ)を認め(C)、半減期の長い変異を有するALS患者ほど平均発症年齢は早くなることが判明した。一方、変異TDP-43のタンパク質半減期と罹病期間の間には、相関は見られなかった(D)。
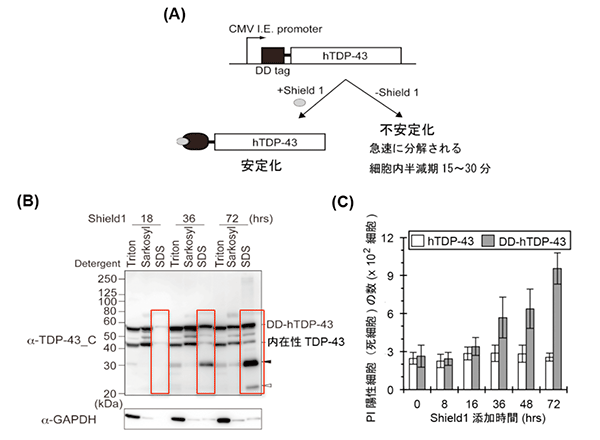
図3 TDP-43タンパク質を安定化する細胞モデル
- (A) TDP-43タンパク質の末端に、FK506結合タンパク質の変異体(DD)を結合させた融合タンパク質に、Shield1を加えるとTDP-43タンパク質が安定化する(+Shield1)。一方、Shield1を加えないでいると不安定化し、急速に分解される(-Shield1)。
- (B) TDP-43タンパク質をShield1により任意の時間安定化させた後、細胞を3種の異なる界面活性剤を用いて段階的に溶解させ、Sarkosylに対する不溶性を検討した。その結果、安定化の時間に依存してSDSにより溶化されるTDP-43タンパク質量(赤枠)が増加した。つまり、Sarkosylでは、不溶化のままのTDP-43タンパク質や切断されたタンパク質断片が増加したことを示す。以上の結果は、ALS患者の病巣で見られるTDP-43タンパク質の生化学的特徴を再現している。
- (C) 安定化したTDP-43タンパク質が細胞内で蓄積すると死細胞数(PI陽性細胞)の増加が見られ、安定化したTDP-43タンパク質は細胞毒性を発揮することが分かった。
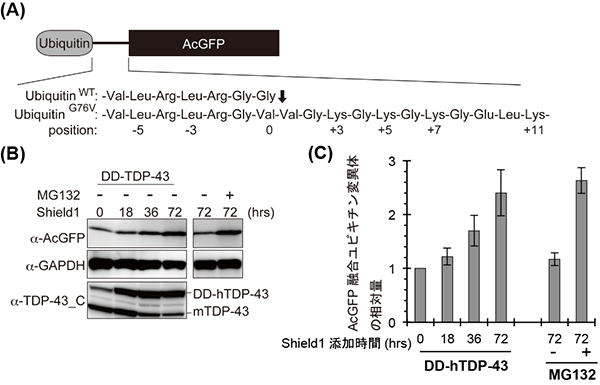
図4 安定化させたTDP-43タンパク質の蓄積による、細胞内のプロテアソーム活性の低下
細胞内のプロテアソーム活性を検討するために、AcGFP(緑色蛍光タンパク質の一種)の末端に分解する目印となるユビキチン変異体(UbiquitinG76V)を結合させた。この融合タンパク質は細胞内でプロテアソームにより分解されるため、プロテアソームの活性は低下しているとAcGFPタンパク質が蓄積し、その量が増加する(A)。このユビキチン-AcGFP複合体とDDタグを結合したTDP-43タンパク質をマウス神経細胞に一過的に発現させ、Shield1により任意の時間TDP-43タンパク質を安定化させた。次に、タンパク質を分離してサイズや量を解析するウエスタンブロット法により、抗AcGFP抗体でAcGFP量を検出・定量した(B、C)。AcGFP融合ユビキチン変異体の量は、安定化したTDP-43タンパク質の蓄積により増加した(B上段、C)。この増加は、プロテアソーム阻害剤(MG132)を添加したときと同程度であったことから(C右)、TDP-43タンパク質の蓄積はプロテアソーム活性の低下を引き起こす。
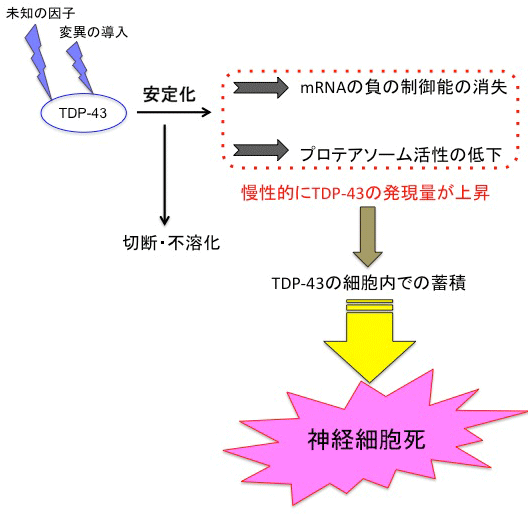
図5 本研究内容のまとめ
変異の導入または未知の因子によりTDP-43タンパク質が安定化すると、TDP-43タンパク質の切断・不溶化が起こる。それに加え、TDP-43の持つ自己mRNA制御能の喪失や、プロテアソーム活性の低下が引き起こされる。これにより、慢性的にTDP-43タンパク質の発現量が上昇し、より一層、細胞内でTDP-43タンパク質が蓄積しやすい環境となり、最終的に運動神経細胞の細胞死を誘導すると考えられる。
