2012年12月26日
独立行政法人理化学研究所
自然免疫と獲得免疫の両方を活性化させるがん免疫療法を開発
-生体内樹状細胞の抗原取り込みと成熟を利用し、多様ながん細胞を排除-
ポイント
- NKT細胞の活性化を利用する「ヒト型人工アジュバントベクター細胞」を作製
- マウスとイヌに加え、ヒト免疫細胞を移植したマウスでも有効性を確認
- がん抗原の入れ替えだけで多様ながんに対応でき、品質が安定した医薬製剤化に貢献
要旨
理化学研究所(野依良治理事長)は、リンパ球の一種であるナチュラルキラーT細胞(NKT細胞)※1や、免疫反応の司令塔である樹状細胞※2を利用して、自然免疫と獲得免疫の両方を活性化させ特定のがんを抑制する「ヒト型人工アジュバントベクター細胞」によるがん免疫療法を開発しました。これは、理研免疫・アレルギー科学総合研究センター(谷口克センター長)免疫細胞移植戦略研究ユニットの藤井眞一郎ユニットリーダー、東京大学医学部付属病院腫瘍免疫学 垣見和宏准教授、山口大学共同獣医学部獣医内科学 水野拓也教授、永井良三前東大拠点長(現自治医科大学学長)らによる共同研究グループの成果です。
生体を外敵から防御する免疫系は、自然免疫と獲得免疫に大きく分けられます。自然免疫ではさまざまな抗原を対象に初期防御を担い、獲得免疫では特定の抗原を強力に排除します。自然免疫において司令塔として機能する樹状細胞は、体内に侵入した抗原を取り込んでその情報をT細胞※3に提示し、T細胞は提示された抗原を認識してそれらを排除する獲得免疫を引き起こします。90年代からは、この樹状細胞を体外で増やしてがん抗原を添加し、再び体内に戻すがん免疫療法が行われてきました。しかし、体外で十分な樹状細胞が得られないなどの問題があり、現在は、体内の樹状細胞を活用する方法が注目されています。
研究グループは、自然免疫に属するNKT細胞の活性化後に樹状細胞が成熟化することに着目し、生体内の樹状細胞にがん抗原を取り込ませる新たながん免疫療法のシステム開発を進めてきました。今回、抗原のタンパク質をコードするmRNAを導入したヒト由来の細胞に、NKT細胞を活性化する糖脂質「α-GalCer(アルファガラクトシルセラミド)※4」を添加した「ヒト型人工アジュバントベクター細胞(aAVC)」を作製しました。aAVCをマウス、イヌ、ヒト免疫細胞移植マウスに投与したところ、自然免疫と獲得免疫の両方が活性化し、特定の抗原を標的にしたT細胞の高効率な分裂・増殖を確認しました。これは、投与したaAVCも自然免疫により殺傷されて生体内の樹状細胞に取り込まれ、導入した抗原がT細胞に提示されたためです。
aAVCは移植医療などで重要なHLA※5の型を問わず、抗原の入れ替えが可能です。今後、多様ながんに対応したがん免疫療法を実現する新たな細胞製剤として医薬製剤化が期待できます。
本研究は、文部科学省「橋渡し研究支援推進プログラム」の支援を受けており、成果は、米国の科学雑誌「Cancer Research」オンライン版に近日掲載予定です。
背景
生体防御を担う免疫系には、先天的な免疫システムでさまざまな種類の抗原を対象に初期防御を担う「自然免疫」と、抗体や多様な細胞性免疫応答によって特定の異物を強力に認識し排除する「獲得免疫」があり、両者が協調して働いています。自然免疫には、マクロファージ、樹状細胞、ナチュラルキラー細胞(NK細胞)、NKT細胞などが関わり、獲得免疫には、B細胞やT細胞といったリンパ球が関与しています。免疫を利用したがんの治療法は、80年代には自然免疫を利用したLAK療法やサイトカイン療法が、90年代初めになると、悪性黒色腫のがん抗原が同定されたのを契機に、がん抗原だけが持つごく小さなタンパク質の断片(ペプチド)を標的にするペプチド療法や、樹状細胞を体外で増やしてがん抗原ペプチドを提示し、再び体内に戻すという獲得免疫を利用した免疫療法が主流となっています。しかし、体外で十分な樹状細胞を増やすことが困難な上、がん細胞はしばしば獲得免疫による排除を免れる場合があることなどの問題点が分かってきました。
研究グループは、自然免疫と獲得免疫の両方を誘導する他者由来の細胞(他家細胞)を利用した免疫療法の開発を目指しています。より強固にがん細胞だけを排除するには、特定の抗原を対象としないNK細胞やNKT細胞を中心とした自然免疫と、特定の抗原を標的にしたT細胞を中心とした獲得免疫の両方を活性化することが重要だからです。すでに、T細胞の標的となるがん抗原と、NKT細胞を直接活性化させることができる糖脂質「α-GalCer(アルファ-ガラクトシルセラミド)」を同時に有する「人工アジュバントベクター細胞」を開発し、生体内の樹状細胞の活性化により自然免疫と獲得免疫の両方の働きを連結させることに成功しています。
今回、ヒト由来の細胞を用いた「ヒト型人工アジュバントベクター細胞(aAVC)」の作製に挑み、マウスとイヌに加え、ヒト免疫細胞を移植したマウスで有効性を調べました。
研究手法と成果
研究グループは、aAVCを作製するために、14種類のヒト線維芽細胞と非線維芽細胞を用いました。各細胞にα-GalCerを細胞表面に提示するために必要なCD1d※6という分子を導入し、細胞増殖率、遺伝子導入効率、NKT活性化能率において高効率な細胞を1つ選びました(HEK293細胞)。このHEK293細胞の培養下にα-GalCerを添加し、抗原として卵白アルブミン(OVA)のmRNAを導入したところ、ヒト型OVA人工アジュバントベクター細胞(aAVC-OVA)の作製に成功しました(図1上)。
次に、aAVC-OVAの効果を、マウスとイヌの前臨床試験で検討しました。まず、正常マウスと樹状細胞欠損マウスにaAVC-OVAを投与して比較すると、正常マウスではOVAだけを認識するT細胞が非常によく分裂・増殖したのに対し、欠損マウスではほとんど増殖しませんでした。これは、樹状細胞がaAVC-OVAを貪食して取り込み、OVAをT細胞に提示して活性化させていたためでした(図1下)。また、大型動物であるイヌで免疫応答と副作用の有無を評価しました。イヌは血中のNKT細胞数が少なく、ヒトの約10分の1しかありませんが、免疫後1~2週間でNKT細胞が10~20倍に増加することや、OVAだけを認識するT細胞が活性化することが分かりました(図2A)。また、心肺機能などの理学所見、血液生化学検査などの副作用検査でも、異常はありませんでした。
さらに、実際にヒトの免疫細胞を活性化させるかどうかを検討しました。まず、ヒト悪性黒色腫のがん抗原(MART-1タンパク質)のmRNAを導入した「ヒト型MART-1人工アジュバントベクター細胞(aAVC-MART-1)」を作製しました。次に、免疫不全マウス(NOGマウス)にヒトの未熟な樹状細胞とNKT細胞、そしてMART-1だけを認識するT細胞を移植しました。このマウスのT細胞は自然には増殖しませんが、aAVC-MART-1で免疫すると、非常に効率よくT細胞が活性化し、分裂・増殖することが分かりました。一方、aAVC-MART-1だけ、ヒトの未熟な樹状細胞とNKT細胞だけ、またはMART-1ペプチドだけを移植した場合はT細胞が活性化しませんでした(図2B)。
これらにより、aAVCを投与すると、NKT細胞の活性化が引き金となって、自然免疫と獲得免疫の両方を誘導できるため、これまでのがん免疫療法にはない効果を発揮することが分かりました。
今後の期待
今回、自然免疫と獲得免疫の両方を活性化するaAVCの作製に成功しました。モデル抗原として卵白アルブミン(OVA)抗原と悪性黒色腫抗原(MART-1)のmRNAを導入し、その機能を実証しましたが、がんの種類に応じてがん抗原を入れ替えるだけで、多様ながんに適応できます。従来の免疫療法は患者本人から血液を採取するオーダーメード療法だったため、医薬品としての開発が困難でした。しかし、aAVCでは、他家細胞を利用するため一定の条件で抗原の発現を調節できます。そのため品質の安定化を図ることができ、医薬製剤化が期待できます。
発表者
理化学研究所
免疫・アレルギー科学総合研究センター 免疫細胞移植戦略研究ユニット
ユニットリーダー 藤井 眞一郎(ふじい しんいちろう)
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.ナチュラルキラーT細胞(NKT細胞)
1986年に千葉大学の谷口克教授(現理研免疫・アレルギー科学総合研究センターセンター長)らが発見した、T細胞、B細胞、NK細胞に続く第4のリンパ球。免疫の制御やがんの免疫学的監視などのさまざまな役割を担う。 - 2.樹状細胞
樹状突起をもつ白血球。微生物の排除やTリンパ球に異物の情報を伝える細胞(抗原提示細胞)として働き、免疫反応の本質的な司令塔としての役割を担っている。 - 3.T細胞
免疫系を構成する主な細胞であるリンパ球はB細胞とT細胞に大きく分けられる。B細胞は抗体(免疫グロブリン)と呼ばれるタンパク質を作り、この抗体がウイルスや細菌、毒素といった異物に特異的に結合して排除する。T細胞は、T細胞レセプターと呼ばれるタンパク質を細胞表面に持ち、このレセプターを介して異物を特異的に認識し活性化する。T細胞はその働きから、ウイルス感染細胞やがん細胞などを特異的に殺すキラーT細胞と、B細胞やマクロファージ(食細胞)などほかの免疫細胞に働きかけてその機能を活性化するヘルパーT細胞に大きく分類されている。 - 4.α-GalCer(アルファガラクトシルセラミド)
NKT細胞だけを活性化する糖脂質リガンドの1つであり、CD1d分子上に提示される。沖縄に生息する海綿の一種( Agelas mauritianus)から得られた。 - 5.HLA
ヒト白血球抗原と呼ばれてきたが、赤血球を除くほぼすべての細胞に発現しており、組織適合性抗原である。自他を認識する免疫機構として働いており、移植医療やがんワクチンにはHLAのタイプが重要となってくる。 - 6.CD1d
抗原の情報を伝えるのに必要な分子(MHC)。β2-ミクログロブリンと非共有結合した膜タンパク質で抗原提示細胞上に発現しており、糖脂質を提示しNKT細胞を活性化する。HLAのような多型性はなく、ヒト、マウス間でも相動性が高いため、同一糖脂質抗原をヒト、マウス無関係にNKT細胞を活性化できる。
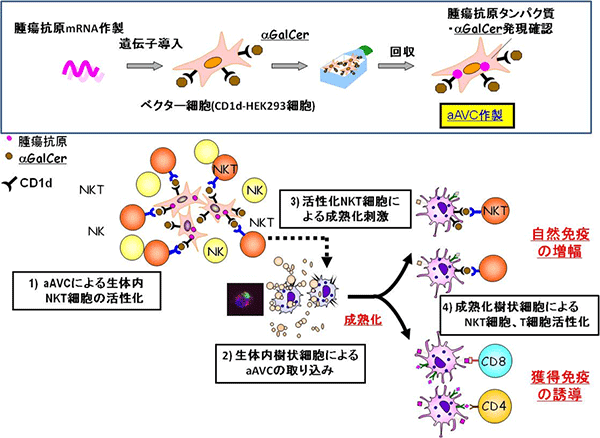
図1 ヒト型人工アジュバントベクター細胞の作製と作用メカニズム
- 上: CD1d分子を発現したHEK293細胞に、NKT細胞を活性化するα-GalCerを添加し、標的となる抗原のmRNAを導入してヒト型人工アジュバントベクター細胞(aAVC)を作製した。
- 下: このaAVCで免疫すると、1)まずNKT細胞が活性化され、次にNK細胞も活性化される。2)aAVC自体は活性化したNKT細胞やNK細胞により殺傷され、近傍の樹状細胞に取り込まれる。3)活性化したNKT細胞は樹状細胞を刺激し、成熟化させる。4)最終的に抗原を取り込み成熟化した樹状細胞は抗原をT細胞へ、α-GalCerをNKT細胞へ提示して獲得免疫の誘導と自然免疫の増幅という免疫の連鎖反応が起こる。
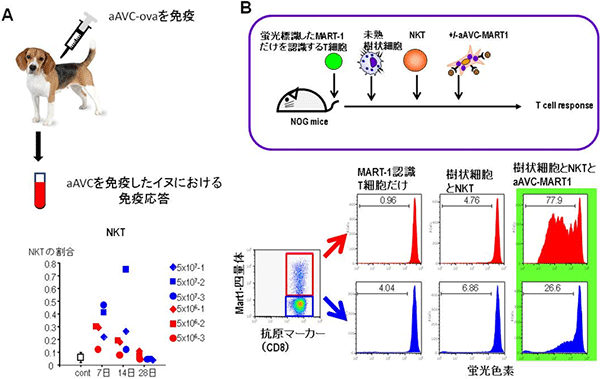
図2 ヒト細胞におけるaAVCの評価
- A: 5x106, 5x107個のaAVC-ovaをイヌ(ビーグル犬)に免疫し、経時的に免疫応答を解析したところ、7日~14日でNKT細胞の増加を確認できた。
- B: ヒト由来の未熟樹状細胞、NKT細胞、MART-1だけを認識するT細胞を移植した免疫不全マウスに、aAVC-MART-1を免疫しT細胞の分裂・増殖を検討した。その結果、樹状細胞+NKT細胞+aAVC-MART-1で最もよく分裂した。これは、ヒト樹状細胞がaAVC由来のMART-1をT細胞に提示できたことを示している。
