2013年2月12日
独立行政法人理化学研究所
国立大学法人大阪大学
生物内部を高速・高精細にイメージングが可能に
-多点共焦点顕微鏡法を二光子励起法の適用で生体観察向けに改良-
ポイント
- 多点共焦点顕微鏡法の問題点“ピンホール・クロストーク”を解消
- 生物の30~100μm深部での観察画像のコントラスト比が30倍以上向上
- 広くライフサイエンス分野での貢献に期待
要旨
理化学研究所(野依良治理事長)と大阪大学(平野俊夫総長)は、生物個体や組織など、厚みがある試料内部の高速・高精細に蛍光イメージングを可能とする装置を開発しました。これは、理研発生・再生科学総合研究センター(理研CDB 竹市雅俊センター長)光学イメージング解析ユニットの清末優子ユニットリーダー、下澤東吾研究員(現 学習院大学所属)と、大阪大学大学院工学研究科の藤田克昌准教授、大阪大学微生物病研究所の山縣一夫特任准教授、理研CDBの形態形成シグナル研究グループの近藤武史基礎科学特別研究員、非対称細胞分裂研究グループの下向敦範専門職研究員、今野大治郎研究員、理研生命システム研究センター(柳田敏雄センター長)発生動態研究チームの髙山順特別研究員、先端バイオイメージング研究チームの渡邉朋信チームリーダー、横河電機株式会社の共同研究グループ、およびコヒレント・ジャパン株式会社の協力による成果です。
生物を詳細に観察するライフサイエンスの研究には、生体分子や細胞の挙動を可視化するイメージング技術が欠かせません。しかし、細胞内で活発に素早く動き回る分子の挙動を見る技術は進歩しましたが、生物の深部でとらえる十分な手段はほとんどありませんでした。そこで共同研究グループは、既存の装置を改良した新たなイメージング装置の開発に挑みました。
今回、多点共焦点顕微鏡法の一種で、高速撮影が可能なスピニングディスク型共焦点顕微鏡[1]に二光子励起法[2]を適用した装置を開発しました。実際に、緑色蛍光タンパク質(GFP)を融合したタンパク質を導入して細胞内構造を可視化した生きたマウスやショウジョウバエなどの胚や卵を観察し、装置の性能評価を行いました。その結果、試料の100マイクロメートル(μm)深部において、従来に比べコントラスト比で30倍以上の改善を達成、ショウジョウバエ胚25μm深部にある、細胞の形態維持や変形に必要な微小管(直径25ナノメートル:nm)の伸長の様子のライブイメージングに成功し、生物深部の高速・高精細イメージングが可能なことを実証しました。
今後、この装置は、基礎研究だけでなく応用研究や医療など幅広いライフサイエンス研究分野の発展に貢献すると期待できます。
本研究は、「最先端・次世代研究開発支援プログラム」により日本学術振興会を通して助成された研究課題「形態形成における微小管細胞骨格の役割の解析」等の一環として行われたもので、本研究成果は、米国の科学アカデミー紀要『Proceedings of the National Academy of Sciences of the United States of America(PNAS)』に2月11日の週に掲載されます。
背景
近年の生物を詳細に観察するライフサイエンス研究においては、細胞や生体分子の挙動を、それらが本来あるべき生体の内部で観察し、明らかにすることが求められています。しかしこれまで、活発に素早く動き回る分子の挙動を、生物の深部で、高速に可視化する十分な手段はほとんどありませんでした。近年、培養細胞を用いた細胞生物学研究では、多点走査方式を採用したスピニングディスク型共焦点顕微鏡を用いることにより、高速での共焦点顕微鏡解析を実現しました。この顕微鏡は、従来のシングル・ビーム共焦点顕微鏡と比べ20~50倍という高速での観察が可能で、さらにデジタルカメラで撮影することから、低ノイズで高諧調の画像を取得できます。しかし、複数の点を同時に励起するこの多点走査方式では、個体や組織などの厚みがある試料に適用することは困難でした。各励起点とその上下の非焦点面で発生する蛍光が各ピンホールに混入し交差してしまい(ピンホール・クロストーク)、共焦点性が失われてしまうことがその原因です(図1C、D)。
共同研究グループは、高速性はそのままで、さらに生体内部まで高精細に解析可能なイメージング装置を開発するために、スピニングディスク型共焦点顕微鏡の改良を試みました。
研究手法と成果
共同研究グループは、多点走査方式の問題点であるピンホール・クロストークを、①ピンホールの間隔を広げて非焦点面からの背景光の混入を減少させること、および②平面選択的な二光子励起法を適用し、非焦点面での蛍光発生を根本的に抑えること、で改善できると考えました(図1)。具体的には、従来のスピニングディスク共焦点スキャンユニット[3]にあるピンホールアレイディスクのピンホール間隔を約2倍にし、二光子励起の効率を上げるためにピンホールアレイディスクの上に搭載した集光レンズ(マイクロレンズ)の直径も約2倍にした新しいスピニングディスクを開発しました。さらに、ピンホール・サイズの影響を調べるため、ピンホール直径が55μmと100μmのピンホールアレイディスクを作製し、これまで適用されてきた一光子励起法[2]と、今回適用する二光子励起法それぞれの場合を比較・評価しました。
蛍光ビーズや蛍光色素溶液を用いた評価では、新たに開発したスピニングアレイディスクと二光子励起の組み合わせで、期待通りにピンホール・クロストークの抑制を確認しました。さらに、ピンホール直径が100μmのアレイディスクに比べて55μmでは、ピンホール・クロストークの抑制および光軸方向の分解能向上に効果があったことから、ピンホール直径は小さな方がよいことを確認しました。自家蛍光するカボチャの花粉(直径約30μm)を用いた評価では、一光子励起では深部でシグナルとノイズが分離できなくなるのに対し、二光子励起では花粉の粒全体を詳細に画像化できました(図2)。
次に共同研究グループは、より実践的な厚みのある生体試料を用いて、ピンホール直径55μmのピンホールアレイディスクと二光子励起法を適用した新型装置の性能評価を行いました。GFP融合タンパク質を発現させたマウスやショウジョウバエなどの胚や卵を用いて評価した結果、試料の数十μm深部において、従来型に比べてコントラスト比が30倍以上改善できました。GFP融合タンパク質により細胞内にある核を可視化したマウス胚切片の前脳領域では、従来型では核の形状がノイズに埋もれて約30μm深部で判別できなくなるのに対し、新型では100μm以上の深部まで可視化できました(図3)。さらに、GFP融合タンパク質により細胞膜を可視化したショウジョウバエ胚では、80μm以上深部にある細胞の輪郭を詳細に観察できました。
さらに、ショウジョウバエ胚を用いて、今回作製した新型装置と従来のシングル・ビーム共焦点顕微鏡で、一光子励起、および二光子励起をそれぞれ適用し撮影した3次元画像の解像度を比較すると、新型装置に二光子励起を適用したときが、最も高精細な3次元像を構築できることを確かめました。以上から、共同研究グループが開発した新型装置は、生体深部においても十分な強度のGFPシグナルを検出しながら、高速に、かつ高解像度に画像を取得できることを示しました。
また、生きたショウジョウバエ胚やマウス卵の内部で、微小管伸長マーカーEB1-GFP[4]を用いて、直径25ナノメートル(nm)の微小管の伸長の可視化に成功しました(図4)。このことから、今回開発した新型装置がライブイメージングにも応用可能であることを示しました。
この方式ではレーザー光を広げて面で照射するため、高出力のレーザーが必要となります。今回、現時点で入手可能な最高出力の二光子励起用レーザーを用いても、視野の10%以下の領域でしかGFPを励起することができませんでした。今後、既存のレーザーよりも5~10倍出力が高いレーザーの実現により、広視野観察や、GFPと赤色蛍光タンパク質との2色観察が可能となります。
今後の期待
今回開発した二光子励起を適用した新型スピニングディスク共焦点顕微鏡は、これまで培養細胞を用いてなされてきた細胞生物学研究を発展させ、生体内部における細胞と分子の機能解析に必要な生体内イメージングを可能にします。また、イメージングの高速・高精細化は、ライブイメージングのみならず、組織透明化試薬などを用いて透過性を良くした大きな試料全体を3次元的にスキャンし、精密な立体画像を再構築するといった最新のイメージング技術にも最適です。今後、基礎研究のみならず応用研究や医療など、幅広いライフサイエンス研究分野の発展に貢献することが期待できます。
原論文情報
- Togo Shimozawa, Kazuo Yamagata, Takefumi Kondo, Shigeo Hayashi, Atsunori Shitamukai, Daijiro Konno, Fumio Matsuzaki, Jun Takayama, Shuichi Onami, Hiroshi Nakayama, Yasuhito Kosugi, Tomonobu M. Watanabe, Katsumasa Fujita, Yuko Mimori-Kiyosue
"Improving spinning disc confocal microscopy by preventing pinhole cross-talk for intravital imaging"
Proceedings of the National Academy of Sciences of the United States of America (PNAS), 2013. doi :10.1073/pnas.1216696110
発表者
理化学研究所
発生・再生科学総合研究センター バイオイメージング解析室 光学イメージング解析ユニット
ユニットリーダー 清末 優子(きよすえ ゆうこ)
国立大学法人 大阪大学
大学院工学研究科 精密科学・応用物理学専攻
准教授 藤田 克昌(ふじた かつまさ)
お問い合わせ先
神戸研究所 広報・国際化室 泉 奈都子(いずみ なつこ)
Tel: 078-306-3310 / Fax: 078-306-3090
報道担当
独立行政法人理化学研究所 広報室 報道担当
Tel:048-467-9272 / Fax:048-462-4715
国立大学法人大阪大学 工学研究科 総務課評価・広報係
Tel: 06-6879-7231 / Fax: 06-6879-7210
補足説明
- 1.スピニングディスク型共焦点顕微鏡
共焦点顕微鏡法とは、蛍光顕微鏡で光学切片画像(共焦点画像)を得る時に、非焦点面で発生する蛍光をピンホールを用いて排除する手法。一般的な共焦点顕微鏡では、1本のレーザー・ビームを用いて試料を走査する方式がとられているが、画像全体の走査には時間がかかるため、動きが速い対象の撮影には不向きである。それに対し、「スピニングディスク型共焦点顕微鏡(ニポウディスク式共焦点顕微鏡)」は、多数のピンホールが配置されたディスクを回転させて複数のレーザー・ビームで試料を走査し高速撮影する。この方式では画像はデジタルカメラで撮影する。従来のシングル・ビーム共焦点顕微鏡ではシグナルを光電子増倍管で検出するが、デジタルカメラで撮影するスピニングディスク共焦点の方が、低ノイズで観察視野が広く、情報量が多いデータを取得しやすいメリットがある。このメリットは細胞生物学領域において広く認知され、近年の細胞生物研究においては欠かせないツールとなっていた。しかし、複数の点を同時に励起すると、各励起点間の干渉や、非焦点面で発生する背景光の混入により共焦点効果が失われる(ピンホール・クロストーク)ため、大量の背景光を発生する厚みがある試料への適用は困難であり、発生学などの分野では利用されていなかった。 - 2.一光子励起法、二光子励起法、二光子顕微鏡
一般の蛍光顕微鏡法では、蛍光色素は1個の光子を吸収して蛍光を発する(一光子励起法)。これに対し二光子励起法は、蛍光色素が2個の光子を同時に吸収して励起状態へと遷移し蛍光を発する「二光子吸収」現象を利用した蛍光観察手法で、この原理を応用した顕微鏡が二光子顕微鏡である。蛍光物質は一光子励起の半分のエネルギー(2倍の波長)の光子を2個吸収して一光子励起時と同じ波長の光を発生するため、二光子励起には長波長帯域の高出力のフェムト秒パルスレーザーを用いる。長波長の光は、組織など透過性が低い試料の内部に浸透しやすいことから、二光子顕微鏡は生体深部の観察に向いている。また、二光子吸収は光密度が最も高い場所だけで起きるため、焦点面だけで蛍光を発生させることが可能で、この特性を生かして、ピンホールを用いずに光学切片画像を構築する。しかし、一般の二光子顕微鏡はシングル・ビームで試料を走査するので、高速イメージングには最適ではない。 - 3.スピニングディスク共焦点スキャンユニット
多数のピンホールを有するディスクを高速回転させて画像を取得する方式は、一般に「ニポウ式」共焦点法と呼ばれる。1枚のピンホールアレイディスクだけでは光の利用効率が低いため、横河電機(株)は、ピンホールアレイディスクの上にピンホールと同じ間隔でマイクロレンズを配置したディスクを搭載して集光力を向上させた。 - 4.微小管伸長マーカーEB1-GFP
細胞骨格のひとつである「微小管」の先端には、「微小管プラス端集積因子(+TIPs)」と総称されるタンパク質が結合し、微小管の動態や配置を制御している。End-binding 1(EB1)は+TIPsの中心的分子で、微小管が伸長するときにその先端に彗星の様に分布する。EB1にGFPを融合したEB1-GFPタンパク質は微小管の伸長を追跡するため(Mimori-Kiyosue et al., Curr Biol. 2000, 10, 865-868; 注1,2のYouTubeサイト参照)、微小管ダイナミクスの解析に広く用いられている。EB1-GFPコメットはおよそ幅25 ×長さ~500ナノメートルの微細な構造で、生き物深部での検出は容易ではない。
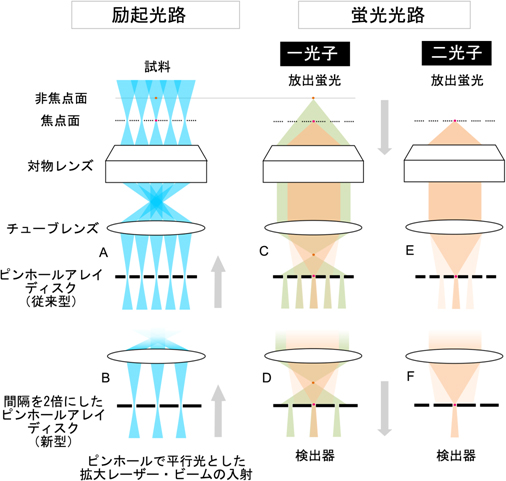
図1 ピンホール・クロストークとその改善戦略
- A、B:従来のスピニングディスク型共焦点顕微鏡法では、広げたレーザー光をピンホールアレイに通して多数の平行光を生成し、ディスクを回転させて試料を走査する。画像取得時には、ピンホールは非焦点面からの背景光を排除する役割を果たす。従来型(A)に比べて、新型(B)ではピンホールの間隔を約2倍に広げた。
- C、D:従来型のピンホールアレイディスクに一光子励起を適用した場合、焦点面で発生し拡散した背景光(薄いオレンジ色の経路)と非焦点面で発生する背景光(緑色の経路)が周辺のピンホールに混入してしまい、共焦点画像が得られなくなる(C)。一方、ピンホール間隔を約2倍に広げた新型の場合、これら背景光の混入を減少させることができた(D)。
- E、F:二光子励起を適用することで非焦点での蛍光の発生を阻止し、ピンホール・クロストークの大部分を防げる。従来型(E)ではマイクロレンズが小さいため集光効率が悪く、GFP発現動物の観察は困難であった。一方、新型(F)では、ピンホール間隔の2倍にともないマイクロレンズの直径を2倍にしたため、ほとんどのクロストークを防げた上、シグナル強度は十分に高く、今回検証した中で最も高解像度の画像取得が可能。
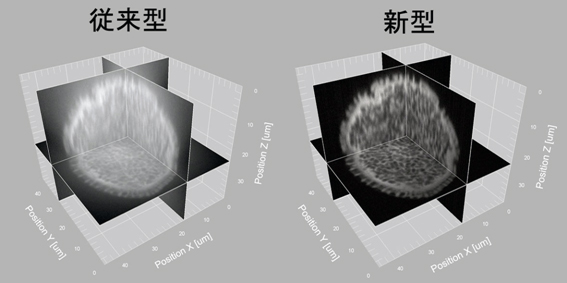
図2 従来型と新型で撮影した花粉の3次元画像の比較
カボチャの花粉を、従来型と新型を用いて撮影し、花粉全体をスキャンし、3次元画像を再構築して花粉の断面を表示した。新型の方が従来型と比較して詳細に花粉を観察できる。

図3 GFP融合タンパク質を発現するマウス胚の切片画像の比較
GFP融合タンパク質を発現するマウス胚の切片を作製し、頭部前脳領域を従来型と新型で撮影した。従来型では、背景光の増加により約30μm深部で核の形状が見分けられなくなるが、新型では100μm深部でも核が判別できる。レーザー強度を上げられれば、さらなるシグナルの向上が可能となる。
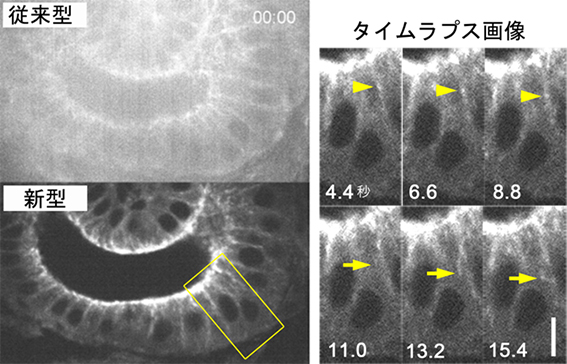
図4 EB1-GFPを発現するショウジョウバエ胚のライブイメージング画像
EB1-GFPを発現するショウジョウバエ胚の約25μm深部を、従来型と新型で撮影した。従来型では、背景光に埋もれて微細構造が全く観察できない。一方、新型では、彗星状のEB1-GFP(黄色囲み)を検出することができ、タイムラプス撮影によってその動く軌跡(黄色矢印)を追跡することができた。スケールバーは、5μm。秒:ミリ秒
