ポイント
- Man2C1が細胞死を抑制する分子メカニズムの詳細が明らかに
- 酵素活性と細胞死抑制はそれぞれ独立して機能する
- がんの増殖・転移を抑える新たな抗がん剤開発に寄与すると期待
要旨
理化学研究所(野依良治理事長)は、糖鎖を分解する酵素「Man2C1」が、酵素活性と無関係に細胞死を抑制する機能を持つことを発見しました。これは、理研基幹研究所(玉尾皓平所長)糖鎖代謝学研究チームの鈴木匡チームリーダー、王麗(ワン リー)特別研究員らの研究チームによる成果です。
生体内の細胞分化やホルモン調節などの基本的な生命現象には、糖鎖[1]とタンパク質が結合した糖タンパク質が大きく関わっています。糖タンパク質は、常に生体内で合成や酵素による分解が繰り返されていて、この分解経路で異常が起きると、心筋機能障害を引き起こすポンぺ病などの病気を発症するため、酵素の働きは重要です。
これまで研究チームは、糖タンパク質がリソソーム[2]と呼ばれる細胞小器官で分解されるという通説に対し、哺乳動物における糖タンパク質の新しい分解経路「非リソソーム糖鎖代謝機構」を提唱してきました。細胞質に存在するMan2C1は、その経路に関わる分解酵素の1つです。Man2C1は、いくつかのがん細胞で発現が増加し、腫瘍の増殖や転移の促進に関連するとされています。一方、Man2C1の発現を抑制すると、さまざまながん細胞で増殖の停止や、アポトーシス[3]と呼ばれる細胞死を引き起こすことが分かっていましたが、その分子メカニズムは不明なままでした。
研究チームは、Man2C1の発現を抑制したさまざまな組織のヒトがん細胞由来の培養細胞株を作製し、細胞に起こる変化を観察しました。その結果、小胞体ストレス[4]時に現れアポトーシスを誘導する転写因子「CHOP[5]」の発現が増加し、このCHOP増加がミトコンドリア[6]を介してがん細胞のアポトーシスを誘導していることが分かりました。一方で、興味深いことにこの細胞死は、人為的に酵素活性を失わせたMan2C1によっても抑制されていました。これは、Man2C1の酵素活性と細胞死抑制が関連なく独立して機能することを示します。
現在、アポトーシスを利用してがん細胞だけを排除する抗がん剤が開発されています。今回の成果により、将来、Man2C1の細胞死抑制機能だけを無くすことができれば、糖鎖分解には影響を与えずにアポトーシスだけを引き起こすような新しい抗がん剤の開発につながると期待できます。
本研究成果は、米国の科学雑誌『The Journal of Biological Chemistry』オンライン版(3月13日付け:日本時間3月14日)に掲載されます。
背景
タンパク質の大部分は、糖鎖と結合した糖タンパク質として存在します。糖タンパク質は、糖鎖部分を細胞の外側に出す形で細胞膜に埋め込まれ、糖鎖が隣の細胞と情報交換することで細胞分化やホルモン調節などの基本的な生命現象を引き起こします。糖タンパク質の生合成の機構についてはほとんどが解明されていますが、どのように分解されるのかについては、まだ未解明の部分が多く残されています。
これまで糖タンパク質は、リソソームと呼ばれる細胞小器官で分解される、というのが通説でしたが、研究チームは、細胞質などリソソーム以外でおこる分解経路“非リソソーム糖鎖代謝経路”を提唱し、関与する酵素を明らかにしてきました。細胞質に存在する糖鎖を分解する酵素「Man2C1」は、その経路に関わる分解酵素として同定されています。
これまでMan2C1は、さまざまながん細胞で発現が増加し、これががん細胞の増殖や転移の促進につながると考えられてきました。一方、発現が抑制されると、細胞増殖の停止や細胞死が引き起こされます。しかし、この機能が糖鎖の分解とどのように関わるのか、また、どのようなメカニズムで増殖の停止や細胞死に至るのかということは、全く不明のままでした。
研究手法と成果
研究チームは、Man2C1の発現抑制が引き起こす効果を調べるため、HeLa細胞[7]をはじめとした、さまざまな組織のヒトがん細胞を使ってMan2C1の発現を抑制した培養細胞株を作製し、観察しました。その結果、小胞体ストレス時に現れる転写因子CHOPの発現増加を確認しました。CHOPは、ミトコンドリア依存的な経路でアポトーシスを引き起こすことが知られています。従って、Man2C1の発現を抑制すると、ミトコンドリア依存的な経路によりがん細胞のアポトーシスが引き起こされると考えられます(図1)。この時、小胞体ストレスは観察されなかったため、Man2C1抑制によるCHOPの発現増加は、小胞体ストレスを介さない経路でアポトーシスを誘導することも明らかとなりました。これは、CHOPの発現要因に新たな知見を与えるものです。
次に、酵素活性と細胞死抑制の機能は互いにどのように関わっているのかを調べるため、人為的に酵素活性を失わせたMan2C1を同一の細胞株に発現させました。その結果、この細胞株でもアポトーシスが抑制されました(図2)。この実験結果から、Man2C1の細胞死抑制と酵素活性は、関連がなく独立した機能であることが分かりました。
今後の期待
今回、Man2C1の発現を抑制するとがん細胞の増殖や転移を抑えられる分子メカニズムが明らかになりました。また、Man2C1の細胞死抑制と酵素活性はそれぞれ独立していることから、将来、細胞死抑制だけを無くすことが可能となれば、糖鎖分解には影響を与えずにアポトーシスだけを引き起こすような新しい抗がん剤の開発につながることが期待できます。
原論文情報
Li Wang and Tadashi Suzuki.
“Dual functions for cytosolic α-mannosidase (Man2C1): its downregulation causes mitochondria-dependent apoptosis independently of its α-mannosidase activity”
The Journal of Biological Chemistry, 2013, doi: 10.1074/jbc.M112.425702
発表者
理化学研究所
基幹研究所 ケミカルバイオロジー研究領域 システム糖鎖生物学研究グループ 糖鎖代謝学研究チーム
チームリーダー 鈴木 匡(すずき ただし)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.糖鎖
細胞膜の表面に存在し、それぞれの細胞に特徴的な構造を外界に示すことで、どんな細胞が存在しているかを周囲の細胞に伝えている。この糖鎖を目印に使って白血球が細菌感染の場に移動したり、神経ネットワークが形成したりしている。 - 2.リソソーム
真核生物が持つ細胞小器官の1つ。糖タンパク質も含めた生体高分子の細胞内分解、代謝の場として機能する。 - 3.アポトーシス
プログラムされた細胞死を指し、生理的には個体の正常な発生に必要であり、またがん化した細胞などの除去の目的でも積極的に引き起こされる。 - 4.小胞体ストレス
正常な折りたたみ構造がとれないタンパク質が、タンパク質合成の場である小胞体で蓄積し、細胞への悪影響(ストレス)を引き起こす現象。例えば適切な糖鎖が付加しないと、タンパク質の折りたたみが阻害されて引き起こされる。小胞体ストレスが細胞の回避機能をの許容範囲を超えると、アポトーシスが誘導される。 - 5.CHOP
C/EBP homologous proteinの略で、C/EBP (CCAAT/ enhancer-binding protein)ファミリーと呼ばれるファミリーに属する転写因子の1つ。小胞体ストレスにより誘導され、細胞にアポトーシスを誘導する。 - 6.ミトコンドリア
真核細胞が持つ細胞小器官の1つ。酸素呼吸の場であるほか、細胞のアポトーシスの抑制にも重要な役割を果たしている。 - 7.HeLa細胞
世界で初めて樹立されたヒトの細胞株(生体外で一定の性質を持って長期間培養できる細胞)。子宮頸(けい)がん由来の細胞で、世界中でさまざまな研究に利用されている。名前は、患者である黒人女性の名前(Henrietta Lacks)に由来する。
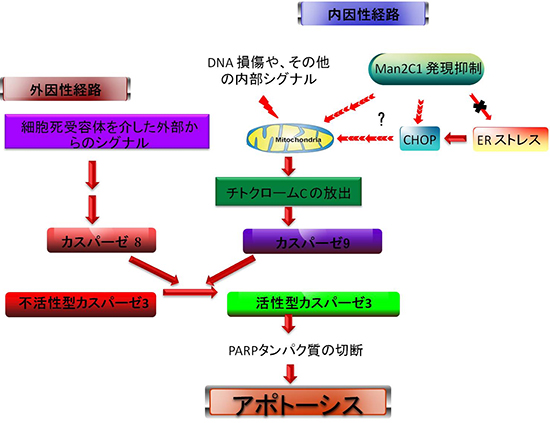
図1 アポトーシスを引き起こす主要な経路
アポトーシスの経路には、外因性経路、内因性経路がある。Man2C1の発現抑制は、内因性経路を活性化させ、小胞体ストレス(ER ストレス)に依存しないで転写因子「CHOP」の発現を増加させる。CHOPが増加すると、ミトコンドリア依存的なアポトーシス*を引き起こす。
*ミトコンドリア依存的なアポトーシス:DNAの損傷といった、さまざまな内因性のシグナルを感知し、ミトコンドリアからチトクロームCが細胞質へ放出、カスパーゼ9や活性型カスパーゼ3の活性化を経てPARP(ポリADPリボースポリメラーゼ)の切断型が増加してアポトーシスを引き起こす。
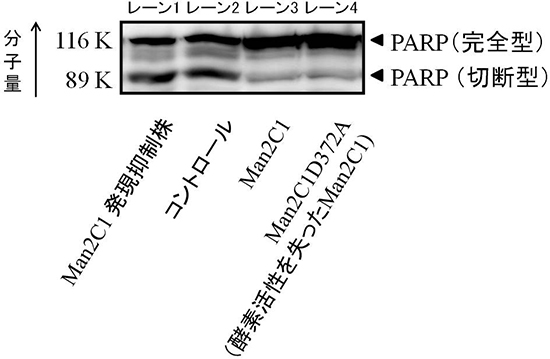
図2 Man2C1の細胞死抑制
アポトーシスが起きると、PARPタンパク質の切断型が増加することを利用した実験を行った。その結果、Man2C1発現抑制株では、PARP切断型の量は増加し(レーン1)、アポトーシスが誘導されたことが分かる。一方、野生型のMan2C1と酵素活性を持たないMan2C1(Man2C1D372A)を発現させると、切断型がほとんど現れず(レーン3、4)、アポトーシスが誘導されていないことを示している。以上から、Man2C1の細胞死抑制は、酵素活性に依存しないことが分かった。
