ポイント
- DNA増幅反応につきものの非特異的増幅と配列の変化を抑制する技術を開発
- 反応液に1種類のタンパク質を加えておくだけの簡便な手法
- 幅広い分野のDNA取り扱い技術の精度向上に寄与
要旨
理化学研究所(理研、野依良治理事長)は、生物がもともと備えているDNA修復機構[1]で働くタンパク質を応用して、遺伝子診断やゲノム解析などに欠かせないポリメラーゼ連鎖反応(PCR)[2]の精度を向上させることに成功しました。これは、理研放射光科学総合研究センター(石川哲也センター長)放射光システム生物学研究グループの福井健二客員研究員(現 大阪大学産学連携本部)、別所義隆チームリーダー、倉光成紀グループディレクターらによる「高度好熱菌丸ごと一匹プロジェクト[3]」で得た研究成果です。
生物の設計図といわれるDNAは、生物分野の基礎研究だけでなく、DNA配列に基づいた臨床診断、残留DNAに注目した犯罪捜査など、現代社会の至るところで利用されています。このとき、目的のDNA配列をある一定の量まで増幅させる「ポリメラーゼ連鎖反応(PCR)」が欠かせません。PCRとは、極めて少量の鋳型DNAを出発点として、長いDNA配列の中から目的の領域だけを約10億倍にも増幅させ、検出や解析を容易にする反応です。この反応では、加熱(約95℃)と冷却(約50℃)を繰り返すたびにDNAを増幅させていきますが、「目的外のDNAも増えてしまうエラー」と「目的のDNAが増えたものの、間違った配列に置き換わってしまうエラー」という2つのエラーが生じます。
これまでに研究グループは、高度好熱菌丸ごと一匹プロジェクトの一環で、90℃を超える環境でも機能するさまざまなタンパク質の構造機能を解析し、中でも、DNAを修復するタンパク質は、DNAの傷害を極めて特異的に認識して結合することを明らかにしてきました。そこで、PCRの2つのエラーが生じる過程で「ミスマッチ塩基対[4]」と呼ばれるDNA傷害の一種が形成される点に着目し、このミスマッチ塩基対に強く結合するDNA修復タンパク質「MutS」を利用しようと考えました。実際に細菌のDNAから、特定の遺伝子領域のDNAをPCRで増幅するときにMutSを加えると、添加量に応じて目的外のDNA増幅が抑制され、間違った配列への置換数も約3分の1に減少しました。
この技術により、今後、幅広い分野のPCR関連技術の効率と精度が改善されると期待できます。
本研究成果は、スイスの科学雑誌『International Journal of Molecular Sciences』(3月22日号)に掲載されました。
背景
ヒトを含むさまざまな生物の全ゲノム配列が解読されている現在、DNAは基礎研究から臨床診断に至るまで幅広い分野で利用されています。このとき欠かせない技術が、特定のDNA配列を選択的に増幅できる「ポリメラーゼ連鎖反応(PCR)」です(図1)。PCRでは、目的のDNA配列を含んだ反応液を加熱したり冷却したりすることで、鋳型を元に複製したDNAを次の反応の鋳型として利用できます。その結果、ごく少量しかないが、入手したいDNA配列だけを約10億倍まで増幅でき、各種検出・解析を容易にします。しかし、PCRでは2種類のエラーが起こり得ます。それは、「目的外のDNAも増えてしまうエラー」と「目的のDNAが増えたものの、間違った配列に置き換わってしまうエラー」です。
DNAは4つの塩基(アデニン:A、チミン:T、グアニン:G、シトシン:C)で構成されており、AはTと、GはCと相補的に結合して二重らせんを構成します。それら以外の塩基の組合わせ、例えばAとG、AとCなどは「ミスマッチ塩基対」と呼ばれます。
PCRが目的の配列だけを増幅できるのは、「プライマー」と呼ばれる短いDNA断片が目的の配列に貼り付き、増幅する範囲を指定するからですが、プライマーが目的外の配列に貼り付くとミスマッチ塩基対が形成されます。その結果、望まない領域の増幅(非特異的増幅)が始まり、目的外のDNAが増えるエラーが起こります。また、DNAの増幅反応そのものを担うのは「DNAポリメラーゼ」と呼ばれるタンパク質ですが、DNAポリメラーゼは一定の割合(例えば、細胞内のDNA複製を担うDNAポリメラーゼの場合は100万回に1回の割合)で間違った塩基を取り込み、ミスマッチ塩基対が作られます。その結果、鋳型とは異なる間違った配列に置換されるエラーが生じます。このように、PCRのある段階でミスマッチ塩基対が生じると、これら2つのエラーが引き起こされます。
研究グループはこれまでに、高度好熱菌丸ごと一匹プロジェクトの研究過程で、高度好熱菌が持つDNA修復タンパク質が、DNAの傷害に対して極めて特異的に結合することを明らかにしてきました。このDNA傷害に対する高い特異性は、分子を真空中の特定の位置に固定するためのアダプターとしての応用が期待されるものであり、タンパク質1分子の立体構造の観察を可能とするX線自由電子レーザー(XFEL)での測定に向けた基礎技術として研究が進められていたものです。そこで、この高い特異性を利用して、PCRの2つのエラー抑制に挑みました。
研究手法と成果
PCRには90℃超える高温の工程がありますが、常温環境で生育する生物由来のタンパク質はそのような高温では壊れてしまいます。一方、高度好熱菌 Thermus thermophilus[5]や超好熱菌Aquifex aeolicus[6]のような高温の環境で生育する生物由来のタンパク質は、90℃を超える温度下でも機能すると予想しました。細胞内には、ミスマッチ塩基対が生じると、それを認識し、修復する系が存在します。すでに高度好熱菌丸ごと一匹プロジェクトの研究で、高度好熱菌が持つDNA修復タンパク質が、DNA傷害に対して極めて特異的に結合することが分かっていました。そこで、最初にミスマッチ塩基対を認識して強く結合するタンパク質「MutS」に着目しました(図2)。
まず、好熱菌由来で耐熱性を有するMutSを調製し、バクテリアゲノムDNAを含んだPCR反応液に加えました。MutSは、ミスマッチ塩基対が生じると、すぐにその部分を認識し強く結合します。その結果、DNAポリメラーゼは接近できず、エラーを含む配列はそれ以上増幅しなくなりました(図3)。実際に2つのエラーについてそれぞれ解析すると、目的外のDNA配列の増幅はMutSの添加量に依存して抑制されており(図4)、間違ったDNA配列へ置換した数は約3分の1まで低下しました(図5)。
今後の期待
今回の成果は、PCRの根源的な改善をもたらすもので、幅広い分野のPCR関連技術の効率と精度の上昇に寄与すると期待できます。
また、PCRのエラーを抑制するには、ミスマッチ塩基対を認識するタンパク質でDNAポリメラーゼの接近を阻害すればよいことが分かりました。ミスマッチ塩基対と呼ばれるDNA構造の中には、MutSが認識できないような特殊な構造も多々ありますが、それら特殊なDNA構造を認識できるDNA修復タンパク質も数多く存在します。こうしたDNA修復タンパク質を同定し、添加できるようになると、よりPCRの精度向上に貢献すると期待できます。
原論文情報
Kenji Fukui, Yoshitaka Bessho, Atsuhiro Shimada, Shigeyuki Yokoyama, and Seiki Kuramitsu. "Thermostable Mismatch-Recognizing Protein MutS Suppresses Nonspecific Amplification During Polymerase Chain Reaction (PCR)."International Journal of Molecular Sciences, 2013, 14, 6436-6453; doi: 10.3390/ijms14036436
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 構造・合成生物学部門
客員主管研究員 倉光 成紀(くらみつ せいき)
お問い合わせ先
放射光科学総合研究推進室
Tel: 0791-58-0900 / Fax: 0791-58-0800
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.DNA修復機構
DNAは複製エラーや活性酸素種などの内的要因と、紫外線や電離放射線の照射などの外的要因により、絶えず損傷を受けている。しかし、生物はこれら損傷を元通りに修復するさまざまなDNA修復機構を備えており、この機構には多くのDNA修復タンパク質が関わっている。 - 2.ポリメラーゼ連鎖反応(PCR)
DNAを増幅するための反応。鋳型となるDNAのうち、望みの領域だけを増幅できる。また、ごく微量しか存在しない鋳型を10億倍にも増幅することができる。まず、鋳型となる2本鎖DNAを高温にして変成させ、1本鎖DNAを生じさせる。反応液を再び冷却するとき、プライマーと呼ばれる短いDNA分子を過剰に加えておくと、この分子が優先的に鋳型と結合し、2本鎖DNA領域を形成する。鋳型-プライマーの2本鎖DNA領域を、DNA合成の役割を担うDNAポリメラーゼが認識し、プライマーの末端を出発点として、残りの1本鎖領域に相補なDNAを合成していく。これにより、2本鎖DNAが複製される。複製されたDNAを再び鋳型として同じサイクルを繰り返すと、DNAが増幅されていく。DNAを変性させるための高温条件でDNAポリメラーゼも変性してしまうと、サイクルごとにDNAポリメラーゼを加える必要があるが、高度好熱菌由来の耐熱性のDNAポリメラーゼを用いると、連続して反応を進めることが可能である。 - 3.高度好熱菌丸ごと一匹プロジェクト
大阪大学を中心に多くの研究者の協力の下に進行中の研究計画で、高度好熱菌サーマス・サーモフィラスHB8株を地球上のあらゆる生物の代表(モデル生物)とし、DNA、タンパク質、糖質、脂質、その他の低分子の構造と機能に基づいて、1つの細胞におけるあらゆる生命現象をシステムとして理解する学問基盤の構築を目指す。この研究計画は以下の4段階を想定している。
第1段階:タンパク質など細胞を構成する分子の、1つの細胞全体の立体構造解析
第2段階:タンパク質など細胞を構成する分子の、1つの細胞全体の機能解析
第3段階:細胞内のそれぞれのシステム(複数分子のネットワーク関係)の解析
第4段階:細胞全体のシミュレーション - 4.ミスマッチ塩基対
DNAはアデニン(A)、グアニン(G)、シトシン(C)、チミン(T)の4種類の塩基がそれぞれ、A-T、C-Gと対合して二重らせんを形成している。それら以外の塩基の組合せ、例えばG-TやC-Aなどをミスマッチ塩基対と呼ぶ。これらは、生体内では主に細胞が増殖してDNAを複製する際に、DNAポリメラーゼが誤った塩基を取り込むことにより生じる。ヒトを含むほとんど全ての生物はミスマッチ塩基対を認識して修復するミスマッチ修復系を備えており、DNA複製の精度を上げている。 - 5.高度好熱菌 Thermus thermophilus
静岡県伊豆半島にある峰温泉から発見された、85℃という極限環境で生育できる細菌。熱水中で生きている細菌(好熱菌)は全生物の共通祖先に近い位置にあり、原始生命の基本的特徴が凝縮されていると考えられている。 - 6.超好熱菌 Aquifex aeolicus
シチリア島から発見された、85~95℃という極めて高温の環境で生育できる細菌。
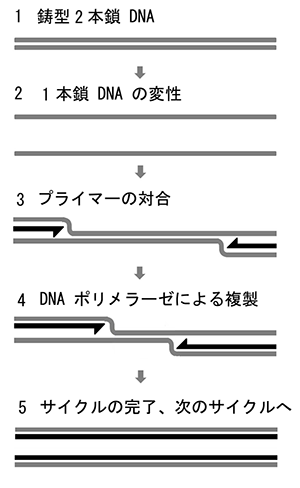
図1 PCR反応
- 1、2鋳型となる2本鎖DNAを高温下に置き、1本鎖DNAへと変性させる
- 3.再び温度を下げる際に、プライマーと呼ばれる短い1本鎖DNA(黒矢印)が優先的に鋳型DNAと対合する
- 4.プライマーと鋳型DNAのハイブリッドをDNAポリメラーゼが認識し、DNA複製を開始する
- 5.複製されて生じた2本鎖DNAは次のサイクルの鋳型として機能する
このサイクルを繰り返してDNAを増幅する
図2 DNA中の傷害を認識し結合するタンパク質「MutS」
ミスマッチ塩基対(緑と黄)に対して、MutSタンパク質(赤)が強く結合している。
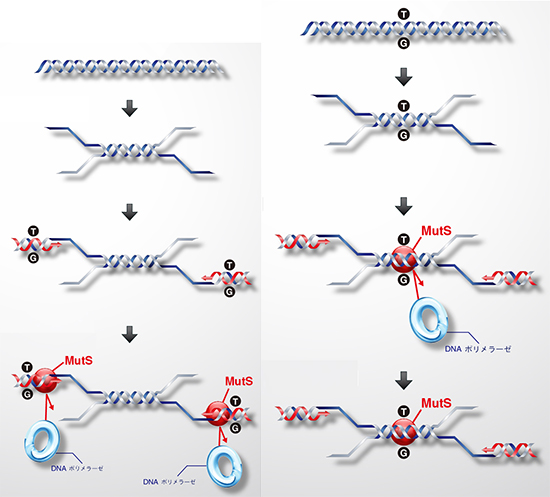
図3 MutS がエラーを抑制する原理
- 左: PCRにおいて、増幅する領域を指定するための「プライマー」が、目的としない領域に誤って結合した際、ミスマッチ塩基対(T/Gの文字で示した)が生じる。これにMutS(赤丸で示した)が強く結合すると、DNAを増幅する分子「DNAポリメラーゼ」が結合できず、目的としない配列の増幅が抑制される。
- 右: DNAポリメラーゼが目的の配列を増幅したものの、配列を変化させて増幅してしまった場合もミスマッチ塩基対が生じる。それをMutSが強く認識することで、DNAポリメラーゼの進行を阻止し、変化した配列を含むDNAがそれ以上増幅されることを抑制する。
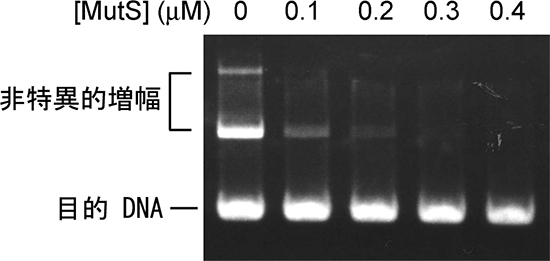
図4 MutSによる非特異的増幅の抑制
PCR反応を行った後に、DNA産物をその長さによって分離し可視化したもの。MutSを加えない左端の条件では、目的DNAの上に2種類の非特異的増幅が見えるが、MutSを加えていくと、非特異的増幅が見られなくなった。
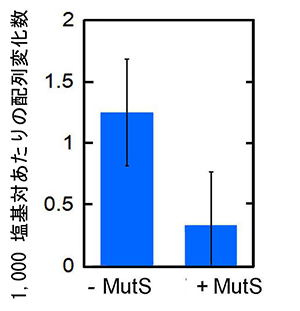
図5 MutSによる間違ったDNA配列への置換の抑制
PCによって増幅された断片の配列を確認し、1,000塩基対あたり何カ所に変化が見られたかを縦軸に表した。MutSを添加することによって、変化する塩基の数が約3分の1に低下した。実験は5回繰り返して行い、標準偏差をエラーバーとして示した。
