ポイント
- ジストニアが大脳基底核の異常活動で起こるという従来説と異なる病態モデルを発見
- 小脳の出力神経細胞「プルキンエ細胞」がジストニア発症の鍵をにぎる
- 神経系の難病であるジストニアの新たな治療法開発に道
要旨
理化学研究所(理研、野依良治理事長)は、細胞内のカルシウム濃度を調節するカルシウムチャネル「イノシトール三リン酸(IP3)受容体[1]」が小脳[2]と脳幹[3]で機能しなくなると、中枢神経系の難治性障害「全身性ジストニア」を発症することを明らかにしました。これは、理研脳科学総合研究センター(利根川進センター長)発生神経生物研究チームの御子柴克彦チームリーダー、久恒智博研究員と、シナプス分子機構研究チームの宮本浩行客員研究員(科学技術振興機構さきがけ研究員)らの共同研究グループによる研究成果です。
ジストニアは、持続的な筋収縮が不随意に起き、全身あるいは身体の一部の捻転、硬直、反復運動を生じる中枢神経系の難治性障害です。病態の多様さから、神経回路レベルでの詳細な発症メカニズムは、まだ明らかにされていません。従来、運動の制御に関わる大脳基底核[4]の異常活動が、ジストニア発症に関わると考えられてきましたが、最近の研究により小脳の異常活動もジストニア発症に関わることが明らかになってきました。しかし、小脳の神経活動がジストニア発症にどのように関わるのかは、未解明のままでした。
共同研究グループは、神経回路の情報伝達に重要な役割を持つIP3受容体に着目し、小脳と脳幹だけでIP3受容体の働きを抑制したマウスを作製しました。その結果、下オリーブ核[5]から伸びる登上線維からのプルキンエ細胞[6]への情報の入力と思われる特徴的な神経活動パターンの増加が、ジストニアによる硬直と密接に関係することなどが分かりました。さらに、ジストニアは、大脳基底核を含まない神経回路で起こることも示し、従来説とは異なるメカニズムを突き止めました。これらの成果を発展させることで、ジストニアの新しい治療法開発につながると期待できます。
本研究成果は、科学雑誌『Frontiers in Neural Circuits』のオンライン版に10月4日に掲載されます。
背景
運動障害、認知症、アルツハイマー病といった脳に関わるさまざまな病気は、情報が脳神経回路上を正しく伝達されない時に発症すると考えられています。この脳神経回路の情報伝達に欠かせない要素の1つが、神経細胞内にあるカルシウムです。カルシウムは、細胞内の情報伝達物質として非常に重要な働きをしています。しかし、過剰なカルシウムは細胞にとって有害となるため、細胞内カルシウムの濃度を適切に調節することが大切です。この濃度調節に重要な役割を果たす分子の1つが、イノシトール三リン酸(IP3)受容体です。IP3受容体は、細胞内に存在するカルシウム貯蔵庫である小胞体の膜上にあるイオンチャネルです。イオンチャネルとは、特定のイオンを透過させる膜タンパク質で、IP3受容体は細胞外からの情報に応じて小胞体から適切な量のカルシウムを細胞内に放出し、濃度を調節しています。IP3受容体には3種類のタイプがあり、タイプ1型のIP3受容体「IP3R1」は脳のさまざまな神経細胞に非常に多く存在しています。
これまでに研究グループは、IP3R1を全身で欠損させたマウス(IP3R1欠損マウス)が、捻転や硬直・後弓反張[7]など、てんかんに似た発作を起こすことを明らかにしてきました。しかし、IP3R1欠損マウスに見られるてんかんに似た発作が、脳のどの領域の神経活動の異常により生じるのか、その発症メカニズムは明らかにされていませんでした。
一方、中枢神経系の難治性障害であるジストニアは、病態の様子から運動の制御に関わる大脳基底核の異常活動が発症に関わると考えられてきましたが、未だ発症メカニズムについて不明のままでした。
研究手法と成果
研究グループはIP3R1欠損マウスに見られるてんかんに似た発作を起こす脳部位や神経回路を特定するために、①海馬/大脳皮質だけでIP3R1を欠損させたマウス(海馬/大脳皮質KOマウス)、②大脳基底核の主要な構成要素である線条体[8]だけでIP3R1を欠損させたマウス(線条体KOマウス)、③小脳/脳幹だけでIP3R1を欠損させたマウス(小脳/脳幹KOマウス)を作製し、観察しました。その結果、③の小脳/脳幹KOマウスだけがIP3R1欠損マウスと同様に、てんかんに似た発作を起こしました。①の海馬/大脳皮質KOマウスと②の線条体KOマウスには明らかな運動障害はみられず、正常でした(図1、2)。
次に共同研究グループは、神経活動の指標となる遺伝子群「cfos mRNA[9]」の量を調べました。cfos mRNAの量が増えるとその領域の神経活動が増えていることを示します。小脳/脳幹KOマウスの脳切片を作製し、cfos mRNAの量を調べた結果、小脳に存在するプルキンエ細胞でcfosmRNAが過剰に増えていることが分りました(図3)。一方、てんかん発症に関連すると考えられている海馬や大脳皮質の領域では、正常マウスと比較してcfos mRNAの量には大きな違いはありませんでした。また、IP3R1欠損マウスと小脳/脳幹KOマウスの大脳皮質の神経活動を調べるために脳波を観察した結果、発作の発症時の脳波に異常は認められませんでした。共同研究グループはこれらの結果とIP3R1欠損マウスに現われる捻転、硬直、後弓反張を踏まえ、「IP3R1欠損マウスに見られる症状はジストニアの病態と同じであり、ジストニアの発症メカニズムには小脳プルキンエ細胞の異常活動が関わるのではないか」という仮説を立てました。
共同研究グループは仮説を検証するために、小脳/脳幹KOマウスのプルキンエ細胞の神経活動に、どのような異常が生じているのかを調べました。具体的には、自由な行動をしている時の小脳/脳幹KOマウスのプルキンエ細胞の神経活動パターンを記録しました。その結果、下オリーブ核から伸びる登上線維からのプルキンエ細胞への情報の入力と思われる特徴的な神経活動パターンの増加が、ジストニアによる硬直と密接に関係することを発見しました(図1、4)。
次に共同研究グループは、プルキンエ細胞の異常活動が小脳/脳幹KOマウスのジストニアを発症させているかどうかを調べました。プルキンエ細胞を持たない「Lurcherマウス」と交配させることで、プルキンエ細胞を無くした小脳/脳幹KOマウスを用いて検証しました。その結果、小脳/脳幹KOマウスのジストニアの症状が消失することが分かりました(図5)。このことから、プルキンエ細胞がジストニア発症に深く関わることが明らかになりました。
さらにジストニア発症に下オリーブ核から登上線維を介したプルキンエ細胞への情報の入力異常が関係するかどうかを検証しました。そのために、小脳/脳幹KOマウスの下オリーブ核に局所麻酔薬であるリドカインを投与しました。その結果、ジストニアの症状が緩和されました。一方、小脳/脳幹KOマウスの線条体のcFosタンパク質の発現や神経活動に明らかな異常は見つからず、また線条体へのリドカインの投与ではジストニアの症状は緩和されませんでした(図6)。
これらの結果から共同研究グループは、小脳と脳幹に発現するIP3R1を欠損させると、オリーブ核を介したプルキンエ細胞への情報の入力が異常になり、ジストニアを発症すると結論付けました(図7)。従来、大脳基底核の主要な構成要素である線条体を介した神経活動の異常が、ジストニア発症に関わると考えられてきましたが、今回の成果により従来説とは異なる発症メカニズムが明らかとなりました。
今後の期待
特定難病疾患である脊髄小脳変性症[10]「SCA15/16」の原因遺伝子として、IP3R1が2004年に同定されました。これまでSCA15/16の患者は小脳失調だけを生じることが報告されてきましたが、最近になってSCA15/16の患者に不随意運動が生じることも報告され始めています。今後、研究を発展させることで、共同研究グループが明らかにしたIP3R1欠損マウスのジストニア発症とSCA15/16患者の不随意運動との関係が明らかになります。また、小脳/脳幹だけでIP3R1を欠損させると下オリーブ核から伸びる登上線維からのプルキンエ細胞への情報の入力がなぜ異常になるのか、その活性化メカニズムの解明が期待できます。
「小脳から出力された異常情報が大脳からの随意信号の情報とどのように交わりジストニアの症状を起こすか」を明らかにしていくことが、新たなジストニアの治療法の確立につながると考えています。
原論文情報
- Chihiro Hisatsune, Hiroyuki Miyamoto, Moritoshi Hirono, Naohide Yamaguchi, Takeyuki Sugawara, Naoko Ogawa, Etsuko Ebisui, Toshio Ohshima, Masahisa Yamada, Takao K. Hensch, Mitsuharu Hattori, and Katsuhiko Mikoshiba."IP3R1 deficiency in the cerebellum/brainstem causes basal ganglia-independent dystonia by triggering tonic Purkinje cell firings in mice" Frontiers in Neural Circuits 2013, doi: 10.3389/fncir.2013.00156
発表者
理化学研究所
脳科学総合研究センター 発生神経生物研究チーム
チームリーダー 御子柴 克彦 (みこしば かつひこ)
研究員 久恒 智博 (ひさつね ちひろ)
お問い合わせ先
脳科学研究推進室
Tel: 048-467-9757 / Fax: 048-467-4914
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.イノシトール三リン酸(IP3)受容体
細胞内のカルシウム貯蔵庫の1つである小胞体の膜上に局在するカルシウムチャネル。細胞外の刺激(神経伝達物質やホルモンなど)に応じて産生されるイノシトール三リン酸(IP3)が結合することによりチャネルが開き、小胞体内のカルシウムを細胞質に放出することで、細胞内のカルシウム濃度を調節する。 - 2.小脳
歩行などの運動や平衡感覚の調節を担う脳の部位。運動の学習にも関わる。小脳に異常があると円滑な動作ができなくなり、平衡感覚が悪化して歩行障害などを引き起こすこともある。 - 3.脳幹
中枢神経系を構成する脳の器官の1つ。延髄と橋(きょう)、中脳と間脳を合わせた領域。生命の維持に関わる呼吸や体温調整、血液循環などの維持に不可欠で、進化の過程において最も古くからある脳部位。 - 4.大脳基底核
大脳皮質と視床、脳幹を結びつけている神経核(線条体、黒質、視床下核、淡蒼球)の集まりで構成される領域。運動機能と密接な関係があり、大脳基底核の機能異常は、パーキンソン病、ハンチントン舞踏病などの運動障害を起こすことが知られている。 - 5.下オリーブ核
延髄にある神経細胞群であり、登上線維と呼ばれる神経線維を伸ばして、プルキンエ細胞へ情報を出力する。 - 6.プルキンエ細胞
小脳皮質に一層に並ぶ神経細胞で、小脳の中で唯一、情報を出力する細胞。特徴的な形をした大型の神経細胞で、よく発達した樹状突起を分子層に伸ばし、顆粒細胞の軸索である平行線維と延髄にある下オリーブ核から伸びる登上線維からの情報の入力を受ける。軸索は白質を通って深部小脳核へ繋がっている。 - 7.後弓反張
頚部を強く背屈させて、全身が後方弓形にそりかえる姿勢のこと。 - 8.線条体
大脳基底核の主要な構成要素で、運動機能学習などの認知機能に関与することが知られている。GABA作動性の中型有棘細胞が多くを占めるが、その他の抑制性神経細胞も存在する。 - 9.cfos mRNA
神経活動の上昇に応じて早い段階で発現が誘導される遺伝子であり、神経活動のマーカーとなる。 - 10.脊髄小脳変性症
小脳・脳幹・脊髄を中心とする神経細胞が変性・脱落し、歩行障害などの強い運動障害をきたす疾患。孤発性、遺伝性を含めて多くの種類が知られている。常染色体優性遺伝性の脊髄小脳変性症は、現在までに約30種類が知られており、その原因となる遺伝子が多数同定されているが、その分子病態は明らかにされておらず、現在、有効な治療法は知られていない。
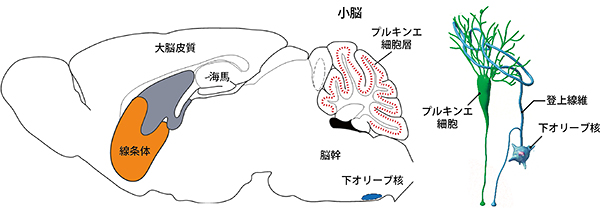
図1 マウスの脳構造における各脳領域の位置とプルキンエ細胞への情報伝達経路
- 左: マウスの脳断面図において、プルキンエ細胞層(赤い点線)、下オリーブ核(青)、線条体(オレンジ)、海馬、大脳皮質、脳幹の領域を示した。左側が前方、右側が後方。
- 右: 下オリーブ核から登上線維を介したプルキンエ細胞への情報伝達経路
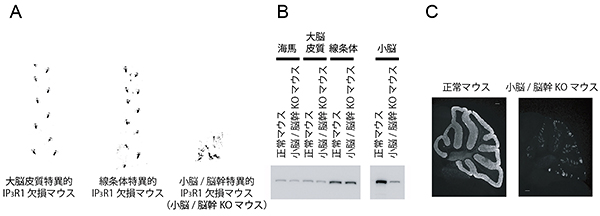
図2 IP3R1を欠損させたマウスの歩行機能の実験結果
- A.マウスの足跡。海馬/大脳皮質および線条体だけでIP3R1欠損させたマウスの歩行は正常だったが、小脳/脳幹だけでIP3R1を欠損させたマウス(小脳/脳幹KOマウス)はジストニアに似た症状を起こし正常な歩行が全くできなかった。
- B.正常マウスと小脳/脳幹KOマウスにおけるIP3R1の量を各脳部位で比較した結果。
- C.小脳のIP3R1に対して免疫染色を行った。正常マウスにはプルキンエ細胞にIP3R1が多く存在しているのに対し、小脳/脳幹KOマウスではほとんど見られなかった。
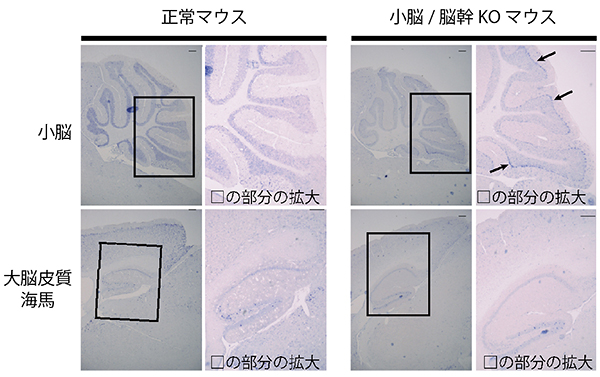
図3 マウスの脳内における神経活動の指標であるcfos mRNAの観察
小脳/脳幹だけでIP3R1を欠損させたマウス(小脳/脳幹KOマウス)のプルキンエ細胞(矢印の先)において正常マウスに見られないcfos mRNA量の増加が観察された。一方、大脳皮質や海馬のcfos mRNAに大きな違いは観察されなかった。
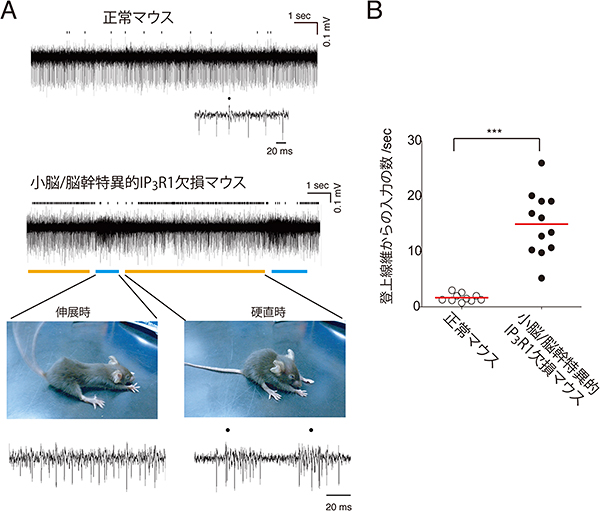
図4 ジストニア発症時のプルキンエ細胞の神経活動
- A.プルキンエ細胞の神経活動。小脳/脳幹だけでIP3R1を欠損させたマウス(小脳/脳幹KOマウス)のプルキンエ細胞の神経活動には、ジストニアによる硬直時(オレンジ)に、下オリーブ核から伸びる登上線維からの情報の入力と思われる特徴的な神経活動パターン(黒点で示す)が断続的に起こり、伸展時にそれが消失した。一方、正常マウスのプルキンエ細胞の神経活動には、行動に応じたそのような特徴的な活動パターンは見られなかった。
- B.正常マウスと小脳/脳幹KOマウスでの登上線維からのプルキンエ細胞への情報の入力の頻度の違い。小脳/脳幹KOマウスのほうが登上線維からプルキンエ細胞への入力頻度が高いことが分かる。
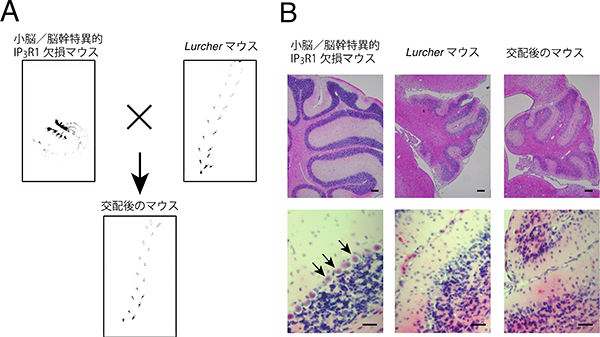
図5 プルキンエ細胞を欠失させた小脳/脳幹だけでIP3R1を欠損させたマウスにおける歩行実験と小脳
- A.マウスの足跡。小脳/脳幹だけでIP3R1を欠損させたマウス(小脳/脳幹KOマウス)を、プルキンエ細胞を持たないLurcherマウスと交配した。その結果、小脳/脳幹KOマウスはプルキンエ細胞を失い、ジストニアの病態が消失し、Lurcherマウスと同じレベルまで歩行ができるようになった。
- B.プルキンエ細胞を染色した。矢印の先が、プルキンエ細胞。Lurcherマウスおよび交配後のマウスは、プルキンエ細胞が消失していることが分かる。
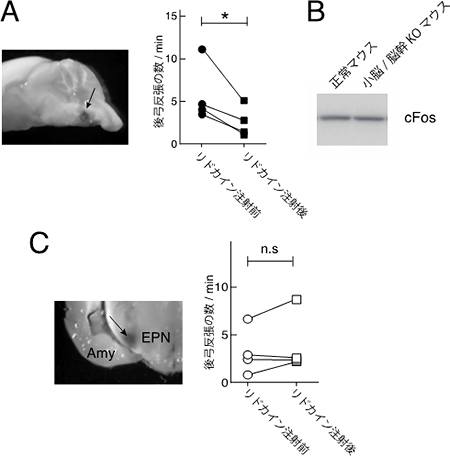
図6 小脳/脳幹だけでIP3R1を欠損させたマウスにリドカインを投与した結果
- A.神経活動を停止させるリドカインを下オリーブ核へ局所的に投与することにより、小脳/脳幹だけでIP3R1を欠損させたマウス(小脳/脳幹KOマウス)のジストニアの症状の改善が見られた。
- B.神経活動マーカーのcFosタンパク質の線条体での発現。正常マウスと小脳脳幹KOマウスで、cFosの線条体での発現に大きな違いがみられなかった。
- C.線条体へのリドカイン投与では、小脳/脳幹KOマウスのジストニアの症状改善が見られなかった(矢印はリドカイン注入箇所)。Amyは扁桃体、EPNは脳脚内核。
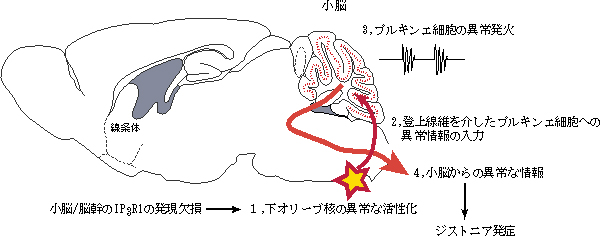
図7 小脳/脳幹だけでIP3R1を欠損させたマウスにおけるジストニア発症メカニズムのモデル
小脳/脳幹のIP3R1を欠損させると、下オリーブ核から伸びる登上線維からのプルキンエ細胞への情報の入力が異常になる。その結果、小脳から末梢神経へ異常な情報が送られ、硬直や姿勢異常を起こしジストニアを発症すると考えられる。
