ポイント
- Fut8が欠損するとバイセクティングGlcNAcを含む糖鎖が増加
- バイセクティングGlcNAcを付加する糖転移酵素GnT-Ⅲの活性が8倍に
- GnT-Ⅲの発現はWnt/β-カテニンシグナルを通じて調節される
要旨
理化学研究所(理研、野依良治理事長)は、糖鎖を作る糖転移酵素[1]「Fut8[2]」を欠損させた細胞では、別の糖転移酵素を発現し、活性化させることで糖鎖を補う仕組みが働くことを発見しました。これは、理研グローバル研究クラスタ(玉尾皓平クラスタ長)理研-マックスプランク連携研究センターシステム糖鎖生物学研究グループ(谷口直之グループディレクター)疾患糖鎖研究チームの栗本綾子研究員(当時)、北爪しのぶ副チームリーダー、大阪府立母子保健総合医療センター研究所の和田芳直所長らの共同研究グループによる成果です。
細胞表面に存在する糖鎖は、細胞内で糖転移酵素によって作られ、タンパク質の品質管理や機能調節など、生体内で重要な役割を果たしています。しかし、糖鎖の機能に関しては不明な点も多くあります。このため、糖転移酵素の遺伝子を欠損させ、目的の糖鎖の機能を解明する試みが多くの研究機関で行われてきました。
共同研究グループは、谷口直之グループディレクターらが以前酵素として分離精製し、さらにその遺伝子を同定した、糖転移酵素のFut8を欠損させると糖鎖構造にどのような変化が起こるのか調べました。Fut8欠損マウスの胎児線維芽細胞(MEF細胞)や血清中の免疫グロブリンG1(IgG1)の糖鎖構造を調べたところ、糖の一種であるバイセクティングGlcNAc[3]を含んだ糖鎖が増えていました。また、野生型に比べてバイセクティングGlcNAcを付加する糖転移酵素GnT-Ⅲ[4]の活性が8倍増加し、GnT-Ⅲの発現に関わるmRNA量も3倍増加していました。この原因を解明するため、Fut8欠損MEF細胞の遺伝子の変化を調べたところ、同細胞内でシグナル伝達タンパク質であるWnt[5]のターゲット遺伝子が増加していること、また、遺伝子の転写を活性化させるβ-カテニン[6]が蓄積していることが分かりました。以上の結果から、Fut8が欠損した細胞では、GnT-Ⅲの発現がWnt/β-カテニンを通して調節されるという一連のメカニズムが明らかになりました。
今回の研究で、生物が糖転移酵素を欠損した場合、他の糖転移酵素を発現し、活性化させることで生命を維持させるという新たな仕組みを持っていることを示唆しており、これまでに明らかになっていない糖転移酵素の新機能解明に役立つと期待できます。
本研究成果は、米国の科学雑誌『The Journal of Biological Chemistry』に掲載されるに先立ち、に近日掲載されます。
背景
私たちの体は約60兆個の細胞からできていますが、そのほとんど全ての細胞の表面に、糖鎖がひげのように生えています。糖鎖は、糖(単糖)が鎖状に連なったもので、その多くは細胞膜に埋め込まれたタンパク質や脂質に結合し、細胞同士の情報伝達やタンパク質の品質管理・機能調節など、生体内で重要な役割を果たしています。
タンパク質に糖鎖を付加する糖転移酵素には、180以上の遺伝子が存在することが知られています。糖鎖の機能を明らかにするため、特定の糖転移酵素を作る遺伝子を欠損させたマウスを用いて研究が行われてきました。
糖転移酵素の1つであるFut8は、N型糖鎖の根元にコアフコース[7]と呼ばれる糖を付加します(図1)。これまでに、谷口直之グループディレクターらはFut8を欠損させたマウス(Fut8欠損マウス)は、生後3日以内に大半が死亡してしまうこと、生存した場合でも成長遅延や肺気腫に加え、統合失調症に似た行動を示す、といった明らかに異常な症状が見られることを報告してきました。しかし、生体にとって重要な糖鎖に関わる遺伝子を欠損させても、マウスが必ずしも重い症状を示さずに生存する場合もたくさんあります。それは、遺伝子には、緊急時に対応する予備能力や補完機能があることを意味しています。しかし、具体的な証拠がないため、補完機能の有無については不明のままで、そのため、糖転移酵素の遺伝子についても、その補完機能についてはあまり議論されてきませんでした。
共同研究グループは、Fut8に着目し、Fut8欠損マウスを用いて、糖転移酵素の欠損が他の糖鎖構造に与える影響と、その仕組みの解明に挑みました。
研究手法と成果
まず、Fut8欠損マウスの胎児線維芽細胞(MEF細胞)の糖鎖構造を解析しました。その結果、バイセクティングGlcNAcという糖を含んだ糖鎖が増加していました。そこで、バイセクティングGlcNAcを付加する糖転移酵素のGnT-Ⅲ(図1)の活性を測定したところ、Fut8欠損MEF細胞では野生型に比べて、活性が約8倍上昇していました(図2A左)。また、GnT-Ⅲの発現に関わるmRNAの量を調べたところ、Fut8欠損MEF細胞では野生型に比べて、約3倍増加していました(図2A右)。さらに、この糖鎖構造の変化はMEF細胞だけでなく、Fut8欠損マウス由来の血清中の免疫グロブリンG1(IgG1)の糖鎖でもバイセクティングGlcNAcの増加が見られました。このことから、生体でも同様の糖転移酵素の活性変化が起こっていると考えられます(図2B)。
次に共同研究グループは、Fut8欠損マウスにおいてGnT-Ⅲの活性の上昇やmRNA量が増えた原因を探るため、Fut8欠損MEF細胞について詳しく調べました。その結果、シグナル伝達タンパク質「Wnt(ウィント)」のターゲット遺伝子が増加していること、また、「βカテニン」のリン酸化が減少し正常な分解が行わないために、β-カテニンが細胞内に蓄積したことが分かりました。Wntシグナルにより、β-カテニンは核の中に移動して遺伝子の転写を活性化する機能を持つタンパク質です。
以上の結果から、Fut8が欠損した細胞では、Wntのターゲット遺伝子が増加し、Wntシグナルが増強する。その結果、β-カテニンのリン酸化が阻害され、β-カテニンの蓄積量が増える。そして、その大量のβ-カテニンがGnT-Ⅲの発現を上昇させ、バイセクティングGlcNAcを含む糖鎖が増加するという一連のメカニズムを明らかにしました(図3)。
今後の期待
従来の研究では、重い症状が見られない糖転移酵素欠損マウスは重要視されていなかったため、見落とされてきた糖鎖の機能は少なくないと考えられます。今回の研究により、糖転移酵素を欠損させても、生物には環境に適応するために他の糖転移酵素を発現させるという新たな仕組みの存在が明らかになりました。
今後、糖鎖機能解明の研究を、症状の重さだけを注視することなく行うことで、これまでに見過ごされていた糖鎖機能が発見され、疾病の原因解明などに結びつくと期待できます。
原論文情報
- Ayako Kurimoto, Shinobu Kitazume, Yasuhiko Kizuka, Kazuki Nakajima, Ritsuko Oka, Reiko Fujinawa, Hiroaki Korekane, Yoshiki Yamaguchi, Yoshinao Wada, and Naoyuki Taniguchi. “The absence of core fucose upregulates GnT-Ⅲ and Want target genes: A possible mechanism for an adaptive response in terms of glycan function”.The Journal of Biological Chemistry, 2014.
発表者
理化学研究所
グローバル研究クラスタ 理研-マックスプランク連携研究センター システム糖鎖生物学研究グループ 疾患糖鎖研究チーム
チームリーダー 谷口 直之(たにぐち なおゆき)
研究員 栗本 綾子(くりもと あやこ)(当時)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.糖転移酵素
細胞の中のゴルジ体や小胞体と呼ばれる器官のなかに存在する酵素群。糖供与体である糖ヌクレオチドから糖をタンパク質に付加する。 - 2.Fut8
糖転移酵素の1つで、N結合型糖鎖の根元のN-アセチルグルコサミンの6位にフコースを1個付加させる。1996年に谷口直之グループディレクターらが発見した。 - 3.バイセクティングGlcNAc
図1参照。この糖鎖が存在すると、糖鎖が伸びるのを抑制する。また、高転移性のがんの転移を抑制することが知られている。 - 4.GnT-Ⅲ
バイセクティングGlcNAcと呼ばれる分岐型糖鎖を触媒する糖転移酵素。 - 5.Wnt、Wntシグナル
Wntとは分泌性の糖タンパク質。Wntシグナルにより、βカテニンが核の中に移動して遺伝子の転写を活性化する。 - 6.β-カテニン
Wntシグナルによって細胞内に蓄積し、核内で転写因子と結合して遺伝子発現を誘導するタンパク質。 - 7.コアフコース
糖の一種。コアフコースを持つ糖タンパク質(AFP)は肝がんの重要な腫瘍マーカーとして知られている。また、コアフコースを取り除いた抗体は、従来の抗体に比べて腫瘍を攻撃する能力が50~100倍増加することから、抗腫瘍抗体医薬品としてすでに臨床でも使用されている。
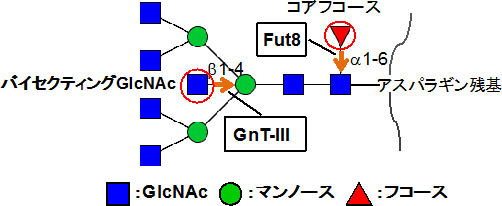
図1 N型糖鎖に働く糖転移酵素
糖転移酵素「Fut8」はN型糖鎖の根元にコアフコースと呼ばれる糖を付加する。糖転移酵素のGnT-Ⅲは、N型糖鎖のトリマンノシルコアと呼ばれる部分の中央のマンノースにb1-4結合でバイセクティングGlcNAcを付加する。
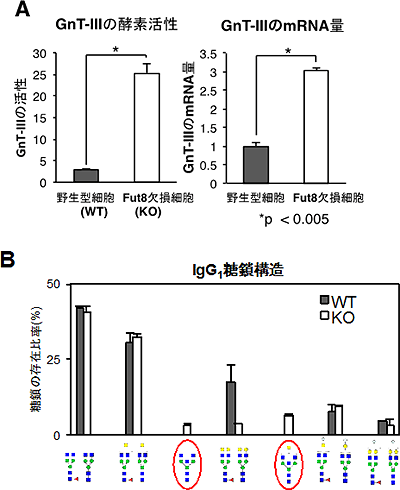
図2 GnT-Ⅲの活性上昇とFut8欠損マウス由来IgG1の糖鎖構造
- A: Fut8欠損マウスのMEF細胞を用いて、GnT-Ⅲの酵素活性を調べた(左)。その結果、約8倍活性が上昇していることが明らかとなった。また、GnT-ⅢのmRNAの量もFut8欠損MEF細胞において約3倍増加していることが分かった(右)。
- B: Fut8欠損マウスの血清中のIgG1の糖鎖を解析したところ、Fut8欠損マウスではバイセクティングGlcNAc糖鎖(赤で示した)が増加していることが明らかとなった。このことから、生体でも糖鎖の変化は起こっていることが分かる。
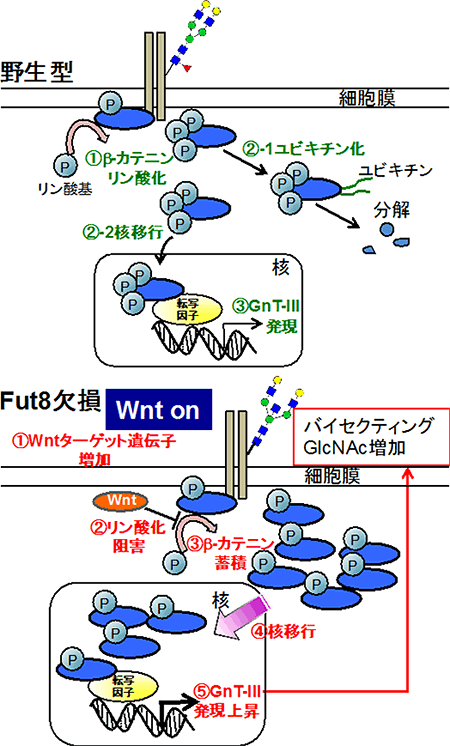
図3 Fut8欠損細胞でのGnT-Ⅲ発現上昇メカニズム
Fut8欠損細胞では①Wntのターゲット遺伝子が増加し、Wntシグナルが増強する。②その結果、β-カテニンのリン酸化が阻害され、③β-カテニンが蓄積する。④そして、核内に移動した大量のβ-カテニンが⑤GnT-Ⅲの発現を上昇させ、バイセクティングGlcNAcを含む糖鎖が増加するという一連のメカニズムが明らかになった。
