2014年4月14日
独立行政法人理化学研究所
独立行政法人科学技術振興機構
次世代型アルツハイマー病モデルマウスの開発に成功
-アルツハイマー病研究に資する新規リソース基盤に-
ポイント
- 既存アルツハイマー病モデルマウスに比べヒト患者により近い病理を再現
- 既存のモデルマウスで得られたこれまでの結果の一部は見直しの必要がある
- アルツハイマー病の基礎・応用研究のための新たな世界標準のツールに
要旨
理化学研究所(理研、野依良治理事長)は、既存のアルツハイマー病モデルマウスよりも、アルツハイマー病患者脳内のアミロイドの蓄積を忠実に表わす、次世代型アルツハイマー病モデルマウスの開発に成功しました。これは、理研脳科学総合研究センター(利根川進センター長)神経蛋白制御研究チームの西道隆臣シニアチームリーダー、斉藤貴志副チームリーダーらによる成果です。
疾患研究には、病態を忠実に再現するモデル動物が不可欠です。モデル動物の作製では、通常、病気の原因となる遺伝子を同定し、その遺伝子を過剰に発現させるか、欠損させます。アルツハイマー病では、アミロイドβペプチド(Aβ)[1]が凝集し、アミロイド斑となって脳内に過剰に蓄積することが病気の発症の引き金と考えられており、これまでにAβの前駆体であるアミロイド前駆体タンパク質(APP)[2]の遺伝子変異が同定されています。そのため、APPを非生理的に過剰に発現させたAPP過剰発現マウスが、第一世代アルツハイマー病モデルマウスとして主に使用されてきました。しかし、過剰発現したAPPの記憶障害などの非生理的な効果が強く、また脳内のアミロイドの蓄積もアルツハイマー病患者との類似性が乏しいため、ヒトのアルツハイマー病のモデルとして適切だとは言い切れませんでした。
研究グループは、この問題を解決するため、遺伝子の過剰発現法を用いずに、患者でみられる遺伝子変異と正常な遺伝子を“置き換える”方法(ノックイン技法[3])により「APPノックインマウス」の開発に成功し、解析を行ってきました。APPノックインマウスは、患者の脳におけるアミロイドの蓄積に忠実なだけでなく、既存モデルでしばしば発生する研究途中での突然死が起きないため、アルツハイマー病モデルとして極めて有用なモデルです。今回、開発に成功したモデルマウスは、既存のモデルに替わる世界標準となる可能性が高く、未解明のアルツハイマー病の病態メカニズムの解明から、予防・治療のための創薬や診断法の開発など、臨床応用のための研究に資する重要な研究ツールやリソース基盤になると期待できます。
本研究成果は、科学技術振興機構(JST)戦略的創造研究推進事業および文部科学省分子イメージング研究戦略推進プログラムの一環として行われ、米国の科学雑誌『Nature Neuroscience』5月号に掲載されるに先立ち、オンライン版(4月13日付け:日本時間4月14日)に掲載されます。
背景
アルツハイマー病は、脳内にアミロイドβペプチド(Aβ)が凝集し、アミロイド斑となって過剰に蓄積することが、発症の引き金と考えられており、アミロイド斑の形成(アミロイドの蓄積)に伴う慢性炎症病態の誘導、シナプス機能の低下などを示し、最終的には神経変性・神経細胞死に至るとされています。Aβは、アミロイド前駆体タンパク質(APP)から酵素による切断を受け生理的に産生されます。家族性(遺伝性)アルツハイマー病の場合、これまでに多くのAPPの遺伝子変異が同定されており、その遺伝子変異の効果によりAβの産生が加速していることが明らかとなっています。
1995年、アルツハイマー病のモデルマウスとして、APP遺伝子を外部から追加挿入する「過剰発現法」を用いてAPPを過剰に発現させたAPPトランスジェニックマウス(APP過剰発現マウス)が作製されました。以来、APP過剰発現マウスが、研究ツールとして一般的に利用されてきました。しかし、APP過剰発現マウスは、APPを過剰に発現させたことによる記憶障害などの非生理的な効果が強く(図1)、アミロイド斑の形成状態もヒトのアルツハイマー病患者との類似性が乏しいため(図2)、ヒトのアルツハイマー病のモデルマウスとして適切であるとは言い切れません。また、飼育・繁殖中にしばしば原因不明の突然死を起こし、アミロイド斑形成も個体差が大きいため、モデルマウスとして問題がありました。そのため、より患者に近似したモデル動物の開発は、重要な課題となっていました。
研究手法と成果
研究チームは、APPの過剰発現法ではなく、遺伝子を置き換える「ノックイン技法」を用いてモデルマウスの開発を試みました。具体的には、家族性アルツハイマー病の遺伝子変異[4](Aβ産生量を増加させるSwedish変異とAβの一種であるAβx-42の産生比率を増加させるIberian変異、およびマウスAβが凝集性を示さないため、Aβの配列をヒト化させAβを凝集させるなど)を多重に、同時に組み込んだターゲッティングベクター[5]を作製し、ノックインによる遺伝子の置き換えを行うことで、「第二世代APPマウス」の創出に成功しました(図3)。APP過剰発現マウスは、12カ月齢からアミロイド斑の形成が認められますが、APPを過剰発現させていない第二世代APPマウスでは、APPの発現量は野生型と同等であるにも関わらず、アミロイド斑の形成は6カ月齢から確認されました。さらに、第二世代APPマウス脳内では、加齢を重ねるほどアミロイド斑が形成され、蓄積するAβ種も患者と同様でした(図4A)。また、アミロイド斑の形成に伴い、神経炎症(図4B)やシナプスの脱落も認められ、18カ月齢から記憶学習能の低下が認められました(図4C)。
次に、第二世代APPマウスの応用性を確認するため、他の遺伝子改変マウスとの交配実験を行いました。一例として、タンパク質分解酵素・カルパイン(細胞内システインプロテアーゼ)の内因性阻害物質[6]・カルパスタチンを欠損させたマウス(Cast-KO)との交配を行いました。以前、研究チームは患者のアミロイド斑の形成部位周辺でカルパインが活性化していることを見いだし、カルパインがアルツハイマー病の病理に何らかの影響を及している可能性を示しました。その際に、APP過剰発現マウスとCast-KOマウスの交配を行いましたが、その交配仔は10週齢までに半数以上が死亡するという原因不明の短命化を引き起こしました。しかし、第二世代APPマウスとCast-KOマウスの交配仔(カルパスタチン欠損第二世代APPマウス)は、短命化を引き起こしませんでした(図5)。このことは、本来はAPPに変異があるマウスとCast-KOマウスを交配しても、その交配仔は短命化を起こさないはずが、APP過剰発現マウスはCast-KOと交配することで交配仔の個体死を誘導するという、非常に人工的なモデルであったことが改めて明らかとなりました。
続いて、カルパスタチン欠損第二世代APPマウスの経時解析を行いました。その結果、同月齢の第二世代APPマウスに比べてアミロイド斑の形成時期が早いこと、神経炎症が加速し記憶学習能の低下時期が早まり病態が悪化することが明らかとなりました。このように、第二世代APPマウスと他の遺伝子改変マウスの交配仔の解析を行うことで、アミロイド斑の増悪因子や改善因子を見いだすことが可能となります。
さらに研究グループは、第二世代APPマウスに、家族性アルツハイマー病変異の1つでありAβが蓄積しやすくなるArctic変異を組み込んだ第三世代APPマウスの創出にも成功しました。その結果、この第三世代APPマウスは、2カ月齢からアミロイド斑の形成を示し、18カ月齢の第二世代APPマウスよりも激しい神経炎症を示しました(図6)。記憶学習能の低下も6カ月齢から認められ、第三世代APPマウスは、研究時間を短縮させることができます。これにより、アミロイド斑の形成初期を標的とした実験には第二世代APPマウスを、アミロイド斑形成後の脳内病態変化を標的とした実験には第三世代APPマウスを、などという形で実験目的によって、第二世代、第三世代APPマウスを使い分けることも可能になります。
今後の期待
これまでのアルツハイマー病の研究では、APP過剰発現マウスのように非常に人工的なモデルマウスを使用して、病態の解析が進められてきた背景があるため、基礎研究から創薬などの応用研究において、正しい研究や薬物候補の評価がなされてきたのか不確定な面があります。今回開発した第二世代や第三世代APPマウスを用いて研究を進めていくことで、今後、従来のAPP過剰発現マウスにより得られた結果を一部見直す必要性が生じる可能性があるかもしれません。それ以上に、いまだに解明されていないアルツハイマー病の慢性の炎症性病態の分子メカニズムの解明に向けた基礎研究を推し進めることが可能になり、アルツハイマー病の予防・治療のための創薬研究のみならず、早期診断法開発などの臨床応用のための研究に資する、新たな世界基準となる重要な研究ツールとして大きく寄与すると期待できます。
原論文情報
- Takashi Saito, Yukio Matsuba, Naomi Mihira, Jiro Takano, Per Nilsson, Shigeyoshi Itohara, Nobuhisa Iwata and Takaomi C. Saido. "Single APP knockin mouse models of Alzheimer’s disease". Nature Neuroscience, 2014, doi:10.1038/nn.3697
発表者
理化学研究所
脳科学総合研究センター 神経蛋白制御研究チーム
チームリーダー 西道 隆臣 (さいどう たかおみ)
副チームリーダー 斉藤 貴志 (さいとう たかし)
お問い合わせ先
脳科学研究推進室
Tel: 048-467-9757 / Fax: 048-462-4914
報道担当
独立行政法人理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
独立行政法人科学技術振興機構 独立行政法人広報課
Tel: 03-5214-8404 / Fax: 03-5214-8432
補足説明
- 1.アミロイドβペプチド(Aβ)
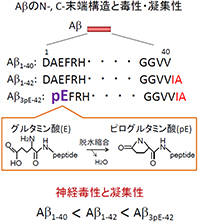 アミロイドβ前駆体タンパク質からプロテアーゼにより切断されて産生される生理的ペプチド。アルツハイマー病で見られるアミロイド斑の構成成分として発見されたことから、この過剰な蓄積がアルツハイマー病発症の引き金と考えられている。Aβはアミノ酸の長さで種類が分類されており、Aβ1-40、Aβ1-42が同定されており、Aβ1-42が最も神経毒性が高いとして解析が行われてきた。最近、アミノ酸の長さが異なるAβ亜種の存在が報告されている。
アミロイドβ前駆体タンパク質からプロテアーゼにより切断されて産生される生理的ペプチド。アルツハイマー病で見られるアミロイド斑の構成成分として発見されたことから、この過剰な蓄積がアルツハイマー病発症の引き金と考えられている。Aβはアミノ酸の長さで種類が分類されており、Aβ1-40、Aβ1-42が同定されており、Aβ1-42が最も神経毒性が高いとして解析が行われてきた。最近、アミノ酸の長さが異なるAβ亜種の存在が報告されている。 - 2.アミロイド前駆体タンパク質(APP)
APPはAmyloid precursor proteinの略。Aβの前駆体タンパク質で、家族性アルツハイマー病の場合、多くの遺伝子変異が同定されており、その変異によりAβの産生が増加することが知られている。逆に、遺伝子変異によりAβの産生が抑えられ、アルツハイマー病を発症しにくいケースも報告されている。このことからも、アルツハイマー病の発症には、Aβの蓄積が引き金になっていることが推察される。 - 3.ノックイン技法
遺伝子組み換え法の1つで、標的遺伝子の目的とする塩基のみを置換する方法。トランスジェニックのように過剰発現を行わず、また、ノックアウトのように遺伝子を欠損させることもない、最も人為的でない方法。 - 4.アルツハイマー病の遺伝子変異
家族性アルツハイマー病の遺伝子変異は、これまで多くの変異が見いだされているが、そのほとんどがAPPかAPPからAβを産生する際に作用する酵素のどちらかに変異が同定されている。これら変異のほとんどは、脳内でAβ42の産生・比率を増加させる効果を示す。第二世代APPマウスには、Aβの産生量を増加させる効果を持つ Swedish変異、および既知のアルツハイマー病変異の中で最もAβ42の産生比率を増加させる Iberian変異を導入している。また、第三世代APPマウスには、上記2つの変異に加え、Aβの凝集性が高まり、Aβ分解酵素に対する分解耐性も獲得する Arctic変異も同時に導入している。 - 5.ターゲッティングベクター
ゲノム中の特定の標的遺伝子配列に変異を導入させたり、欠損させたりするために相同組み換えを行うためのベクター。目的とする遺伝子変異(今回は、 Swedish変異、 Iberian変異)を有する遺伝子配列を組み込んだベクターをES細胞(胚性幹細胞)へ導入することで、相同組み換えを行った。 - 6.内因性阻害物質
化学合成または微生物等から精製した阻害物質ではなく、もともと生体内にある阻害物質。
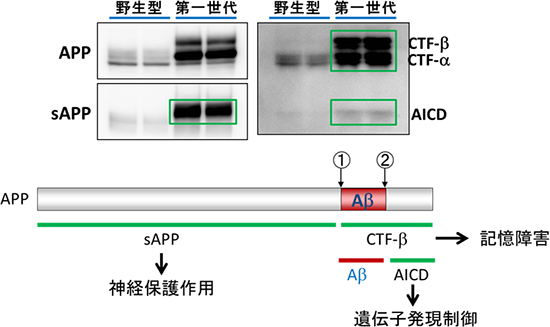
図1 第一世代:APP 過剰発現マウスの問題点
APP過剰発現マウスは、野生型マウスに対して約10倍のAPPを非生理的に発現している。Aβは、酵素の作用により、APPの①β切断部位次いで②γ切断部位の順に切断を受け産生されるが、Aβ以外の断片(緑線部: sAPPやCTF-b、AICD)も非生理的に産生される。これら断片には、さまざまな生理機能が報告されているため、APPを過剰発現させることは、Aβ以外の機能断片も過剰に産生させることになる。そのため、APP過剰発現マウスの表現型は、純粋にAβの毒性によるものだけでなく、さまざまな複合効果の現れであり、アルツハイマー病のモデルマウスとして適切だとは言い切れない。
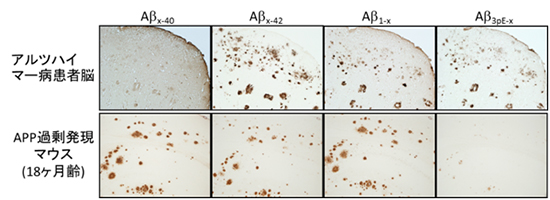
図2 アルツハイマー病患者とAPP過剰発現マウスのアミロイド斑の比較
APP過剰発現マウスの脳内に蓄積しているAβの主種(Aβx-40)と患者の脳に蓄積しているAβの種(Aβx-42)は異なるため、ヒトのアルツハイマー病のモデルとして適切だとは言い切れないことが分かる。
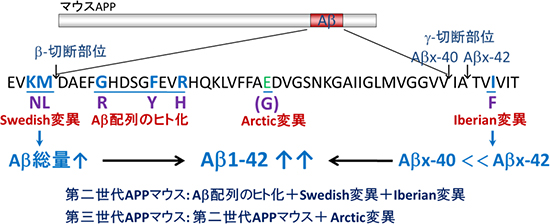
図3 次世代型アルツハイマー病モデルマウス作製のためのコンセプト
Aβは、酵素の作用により、APPのβ切断部位次いでγ切断部位の順に切断を受け産生される。第二世代APPマウスは、Aβ産生量を増加させるSwedish変異及びAβx-42の産生比率を増加させるIberian変異を導入し、更に、マウスのAβ配列は凝集を示さないため、Aβ配列のヒト化を同時に行ったマウスである。第三世代APPマウスは、上記変異に加えて家族性アルツハイマー病の遺伝子変異の1つArctic変異も導入したマウスである。
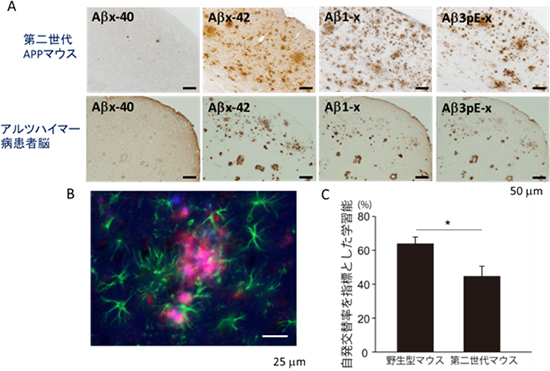
図4 第二世代APPマウスの脳のアミロイド斑、神経炎症および学習能
- A. 第二世代APPマウスのアミロイド斑は、患者と非常に類似していた。
- B. 第二世代APPマウスは、神経炎症(青:Aβ、赤:ミクログリア、緑:アストロサイト)を示した。
- C. 第二世代APPマウスは、18カ月齢から学習能が低下していた。
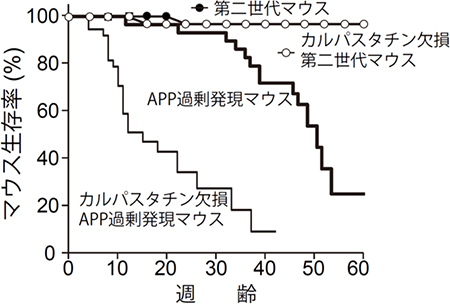
図5 カルパスタチン欠損によるアルツハイマーモデルマウスの寿命の変化
APP過剰発現マウスは、30週齢を過ぎた頃から原因不明の突然死を起こす。また、カルパスタチンを欠損することで、急激な短命化を引き起こすが、その原因は不明である。一方、第二世代マウスは、カルパスタチン欠損の有無にかかわらず、短命化は起こらない。すなわちAPP過剰発現マウスは非常に人工的なマウスであると言える。
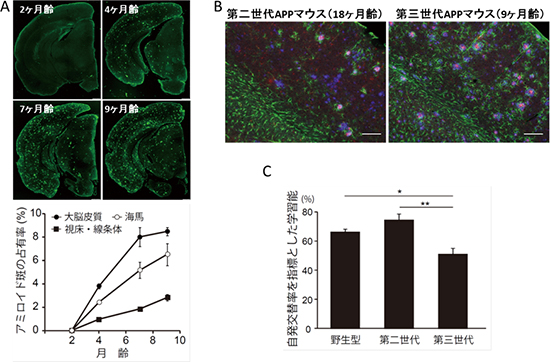
図6 第三世代APPマウス脳のアミロイド斑、神経炎症および学習能
- A. 第三世代APPマウスは、2カ月齢からアミロイド斑の蓄積を示した。
- B. 第三世代APPマウスは、第二世代APPマウスよりも激しい神経炎症(青:Aβ、赤:ミクログリア、緑:アストロサイト)を示した。
- C. 第三世代APPマウスは、6カ月齢から学習能が低下していた。
