2014年11月11日
理化学研究所
腸内細菌科細菌が腸内・体外の環境変化に順応するメカニズムを解明
-細菌感染症対策の鍵となる新しい分子メカニズム-
ポイント
- 腸内細菌科細菌が、腸内外の環境に順応するための「酸化還元スイッチ」を発見
- 酸化還元スイッチによる細胞内タンパク質分解の最適化メカニズムを解明
- 解明したメカニズムを標的とした新規薬剤開発に期待
要旨
理化学研究所(理研、野依良治理事長)は、腸内細菌科細菌[1]が腸内・体外の環境変化に順応することを可能にする、新規の分子メカニズムを解明しました。細菌感染症対策の鍵となる重要な知見となります。これは、理研横山構造生物学研究室の横山茂之上席研究員、西井亘研究員と、理研ライフサイエンス技術基盤研究センタータンパク質機能・構造研究チームの白水美香子チームリーダー、新野睦子上級研究員、東京薬科大学生命科学部の小島正樹教授、姫路日ノ本短期大学の木原裕学長らの研究グループの成果です。
大腸菌、サルモネラ菌などの腸内細菌科細菌は、細菌感染症の約半数に関与し、下痢、嘔吐、食中毒、敗血症、尿道炎、髄膜炎、赤痢、肺炎、チフス、ペストなど、さまざまな疾病を引き起こします。このことは、腸内細菌科細菌が、腸内の嫌気環境と体外の好気環境のいずれの環境でも増殖できる「通性嫌気性」を持つことに由来すると考えられます。2つの環境では、細胞内で生じる異常タンパク質[2]の量が大きく異なります。異常タンパク質は有害であり、細胞内のタンパク質分解酵素(プロテアーゼ)によって、速やかに除去されなければいけません。しかし、プロテアーゼは、過剰に働くと、細胞内で機能する正常なタンパク質も分解してしまいます。従って、通常は嫌気・好気いずれかの環境に細胞内プロテアーゼの活性は最適化されています。一方、腸内細菌科細菌は、両環境間の変化に応じてプロテアーゼ活性を切り替えることで、いずれの環境においても、強い増殖力を発揮すると考えられています。しかし、そのメカニズムは明らかになっていませんでした。
研究グループは、このような生育環境の変化に応じて、腸内細菌科細菌が細胞内プロテアーゼ活性を調節する「酸化還元スイッチ[3]」を発見しました。このスイッチは、Lonプロテアーゼ[4]の分子中に存在し、分解産物のペプチドを放出する出口孔のサイズを、可逆的なジスルフィド結合[5]の形成を通して調節します。その結果、腸内細菌科細菌の細胞内タンパク質分解の活性は、腸内(嫌気環境)では低く、大気中(好気環境)では高く設定され、いずれの環境でも、細胞が強い増殖力を発揮することが可能となります。この類例のない新規のメカニズムは、細菌感染症対策の鍵となり得る新規薬剤の標的として期待できます。
本研究成果は、文部科学省ターゲットタンパク研究プログラム、文部科学省創薬等支援技術基盤プラットフォーム事業の一環として行われたもので、英国の科学雑誌『Nature Chemical Biology』オンライン版(11月10日付け:日本時間11月11日)に掲載されます。
背景
細菌感染症の約半数は、大腸菌、サルモネラ菌、セラチア菌、赤痢菌、クレブシエラ菌、ペスト菌などの腸内細菌科細菌(Enterobacteriaceae科細菌)が引き起こします。このことは、腸内細菌科細菌が、宿主の腸内の嫌気環境と体外の好気環境のいずれの環境でも、強い増殖力を発揮できる「通性嫌気性」を持つことに由来すると考えられます。2つの環境は生物にとって大きな違いがあり、多くの生物はどちらか一方でしか生育できません(図1)。例えば、腸内フローラ[6]の99%を占める偏性嫌気性細菌[7]は体外では生育できず、必然的に感染性がほとんどありません。それに対し、腸内細菌科細菌は、腸内だけでなく、土壌、湖沼、下水など人間が生活する環境のいたるところで生育するため、宿主間を容易に移動することが可能です。その結果、腸内細菌科細菌は、体力の弱った宿主に日和見感染、院内感染、旅行者下痢などを引き起こす「条件性病原菌」として、さらには、赤痢、食中毒、敗血症、尿道炎、肺炎、髄膜炎、チフス、ペストなどといった深刻な疾病を引き起こす「偏性病原菌」として、人々に頻繁に感染します。従って、腸内細菌科細菌が、宿主の腸内と体外の環境変化に、どのように細胞機能を適応させているのか、そのメカニズムを解明することは極めて重要です。
細胞内で機能する最も重要な生体分子はタンパク質です。しかし、細胞内では、酸化ダメージや誤った生合成によって、異常タンパク質が日常的に発生します。細胞内の異常タンパク質の生成量は、腸内の嫌気環境と体外の好気環境で大きく異なります。すなわち、腸内の嫌気環境では酸素による酸化ダメージがほとんどなく、またタンパク質の生合成が活発でないため、異常タンパク質は少量しか生じません。一方、体外では、大気中、あるいは溶存する酸素による酸化ダメージと、酸素呼吸に伴う活発なタンパク質の生合成とによって、異常タンパク質が大量に生じます。このような異常タンパク質が蓄積することは、細胞にとって極めて有害であり、細胞内のタンパク質分解酵素(プロテアーゼ)により、速やかに分解除去される必要があります。しかし、プロテアーゼの活性が過剰に発現すると、細胞内の正常なタンパク質まで分解してしまい、細胞に深刻な打撃を与えます。従って、通常の生物の細胞では、嫌気・好気いずれかの環境に、プロテアーゼの活性は最適化されています。
一方、腸内細菌科細菌は、両環境間でプロテアーゼ活性を切り替えることで、いずれの環境においても、強い増殖力を発揮できると考えられています。しかし、これまで、そのメカニズムは明らかになっていませんでした。
研究手法と成果
細菌の細胞内で異常タンパク質を分解する主なプロテアーゼは、Lonプロテアーゼ(以下Lon)です。LonはAAA+プロテアーゼ[8]の1つであり、基質となる異常タンパク質を、入口孔から分子内の分解チャンバーに引き込み、分解により生じるペプチドを出口孔から分子外に放出します(図2)。
研究グループは、腸内細菌科細菌のLonが、分子内の2つのシステイン残基[9]の間でジスルフィド結合を形成することに着目しました。これは、他の生物種由来のLonにはみられない、腸内細菌科細菌Lonのユニークな特徴です。研究グループはまず、X線結晶構造解析によって、Lonには、このジスルフィド結合を持たない「還元型」と、持つ「酸化型」の2種類の形態があり、酸化還元環境の変化に応じて、両者間を可逆的に転換することを発見しました(図3)。さらに両者は、分解産物のペプチドを分子外に放出する出口孔の構造が異なること、すなわち出口孔のサイズが、還元環境では狭く、酸化環境では広くなることを発見しました(図4)。このサイズ変化は、上記ジスルフィド結合の形成・解離が引き起こす、出口孔付近のペプチド鎖の極めて精妙な構造変化によるものです(図5)。出口孔のサイズは、放出される分解産物ペプチドのサイズに対応しています。したがって、この出口孔のサイズ変化は、分解産物ペプチドの通過速度に影響し、その結果、タンパク質分解活性も変化することが予想されました。
次に、異常タンパク質分解に対する腸内細菌科細菌のLonの活性を試験管内で調べました(図6)。その結果、Lonの活性は、還元環境では減少し、酸化環境では増大することを発見しました。さらに生化学的、タンパク質工学的解析から、この活性変化が、上述の出口孔サイズの変化によることを証明しました。これらの結果により、腸内細菌科細菌のLonの2つのシステイン残基は、可逆的なジスルフィド結合の形成を通してLonの活性を調節する「酸化還元スイッチ」であることが分かりました。また、この酸化還元スイッチが、大腸内の還元的環境にある細胞と、体外(大気中)の酸化的環境にある細胞のちょうど中間の酸化還元電位において、Lonの活性を切り替えることを明らかにしました。
さらに、酸化還元スイッチが腸内細菌科細菌の細胞内で実際に機能し、細胞内異常タンパク質の分解に対するLonの活性を嫌気環境においては低く、好気環境においては高く設定することを確かめました(図7)。また、このメカニズムによってLonの活性が最適化されることで、腸内細菌科細菌の細胞が、嫌気・好気いずれの環境においても、強い増殖力を発揮できることを、実験的に証明しました。
以上の結果から、腸内細菌科細菌が、宿主の腸内・体外のいずれの環境においても強い増殖力を持つことができるのは、細胞内異常タンパク質分解を最適化する酸化還元スイッチの存在によることが分かりました。(図8)。この酸化還元スイッチは、Lonの分子中に存在し、分解産物のペプチドを放出する出口孔のサイズを、可逆的なジスルフィド結合の形成を通して調節します。これは、これまでに類例のない、全く新規の分子メカニズムです。
今後の期待
腸内細菌科細菌は、高い感染性をもち、私たちの暮らしに大きな影響を与えます。本研究は、このことの基本となる、驚くほどエレガントな分子メカニズムを明らかにしました。この発見は、感染症を分子レベルで理解する上で、パラダイムシフトというべき、新たな概念をもたらします。そして、このメカニズムを標的とすることで、細菌感染症対策の鍵となる、新規薬剤の開発につながることが期待できます。
原論文情報
- Wataru Nishii, Mutsuko Kukimoto-Niino, Takaho Terada, Mikako Shirouzu, Tomonari Muramatsu, Masaki Kojima, Hiroshi Kihara, & Shigeyuki Yokoyama.
"A Redox switch shapes the Lon protease exit pore to facultatively regulate proteolysis" Nature Chemical Biology, In Press. 2014, doi: 10.1038/nchembio.1688
発表者
理化学研究所
上席研究員研究室 横山構造生物学研究室
上席研究員 横山 茂之(よこやま しげゆき)
研究員 西井 亘(にしい わたる)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.腸内細菌科細菌
細菌分類上の一グループ。ヒトや動物の腸内の嫌気環境(無酸素環境)、および土壌、湖沼、下水などの好気環境(有酸素環境)のいずれにおいても生育することができる、通性嫌気性を持つ。細菌感染症の約半数に関与している。 - 2.異常タンパク質
本来持つべき正常な構造、機能を失ったタンパク質。タンパク質生合成中のミス、あるいは、環境中の酸化や熱などが与えるダメージによって細胞内に生じる。異常タンパク質が適切に除去されずに蓄積することは、細胞にとって極めて有害である。 - 3.酸化還元スイッチ
酸化還元環境の変化を感知し、それに応じてタンパク質分子の構造、機能を制御する分子メカニズム。 - 4.Lonプロテアーゼ
細菌細胞内の異常タンパク質を分解する主要な「AAA+プロテアーゼ」。LonはAAA+プロテアーゼの中で唯一、全ての生物界(細菌、古細菌、真核生物)に普遍的に存在する。 - 5.ジスルフィド結合
2つのチオール(–SH)基間にできる共有結合。タンパク質中ではチオール基を有するアミノ酸であるシステイン(Cys)残基間で形成される。反応式は以下の通りである(式1)。
R–SH+R’–SH⇄R–S–S–R’+2H++2e–(式1)
タンパク質のジスルフィド結合には、高次構造形成に重要な「構造的ジスルフィド結合」と、タンパク質の機能発現に関わる「機能的ジスルフィド結合」がある。機能的ジスルフィド結合はさらに、酵素の触媒残基として機能する「触媒的ジスルフィド結合」と、触媒分子機構には直接関わらずに機能を調節する「アロステリックジスルフィド結合」に別れる。Lonの酸化還元スイッチは、通常の生理条件で機能することが証明された初めてのアロステリックジスルフィド結合である。
- 6.腸内フローラ
ヒトや動物の腸内で、多種多様な細菌がびっしりと生息する様子を花畑に例えて呼ぶ名称。腸内は、酸素がほとんどない嫌気環境であり、腸内フローラの99%は偏性嫌気性細菌が占める。通性嫌気性細菌である腸内細菌科細菌は、腸内フローラの1%未満に過ぎない。 - 7.偏性嫌気性細菌
好気環境(有酸素環境)では生育できず、嫌気環境(無酸素環境)においてのみ生育が可能な細菌。 - 8.AAA+プロテアーゼ
ATPの加水分解によって得られるエネルギーを利用して、多彩な細胞機能を担う、 ATPase associated with diverse cellular activities(AAA+)タンパク質の一種で、プロテアーゼ活性を併せ持つもの。自然界に6分子種存在する(26Sプロテアソーム、ClpAP、ClpXP、HslVU、FtsH、Lon)。細胞内の異常タンパク質や、ある種の制御タンパク質を分解することを通して、細胞内タンパク質の品質管理と細胞機能の調節にそれぞれ貢献する。 - 9.システイン残基
タンパク質を構成する20種類の基本アミノ酸残基の1つ。側鎖にチオール基を持つ。生理的な酸化還元環境における反応性が高く、2つのシステイン間でジスルフィド結合を形成する。
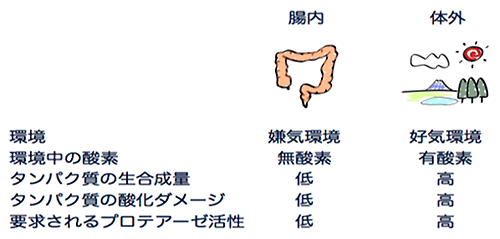
図1 嫌気環境と好気環境
生物にとって腸内の「嫌気環境」と体外の「好気環境」では、大きな違いがあり、多くの生物はどちらか一方でしか生育できない。腸内細菌科細菌は、いずれの環境でも強い増殖力を発揮できる「通性嫌気性」を持つ。
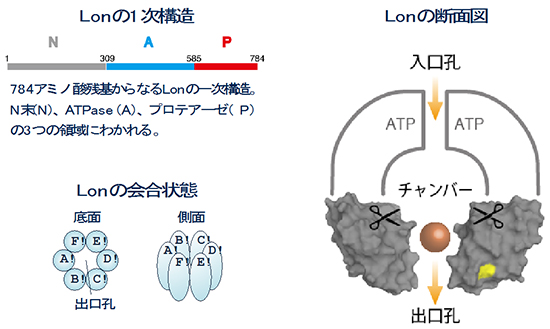
図2 Lonの構造
Lonは、N、A、Pの3つの部位からなる一次構造を持つ分子(サブユニット)が、6分子、バレル状に会合することにより、分子内チャンバーを形成する。基質タンパク質は、Lonの入口孔からチャンバー内に、ATPを加水分解することによって得られるエネルギーを用いて、取り込まれる。続いてチャンバー内のプロテアーゼ活性部位(✂)において、アミノ酸が10残基程度繋がったペプチド(オレンジ色の球で示した)に分解される。最後に、分解産物ペプチドが、出口孔より分子外へ放出される。図中の立体構造は、Lonの基質分解部位と出口孔を含む、プロテアーゼ領域の結晶構造(サブユニットAおよびDのみ表示)。黄色い部分は酸化還元スイッチ(サブユニットD。サブユニットAの酸化還元スイッチは、紙面向こう側のため見えない。6量体であるので、実際には6ヶ所に存在)。
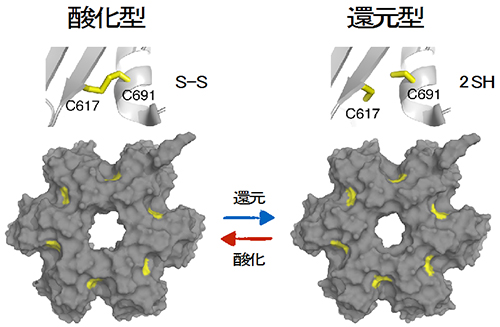
図3 酸化型および還元型Lonのプロテアーゼ(P)部位の構造
X線結晶構造解析で決定した、酸化型および還元型Lonプロテアーゼ部位。6カ所のシステイン残基対が、酸化型、還元型で、それぞれ形成、解離している。両型の全体構造はほぼ同じであり、出口孔のサイズのみ異なる。
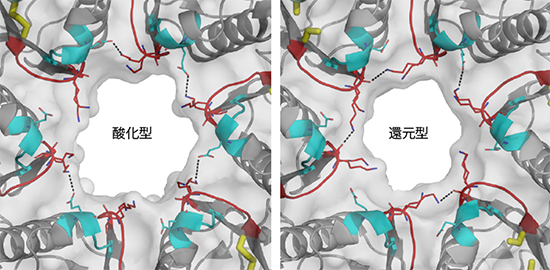
図4 Lon出口孔のサイズ変化
結晶構造解析により明らかになった、酸化型、還元型の出口孔サイズの違い。出口孔の断面積は、酸化型が230Å2、還元型が160Å2。なお、通過する分解産物ペプチドの推定投影面積は、150Å2である。
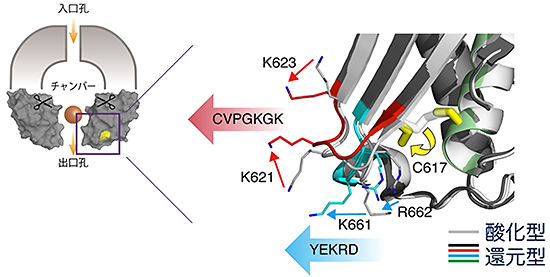
図5 酸化還元スイッチによる出口孔サイズ変化の分子メカニズム
酸化型から還元型への転換に伴う、出口孔周辺の構造変化。ジスルフィド結合の解離に伴い、出口孔を形成する、「CVPGKGK」部位と「YEKRD」部位の主鎖が移動する。同時に、システイン617番(C617)の側差が回転し、アルギニン662番(R662)、リジン661番(K661)、リジン621番(K621)、リジン623番(K623)の各側鎖の構造変化を引き起こす。これら主鎖と側鎖の変化が協調的に起こることにより、出口孔が狭くなる。還元型から酸化型への転換は以上の逆。
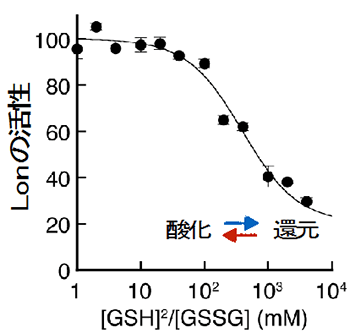
図6 酸化還元環境の変化に伴うLonの活性変化
試験管内で、酸化還元試薬存在下におけるLonの活性の測定した結果。Lonの活性が、グラフ左(酸化的)にいくほど増大、右(還元的)になるほど減少することが分かる。
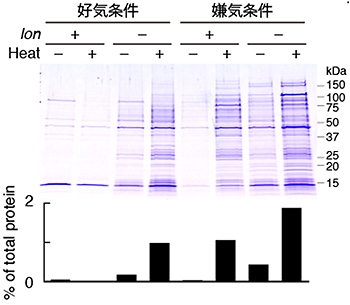
図7 嫌気、好気両条件における細胞内Lonの活性の違い
好気条件および嫌気条件における、野生型株(lon+)およびlon遺伝子欠損株(lon–)の大腸菌を熱処理し(42ºC、Heat+)、細胞内に異常タンパク質(熱変成タンパク質)を生じさせ、その後、回収・検出した。好気条件においては、異常タンパク質が、lon+株でほとんど蓄積せず、lon–株では蓄積している。一方、嫌気条件においては、両株とも蓄積している。この結果は、Lonの細胞内異常タンパク質分解活性は、好気条件で高く、嫌気条件で低くなることを示している。
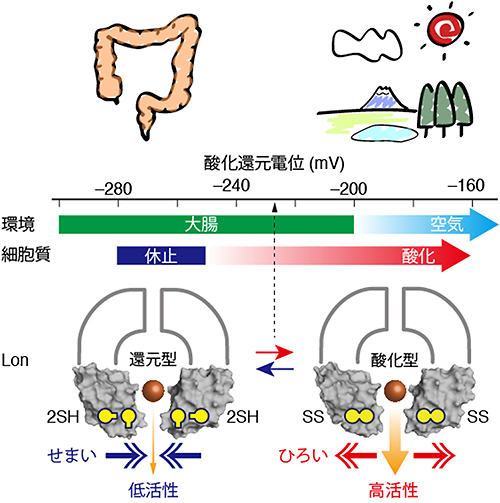
図8 酸化還元スイッチによる腸内細菌科細菌の細胞内タンパク質分解
酸化還元スイッチは、Lonの分子中に存在する。分解産物のペプチドを放出する出口孔のサイズが、ジスルフィド結合を持たない還元型Lon(左)では狭く、ジスルフィド結合を持つ酸化型Lon(右)では広くなる。これにより、異常タンパク質分解に対するLonの活性が、還元環境では低下し、酸化環境では増大する。その結果、腸内細菌科細菌は、宿主の腸内、体外のいずれの環境においても強健に生育することが可能になり、強い感染性を発揮する。
