2015年1月30日
独立行政法人理化学研究所
鹿児島大学
悪性リンパ腫の増殖を阻止できる可能性を見いだす
-悪性リンパ腫増殖に必須なCARMA1活性化の仕組みを発見-
要旨
理化学研究所(理研)統合生命医科学研究センター免疫シグナル研究グループの斉藤隆グループディレクターと鹿児島大学大学院医歯学総合研究科免疫学分野の原博満教授らの共同研究グループ※は、悪性リンパ腫の増殖をコントロールする分子「CARMA1」が働くための重要な仕組みを発見し、この仕組みを阻害することでリンパ腫の増殖を阻止できる可能性を見いだしました。
びまん(瀰漫)性大細胞型B細胞リンパ腫(DLBCL)[1]は、抗体を産生するB細胞ががん化したリンパ腫です。このうち活性化B細胞様のDLBCLである「ABC DLBCL」は、薬の効きにくい悪性リンパ腫として知られています。これまでの研究で、ABC DLBCLの発症は、その多くが、B細胞が抗原を感知する受容体(リンパ球抗原受容体[2])から異常な信号を受け、B細胞の増殖を促すNF-κB[3]という分子が過剰に活性化してしまうことが原因と分かっています。B細胞内のCARMA1は、B細胞抗原受容体(BCR)を介してNF-κBを活性化する信号伝達に必須の分子です。CARMA1遺伝子の変異によってCARMA1分子が細胞内で異常な凝集を引き起こし、これによりNF-κB活性化が起こってABC DLBCLを発症してしまう例が多いことが報告されていました。しかし、なぜCARMA1が凝集しNF-κB活性化が起こるのか、その仕組みは解明されていませんでした。
共同研究グループは、CARMA1分子を詳しく調べた結果、CARMA1分子内に存在するSH3ドメインとGUKドメインという領域が相互作用することで、CARMA1の分子内および分子間の結合を誘導することを見いだしました。この結合は、抗原刺激に応答したリンパ球の活性化と増殖に必須であることも分かりました。また、2つのドメイン同士が結合する能力を失わせると、抗原刺激による活性化が起こらず、CARMA1の遺伝子変異によって引き起こされる異常なCARMA1の凝集やNF-κBの活性化をほぼ完全に阻害できることが明らかになりした。
今回、CARMA1の働きを制御する仕組みが解明されたことで、CARMA1のSH3とGUKドメインの相互作用の阻害を標的とした、新しいリンパ腫の治療薬開発が進展すると期待できます。成果は、英国のオンライン科学雑誌『Nature Communications』(1月20日付け、日本時間1月21日)に掲載されました。
※共同研究グループ
理化学研究所 統合生命医科学研究センター 免疫シグナル研究グループ
グループディレクター 斉藤 隆(さいとう たかし)
鹿児島大学大学院 医歯学総合研究科 免疫学分野
教授 原 博満(はら ひろみつ)
佐賀大学 医学部分子生命科学講座 免疫学分野
教授 吉田 裕樹(よしだ ひろき)
背景
私たちの身体には、過去に遭遇したウイルスや細菌などの異物(抗原)に対して、抵抗性を獲得する仕組みが備わっています。この仕組みを獲得免疫と呼び、獲得免疫は白血球の1つであるリンパ球が異物を認識して活性化することによって生じます。リンパ球は、抗体を分泌するB細胞と、その働きを助けたり、ウイルス感染細胞を殺傷したりするT細胞に分けられますが、どちらの細胞も抗原受容体(B細胞はBCR、T細胞はTCR)と呼ばれるセンサーを介して異物を認識します。リンパ球が異物を認識すると、免疫応答を拡大するために活発な増殖を開始します。通常は、異物の排除が終了するとリンパ球の増殖も止まりますが、遺伝子の変異で増殖の仕組みに異常が生じると、増殖が止まらず、リンパ腫を発症する原因になることが知られています。
びまん(瀰漫)性大細胞型B細胞リンパ腫(DLBCL)は、B細胞ががん化したリンパ腫の1つです。DLBCLは遺伝子型によってABC型とGCB型に分類され、ABC型のDLBCL(ABC DLBCL)は、薬の効きにくい悪性リンパ腫であることが知られています。過去の研究により、ABC DLBCLでは、B細胞抗原受容体(BCR)から細胞内への信号伝達経路に異常があり、がん細胞の生存や増殖を促すNF-κBという分子が過剰に活性化していることが報告されていました。2003年に研究グループの原らは、B細胞やT細胞のCARMA1という分子が、BCRやTCRの刺激に応答したNF-κBの活性化に必須であることを報告しました。その後、米国の研究者が「多くのABC DLBCLではCARMA1遺伝子に変異が存在し、これによって作られる変異CARMA1分子が細胞内で異常な凝集を生じると、NF-κBの過剰な活性化を引き起こす原因になる」と報告しました。
従って、CARMA1の凝集をうまく抑制することができれば、ABC DLBCLの増殖を阻止する効果的な治療ができると考えられます。共同研究グループは、CARMA1の凝集とNF-κB活性化を制御している仕組みの解明に取り組みました。
研究手法と成果
CARMA1はいくつかの“ドメイン(領域)”と呼ばれる部分が集まって構成されるタンパク分子です。共同研究グループは、CARMA1分子を詳しく調べた結果、その中のSH3ドメインとGUKドメインと呼ばれる部分が分子内で結合することを見いだしました。また、この2つのドメイン同士の結合は、同じ分子内だけでなく、別のCARMA1分子との間でも生じることを明らかにしました(図1)。
共同研究グループは、この結合が、リンパ球が活性化する過程において一過性に細胞膜上に観察される小さなCARMA1の凝集体の形成に関与するのではないかと予想しました。そこで、この結合が生じないように改変したCARMA1分子(L815P CARMA1)を発現するマウスを作製して、そのリンパ球の機能を調べました。その結果、このマウス由来のリンパ球は、抗原受容体の刺激によって活性化した際のCARMA1凝集体の形成がほぼ完全に消失し(図2)、NF-κBの活性化に伴うリンパ球の増殖もほとんど起こらないことを見いだしました(図3)。
ABC DLBCLで報告されている異常な細胞内凝集体を形成するCARMA1分子(L251P CARMA1)は確かに凝集を引き起こしますが、これにL815P変異を加えてみたところ、細胞内での凝集および蓄積がなくなり、過剰なNF-κBの活性化も抑制されることを発見しました(図4)。
これらの結果から、リンパ球抗原受容体を介した生理的、あるいはがん化を導く病的なCARMA1の凝集とNF-κBの活性化の両方に、SH3ドメインとGUKドメインのCARMA1分子内および分子間での結合が重要であることが明らかになり、この結合を阻害すればNF-κBの活性化を抑制できることが分かりました。
今後の期待
ABC DLBCLは、既存の化学療法の効果が低い悪性リンパ腫であり、より効果的な治療薬の開発が望まれていました。今回の研究で、ABC DLBCLの増殖と生存に決定的な役割を演じているNF-κBの活性化が、SH3ドメインとGUKドメインの結合を介したCARMA1凝集体の形成によって制御されていることが明らかになりました。従って、この結合を効率よく阻害する薬剤を開発できれば、ABC DLBCLの効果的な治療薬になると期待できます。
原論文情報
- Hiromitsu Hara, Tadashi Yokosuka, Hideki Hirakawa, Chitose Ishihara, Shinsuke Yasukawa, Masanori Yamazaki, Haruhiko Koseki, Hiroki Yoshida and Takashi Saito, "Clustering of CARMA1 through SH3–GUK domain interactions is required for its activation of NF-κB signalling", Nature Communications, doi: 10.1038/ncomms6555
発表者
理化学研究所
統合生命医科学研究センター 免疫シグナル研究チーム
グループディレクター 齊藤 隆(さいとう たかし)
鹿児島大学大学院医歯学総合研究科
免疫学分野
教授 原 博満(はら ひろみつ)
報道担当
独立行政法人理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
国立大学法人鹿児島大学広報センター
Tel: 099-285-7035 / Fax: 099-285-3854
sbunsho [at] kuas.kagoshima-u.ac.jp(※[at]は@に置き換えてください。)
補足説明
- 1.びまん(瀰漫)性大細胞型B細胞リンパ腫(DLBCL)
DLBCLは、diffuse large B-cell lymphomaの略。日本の成人リンパ腫のほとんどを占める非ホジキンリンパ腫の中で、最も発症頻度が高い。また、日本の悪性リンパ腫の多くがDLBCLである。DLBCLは、遺伝子発現の型によって、胚中心B細胞様(GCB)DLBCLと活性化B細胞様(ABC)DLBCLに分類され、ABC DLBCLはより悪性度が高いことが知られている。ABC DLBCLの大きな特徴の1つがNF-κBの活性化で、これはB細胞抗原受容体(BCR)からの信号伝達経路の活性化制御の不全によって生じると報告されている。また、CARMA1のコイルドコイルドメインという領域をコードする遺伝子の点変異がABC DLBCLの多くに見られる。 - 2.リンパ球抗原受容体
私たちの体に備わっている免疫系は、体内に一度侵入した異物(抗原)を記憶し、同じ抗原が再度侵入した際に、より速く大きな免疫応答を引き起こしてこれを排除することができる。このように、ある抗原に対して免疫力を獲得することを獲得免疫と呼び、これがワクチンの原理となる。獲得免疫をつかさどる細胞は白血球の1つであるリンパ球であり、リンパ球の多くはT細胞とB細胞と呼ばれる細胞に分類される。T細胞とB細胞はそれぞれT細胞抗原受容体(TCR)とB細胞抗原受容体(BCR)と呼ばれるセンサー分子を細胞表面に発現し、侵入してきた抗原を感知する。TCRやBCRが抗原を感知すると、細胞内にその信号が伝達されて核に伝わり、さまざまな遺伝子の発現が誘導される。これをリンパ球の活性化と呼ぶ。活性化したリンパ球は活発な細胞増殖を開始して抗原に対抗する集団を拡大するとともに、抗体産生B細胞(プラズマ細胞)、ヘルパーT細胞、細胞傷害性T細胞などの攻撃能力を持ったエフェクター細胞に変化して抗原の排除に働く。 - 3.NF-κB
核に存在する遺伝子が発現して、機能を発揮するタンパク質が作られるまでの最初の段階として、DNAに書かれた遺伝子情報がmRNAという別の核酸に写し取られる。このステップを「転写」と呼び、転写は遺伝子のオンとオフを制御する主要な機構である。遺伝子の転写を制御しているタンパク質を総称して転写因子と呼ぶ。NF-κBは転写因子として働くタンパク質の複合体であり、白血球の分化や活性化に働く遺伝子の発現に関与する。リンパ球が抗原受容体を介した刺激を受けると、その信号が細胞内に伝わり、細胞質に存在していたNF-κBが核に移動して標的となる遺伝子の転写を誘導する。これをNF-κBの活性化と呼ぶ。NF-κBは、活性化したリンパ球の増殖や生存、サイトカイン産生、エフェクター細胞への分化誘導など重要な役割を演じる。
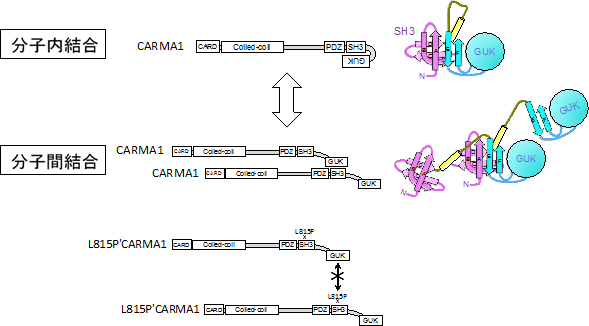
図1 CARMA1のSH3ドメインとGUKドメインの分子内および分子間結合様式
CARMA1のSH3ドメインとGUKドメインは分子内および分子間で結合することが可能。CARMA1のSH3ドメイン内にある815番目のロイシン残基(L815)をプロリン(P)に変換する点変異(L815P)を導入すると、この結合が阻害される。
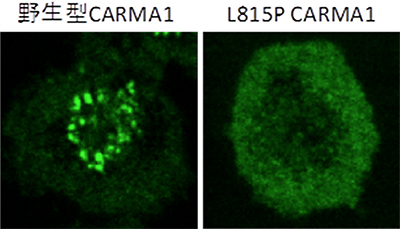
図2 野生型および815P CARMA1の凝集体形成の観察結果
野生型のCARMA1を発現するリンパ球(T細胞)は、抗原受容体刺激を加えると、細胞膜上にCARMA1の小さな凝集体が一過的に形成される。一方、SH3ドメインとGUKドメインの結合が阻害される変異を加えたCARMA1(L815P CARMA1)を発現するリンパ球は、明瞭なCARMA1凝集体が形成されない。
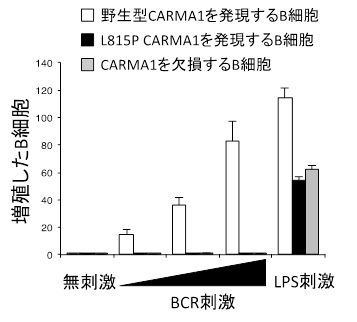
図3 BCR刺激後のB細胞の増殖
野生型のCARMA1を発現するB細胞は、BCRを介して刺激すると活発な増殖が誘導される。一方、SH3ドメインとGUKドメインの結合ができないL815P CARMA1を発現するB細胞は、CARMA1を完全に欠損するB細胞と同様に、生物活性を促すリポ多糖(LPS)刺激には反応するものの、BCR刺激による増殖応答が全く起こらない。
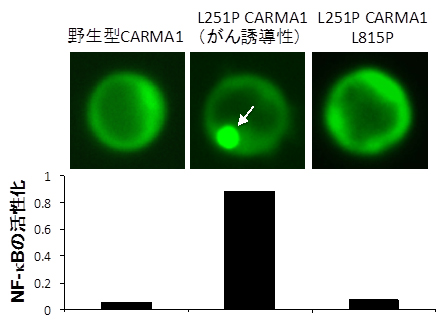
図4 L251P CARMA1にL815P変異を加えた実験結果
ABC DLBCLで発見された、がん誘導性のCARMA1変異(L251P CARMA1)は、CARMA1の細胞内での異常な凝集体(矢印)蓄積を生じ、これに伴ってNF-κBの定常的な過剰活性化を生じさせる(図中央)。このL251P CARMA1に、さらにL815P変異を加えてSH3ドメインとGUKドメインの結合を阻止すると、凝集体の形成が解消されると同時にNF-Bの活性化も阻害することができた(図右)。
