要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センターゲノム情報解析チームのピエロ・カルニンチ チームリーダー(副センター長)、エリック・アーナー副チームリーダーと、理研予防医療・診断技術開発プログラムの林崎良英プログラムディレクターらが参画する国際研究コンソーシアム「FANTOM[1]」は、幹細胞の分化など細胞の性質が変わる過程で転写されるゲノム領域を網羅的に解析し、遺伝子から離れた位置で遺伝子の転写効率に関わる制御部位である「エンハンサー[2]」の活性化が、一連の遺伝子発現の変化に先行して起きる現象であることを明らかにしました。
未分化な細胞が分化したり、分化した細胞が外界の刺激に応答する際には、発現する遺伝子のセットが大きく変化することが知られています。特定の遺伝子の発現は、遺伝子の近くにあって遺伝子を発現させる機能を持つ「プロモーター[3]」や、離れた場所にあるエンハンサーと呼ばれるゲノム上の複数の遺伝子制御部位によって調節されています。しかし、これらが細胞分化の過程でどのように協調して、分化に必要な遺伝子の発現を制御しているかは詳しく分かっていませんでした。FANTOMは2014年に、ゲノム上の遺伝子制御部位の活性を細胞の種類ごとに測定し、遺伝子制御部位の多くが細胞ごとに決まった組み合わせで働いていることを突き止めました。今回、細胞の状態が変化していく過程での遺伝子制御部位の活性変化を網羅的、経時的に捉え、遺伝子発現が動的に変化する仕組みの解明に取り組みました。
研究チームは、ES細胞(胚性幹細胞)やiPS細胞(人工多能性幹細胞)の分化や、培養細胞が外界の刺激に応答する過程など33例(ヒト細胞で19例、マウス細胞で14例)を対象に、数時間から数十日にわたってプロモーターとエンハンサーの活性を測定しました。解析には、遺伝子制御部位の活性を高感度に計測できる理研独自の技術「CAGE法[4]」を用いました。その結果、エンハンサーの活性化が最も初期に起きるイベントであり、続いて転写因子の発現に関わるプロモーターが活性化し、その後転写因子以外の発現に関わるプロモーターの活性が徐々に優勢になることが明らかになりました。
これは、エンハンサーとプロモーターの活性化は同時に起きるとされていた従来のモデルを覆す発見であり、iPS細胞の分化、がん細胞の成長因子への応答など、生命現象の根源的な理解に向けた手がかりとなる成果です。さらには、細胞の形質を自由に制御する技術への応用が期待できます。
本研究成果は、米国の科学雑誌『Science』オンライン版(2月12日付け:日本時間2月13日)に掲載されます。また、関連する基礎情報は、論文発表と同時に理研のWEBサイト「FANTOM5 gateway」および「ZENBU」と、国立遺伝学研究所の日本DNAデータバンク(DNA Data Bank of Japan: DDBJ)のデータベース上で公開されます。
背景
理研が主宰する国際コンソーシアム「FANTOM」は、ゲノムDNAから転写されるRNAの機能をカタログ化することを目的に2002年に発足しました。2015年まで5期にわたって活動を続けており、2003年の第3期(FANTOM3)では、DNA全体の70%以上がRNAに書き写され、そのほとんどがタンパク質を作らずRNAのままで機能していることを示し、RNAという重要な研究分野が発展するきっかけになりました。2009年の第4期(FANTOM4)では、ヒトがん細胞を用いた研究から分化を支配する転写因子ネットワークが存在することを明らかにしています注1)。
FANTOMは現在、RNAを含む遺伝子ネットワークの網羅的な解析により、細胞が分化する仕組みや、多様な細胞の表現型が維持される仕組みの解明に取り組んでいます。2014年の第5期の第1段階(FANTOM5 Phase1)では、180種以上のヒト細胞で、遺伝子を発現させる機能を持つ「プロモーター」や遺伝子の転写効率に関わる「エンハンサー」などの遺伝子制御部位の活性を測定しました。その結果、細胞の種類ごとに決まった組み合わせの遺伝子制御部位が機能していることを見いだしました注2)。これは、プロモーターやエンハンサーの活性のパターンが「細胞の形質の定義」となることを意味します。
一方、細胞が分化する過程での遺伝子制御部位の活性変化は、これまで一部の細胞種の解析しかなく、この結果が細胞種特異的なものか、それとも細胞の分化という基本的な生命現象に一般化できるのかは分かっていませんでした。そこでFANTOM5の第2段階の活動として、細胞が分化したり、分化した細胞が外界の刺激に応答する際に遺伝子制御部位の活性がどのように変化するかを、さまざまな細胞で解析するプロジェクト(FANTOM5 Phase2)を実施しました(図1)。
- 注1) 2009年4月20日プレス発表「細胞の分化などの状態を支配する分子ネットワークを解明」
- 注2) 2014年3月27日プレス発表「ゲノム上の遺伝子制御部位の活性を測定し正常細胞の状態を定義」
研究手法と成果
研究チームは、細胞分化や細胞応答を幅広く解析するため、ヒトの細胞で19例、マウスの細胞で14例の時間経過に伴う細胞の変化を観察しました。これらには、ES細胞(胚性幹細胞)やiPS細胞(人工多能性幹細胞)の分化、がん細胞の成長因子への応答や、免疫細胞のインフルエンザへの応答などが含まれます。数時間から数十日間にわたり細胞の表現型の変化とともに、プロモーターとエンハンサーの活性変化を追跡しました。FANTOMや国際プロジェクト「ENCODE [5]」のこれまでの成果から、プロモーターやエンハンサーからの転写は、それらが活性化している指標となることが分かっています。本研究では「CAGE法」を用い、特定のプロモーターやエンハンサーからの転写量を測定しました。CAGE法は、ゲノム上の転写開始点を網羅的に同定し、サンプル中の各RNAの数をカウントする理研の独自技術で、遺伝子制御部位の活性を高感度に計測できます。
解析の結果、全プロモーターの半数以上の活性が、時間の経過とともに変化していました(ヒトのプロモーター約20万個のうち51%、マウスのプロモーター約16万個のうち61%の活性変化が確認できました)。
今回の解析で活性を確認できたエンハンサーは、FANTOM5 Phase1で同定したエンハンサーの約7割(ヒトエンハンサー約6万5千個のうち65%、マウスエンハンサー約4万4千個のうち77%)に及びました。このうちヒトで約5千個、マウスで約7千個のエンハンサーの活性が時間の経過とともに変化していました。変化を示すエンハンサーの種類は、それぞれの細胞にほぼ特異的でした。
次に、活性の時間変化をより詳しく調べるため、時間経過ごとの詳細な追跡が可能な9例(ヒト5例、マウス4例)を選び、最初の6時間の変化を解析しました。その結果、個々のエンハンサーやプロモーターの活性変化は6つのパターンに分類できることが分かりました。細胞変化の初期にピークを示すパターンにはエンハンサーが多く含まれており、早い例では細胞が刺激を受けてから15分で活性がピークに達するものもありました。その後、転写因子を発現させるプロモーターが活性化し、それに続いて、転写因子以外の発現に関わるプロモーターが徐々に活性化しました(図2)。また今回得られた転写解析に基づくプロモーターとエンハンサーの活性変化は、転写因子の結合配列から予測される結果とも合致しました。
今後の期待
一部の遺伝子とエンハンサーの組み合わせを解析した先行研究から、エンハンサーの活性化が遺伝子の発現よりも先に起きる例があることは、これまでにも知られていました。しかし、多様な細胞のさまざまな変化を網羅的に解析した研究はなく、「同じ遺伝子の発現制御に関わるエンハンサーとプロモーターは、その機能が持続している間は同時に転写され続けている」というモデルが提唱されていました。これに対し今回の結果は、「細胞分化や細胞応答の過程では、エンハンサーの活性化が最初に起こるイベントであり、その後にプロモーターからのmRNAの転写に切り替わっていく」というモデルが普遍的であることを示しています。ゲノム上の遺伝子制御部位により、遺伝子の発現がどのように協調的に制御されているのかは、現代の生物学における根本的な課題の1つです。本研究は、この問いに一般的な解を求める手がかりとなると期待できます。将来的には、例えば、iPS細胞から目的の細胞への分化誘導を行う際、さらには、iPS細胞を経ずして分化誘導を行う際に、エンハンサーを操作することで分化誘導を達成できるようになる可能性もあります。
なお、関連する基礎情報は、論文発表と同時に理研のWEBサイト「FANTOM5 gateway注3」および「ZENBU注4」と、国立遺伝学研究所の日本DNAデータバンク(DNA Data Bank of Japan: DDBJ)のデータベース上で公開されます。
- 注3)
Genome Biology 2015, 16:22
Gateways to the FANTOM5 promoter level mammalian expression atlas(英語) - 注4) 2014年3月10日プレス発表「新しいバイオインフォマティクス・ツール「ZENBU」を開発」
原論文情報
- RIKEN & FANTOM consortium, "Transcribed enhancers lead waves of coordinated transcription in transitioning mammalian cells.", Science, doi: 10.1126/science.1259418
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 機能性ゲノム解析部門 LSA要素技術研究グループ ゲノム情報解析チーム
チームリーダー Piero Carninci(ピエロ・カルニンチ)(副センター長)
副チームリーダー Erik Arner(エリック・アーナー)
予防医療・診断技術開発プログラム
プログラムディレクター 林崎 良英(はやしざき よしひで)
お問い合わせ先
理化学研究所 ライフサイエンス技術基盤研究センター
チーフ・サイエンスコミュニケーター 山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.FANTOM
20カ国、114の研究機関が参加する国際研究コンソーシアム。理研のマウスゲノム百科事典プロジェクトで収集された完全長cDNAの機能注釈(アノテーション)を行うことを目的に、理研予防医療・診断技術開発プログラムの林崎良英プログラムディレクターが中心となり2000年に結成された。役割は、トランスクリプトーム(転写産物)解析の分野を軸に発展・拡大してきた。また、プロジェクトの研究対象は、ゲノムの転写産物という「要素」の理解から、転写制御ネットワークという「システム」つまり「生命体のシステム」の理解へと発展し、知見を基礎・応用の両面で有用なリソースとして公開している。同時に、医療への応用の基礎となること目指している。
FANTOM(英語) - 2.エンハンサー
主に遺伝子の上流や下流に位置し、遺伝子の転写効率を変化させるDNAの特定の配列のうち、転写効率を著しく高める部分をエンハンサー領域(配列)という。 - 3.プロモーター
ゲノムDNA上でRNAに書き写される領域の近くにあり、遺伝子を発現させる機能を持つ部分をプロモーター領域(配列)という。 - 4.CAGE法
CAGEはCap Analysis of Gene Expressionの略。理研が独自に開発した遺伝子解析技術で、転写開始点と呼ばれるRNAが書き写される領域の先頭(5’端)だけを次世代シーケンサーで解析する方法。読み取った配列をゲノム上にマッピングして数えることで、転写開始点を同定するとともに、各転写開始点から書き出されているRNAの数を定量することができる。理研ライフサイエンス技術基盤研究センター機能性ゲノム解析部門、ゲノムネットワーク解析支援施設(GeNAS)では、受託解析を通じCAGE技術を他の研究機関に広く提供している。 - 5.ENCODE
The Encyclopedia of DNA Elements。米国・国立ヒトゲノム研究所(NHGRI)が2003年に立ち上げたヒトゲノム解析プロジェクト。ヒトゲノムのすべての機能要素の解析を目指している。世界5か国(スペイン、米国、英国、日本、シンガポール)から32の研究機関が参加している。日本からは唯一理研が参加している。
The ENCODE Project(英語)
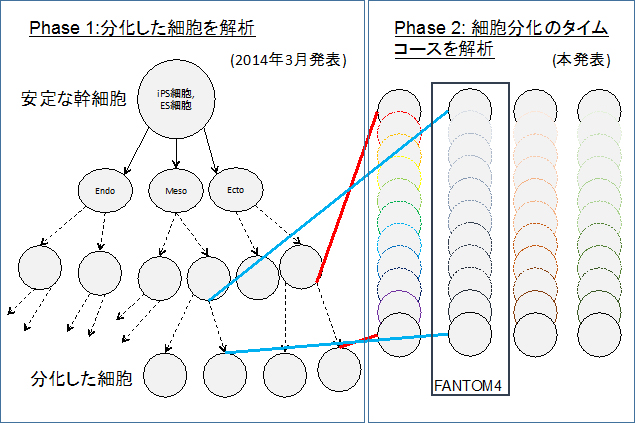
図1 FANTOM5 プロジェクトの全体構想
体を構成するすべての細胞はたった1つの受精卵から分化した細胞であり、ES細胞やiPS細胞を用いた研究で分化過程の再現が可能になりつつある。2014年3月発表の第1段階(FANTOM5 Phase1)では、分化したヒト細胞の性質を制御する遺伝子制御部位の活性を網羅的に解析した。本研究(FANTOM5 Phase 2)では、細胞分化の過程で遺伝子制御部位の活性がどう変化するかをさまざまな細胞で調べた。
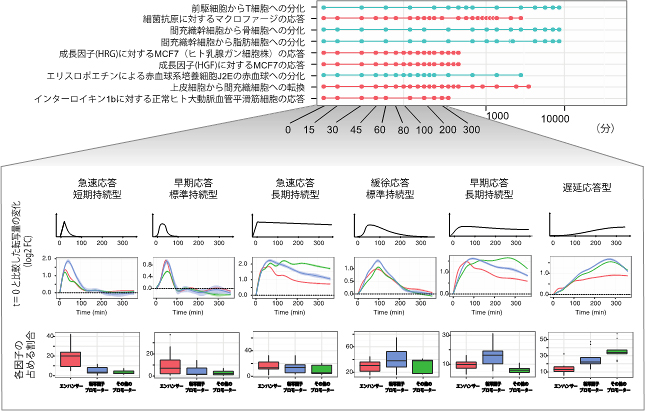
図2 細胞が変化する過程で共通する遺伝子制御部位の活性化パターン
細胞の変化に伴うエンハンサーとプロモーターの活性を測定したところ、細胞種や細胞の反応によらず、6つのパターンに分類されることが分かった。赤はヒト由来の細胞、青はマウス由来の細胞を示す。(上)それぞれのパターンに含まれるエンハンサー、転写因子のプロモーター、転写因子以外のプロモーターの割合を調べたところ、細胞変化の過程の初期にピークを迎えるパターンにはエンハンサーが多く含まれ、その後、転写因子のプロモーター、転写因子以外のプロモーターの順に活性が上昇した。(下)
