ポイント
要旨
理化学研究所(理研)脳科学総合研究センター細胞機能探索技術開発チームの宮脇敦史チームリーダーと筒井秀和客員研究員(現 北陸先端科学技術大学院大学)らの共同研究チーム※は、生きた細胞の中で巨大な結晶を瞬時に形成する蛍光タンパク質「Xpa(Crystalizable and photo-activatable:クリスパ)」を発見しました。また、Xpaタンパク質の結晶が、細胞のオートファジー(自食)[1]に関わる細胞内小器官のリソソーム[2]の膜に囲まれ、隔離される過程を明らかにしました。
一般的に、タンパク質の結晶(プロテインクリスタル)は、そのタンパク質を高濃度に含む溶液を静かに置くことによってつくられます。一方、生きた細胞の中、特に細胞質[3]の中では、さまざまなタンパク質が動き回って存在しており、そうした環境ではタンパク質の結晶形成は起きにくいと考えられています。
共同研究チームは、キクメイシサンゴ由来の蛍光タンパク質「KikGR」を遺伝子改変する過程で、生きた細胞の中で巨大な結晶を成長する改変体[4]を偶然発見し、Xpaと名付けました。XPaタンパク質を発現する培養細胞をタイムラプスイメージングという手法で観察したところ、細胞質中に広がったXpaタンパク質が一瞬にして集積し、数ミクロン程度のひし形結晶に変身する様子が確認されました。Xpaタンパク質の結晶を免疫組織学実験および透過型電子顕微鏡[5]観察したところ、リソソームの膜で覆われていることが分かりました。さらにその結晶はユビキチン、p62、LC3[6]を介する選択的オートファジー[1]によってリソソームへ取り込まれることが明らかになりました。また、細胞1個を材料に、X線回折構造解析[7]を行い、Xpaタンパク質の立体構造を2.9オングストローム(1Åは10-10m=0.1ナノメートル)の分解能で決定することに成功しました。
今回の研究により、細胞の中で、タンパク質が結晶化する様子、および結晶がオートファジー機構によって隔離される様子を明らかにすることができました。また、蛍光タンパク質の活用により、タンパク質の集積に関して動的な理解を深められることが証明されました。集積を結晶から凝集に広げて考えれば、アルツハイマー病におけるアミロイド斑[8]形成やプリオン病におけるプリオン凝集[9]などの現象の解明にもつながる可能性があります。
本研究は、米国科学雑誌『Molecular Cell』(4月2日号)に掲載されるのに先立ち、電子版(3月12日付け:日本時間3月13日)に掲載されます。
※共同研究チーム
理化学研究所 脳科学総合研究センター 細胞機能探索技術開発チーム
チームリーダー 宮脇 敦史 (みやわき あつし)
客員研究員 筒井 秀和(つつい ひでかず)
(現:北陸先端科学技術大学院大学 マテリアルサイエンス学部 准教授)
研究員 片山博幸 (かたやま ひろゆき)
テクニカルスタッフ 庄田恵子 (しょうだ けいこ)
大阪大学 医学系研究科 生命機能研究科 統合生理学教室
技術補佐員 神野 有香(じんの ゆか)
研究助手 富田 亜希子(とみた あきこ)
大阪大学 蛋白質研究所
教授 中川 敦史(なかがわ あつし)
助教 山下 栄樹(やました えいき)
研究員 松田 真 (まつだ まこと)
背景
一般にタンパク質の結晶を作製する場合、タンパク質の純度と濃度の高い水溶液を静置することで、大きくて美しい結晶が得られます。一方、生きた細胞の中、特に細胞質では非常に多くの種類の分子が絶えず動き回っているため、タンパク質の濃度を高くしても、結晶の形成は起きにくいと考えられています。
共同研究チームは、2002年に沖縄で採集したキクメイシサンゴ(図1、2)から、緑色の蛍光タンパク質「KikG」の遺伝子を取り出しました。その後2005年、KikGにアミノ酸変異を導入することで、紫外線を浴びて緑色から赤色に変わる蛍光タンパク質「KikGR」を作製し報告しました。今回、KikGRにアミノ酸変異を導入する実験過程で、ある改変体が細胞内で結晶化することを見つけ、これを「Xpa(Crystalizable and photo-activatable:クリスパ)」と命名しました(XpaのXは結晶、paは光による色変換を意味する)注)(図3)。タンパク質が細胞内で結晶化する過程や、その後の結晶の運命は今まで明らかにされておらず、共同研究チームはその解明に挑みました。
注)Tsutsui H, Karasawa S, Shimizu H, Nukina N, Miyawaki A. “Semi-rational engineering of a coral fluorescent protein into an efficient highlighter.” EMBO Rep. 2005 Mar;6(3):233-8.
研究手法と成果
共同研究チームは、Xpaタンパク質の遺伝子を通常の培養細胞(HEK293:哺乳類細胞)に導入し、細胞質内にできるXpaタンパク質の結晶を観察しました。その結果、ある割合の細胞で、結晶はひし形で数ミクロンのサイズに成長していました(図4)。
また、遺伝子導入後の培養細胞を、一定の時間間隔で静止画を撮り、それらをつないで編集するタイムラプスイメージングで観察したところ、結晶が著しく速いスピードで成長することが分かりました(図5)。結晶の核が形成されると同時に、細胞質に存在するほぼ全てのXpaタンパク質が瞬時に集合して結晶が完成したと考えられます。
透過型電子顕微鏡で観察すると、結晶内に、Xpaタンパク質の多量体構造が規則正しく整列する様子が確認されました(図6)。さらに結晶の周りに注目すると、結晶がある脂質膜[10]で覆われていることに気づきました。この脂質膜の由来および実体を免疫組織化学法で調べたところ、リソソーム膜であることが分かりました。
リソソームは、細胞内の不要なタンパク質を分解する仕組み(オートファジー)を担う細胞小器官です。オートファジーには2種類あり、1つは生体に不要な高分子やオルガネラを大規模に非選択的に分解する「非選択的オートファジー」、もう1つはユビキチン、p62、LC3などの特定の目印で標識したタンパク質を選択的に分解する「選択的オートファジー」です。
Xpaタンパク質の結晶のように大きな構造物の場合、非選択的オートファジーによって処理されると思われますが、免疫組織学実験で実際に解析したところ、ユビキチン、p62、LC3で標識されていることが確認され(図7)、Xpaタンパク質は選択的オートファジーにより処理されることが分かりました。
続いて、Xpaタンパク質の細胞内での結晶生成について検討しました。Xpaタンパク質の結晶が最終的にリソソーム内に存在することから2つの仮説を立てました(図8)。1つ目は、Xpaタンパク質がリソソーム内で濃縮されて結晶化し、そのままリソソーム内に存在するという仮説。2つ目は、Xpaタンパク質が細胞質内で結晶化し、その後オートファゴゾームという膜構造に囲まれ、最終的にリソソーム内に存在するという仮説です。これらの仮説を検証するために、リソソームの成熟を阻害する薬剤を細胞に加え、Xpaタンパク質の結晶化を観察しました。その結果、リソソームの成熟を阻害したにも関わらず、細胞質内に大きく美しいXpaタンパク質の結晶が確認されました。すなわち後者の仮説が正しいことが立証されました。
以上の結果から、Xpaタンパク質は細胞質内で結晶化し、その後“選択的”にオートファゴゾームに囲まれ、リソソームの腔内へと移行することが分かりました。
さらに、Xpaタンパク質の結晶が存在する細胞1個の凍結試料を作製し、大型放射光施設「SPring-8」[11]でX線回折構造解析を行いました。その結果、解析可能な回折パターンが得られ、2.9オングストローム(1Åは10-10m=0.1ナノメートル)の分解能でXpaタンパク質の立体構造を決定することができました(図9)。
今後の期待
本研究によって、タンパク質の結晶に対する細胞の応答に関する新知見が得られました。細胞質内にできたタンパク質の結晶は、選択的オートファジーによって排除されるように膜で隔離されることが分かりました。Xpaタンパク質の細胞内発現系を活用することで、結晶のような特殊構造物に対する細胞の許容、共存、排除について理解を深めることができます。
細胞内結晶の天然例は植物種子などに認められますが、一般的には非常に稀な現象とされています。Xpaタンパク質の結晶は蛍光を発して目立ったため発見できましたが、蛍光を発さない通常のタンパク質の結晶は見逃されてしまうでしょう。タンパク質の結晶化はもっと頻繁に起きていると考えてもおかしくはありません。将来、蛍光以外にも効率のよい検出技術が開発または活用されれば、細胞内のタンパク質結晶に関するより包括的な解析が可能になるでしょう。いずれにしても、結晶化しやすいように突然変異したタンパク質はどのように淘汰されていくのかを調べることは、分子進化[12]の観点で非常に面白いテーマであるといえます。また、結晶を凝集体に広げて考えると、アルツハイマー病におけるアミロイド斑やプリオン病におけるプリオン凝集などの細胞内存在意義に関連するテーマであるといえます。
結晶の生成過程は(1)核形成[13]と(2)成長とに分けて考えることができます。共同研究チームは、Xpaタンパク質の結晶の成長が飛躍的に速いことを示しました。今後、その成長過程をより高い時間分解能で観察することを計画しています。これにより細胞内の動的環境の中でも起こる規則的分子集合の実態の理解を目指しています。一方、Xpaタンパク質の結晶の核形成については、未解明な部分が多いのが現状です。核形成の仕組みが分かれば、Xpaタンパク質の結晶生成を時空間的に制御する技術の開発につながります。たとえば、共同研究チームは、結晶形成によって、細胞内の物質輸送を遮断したり、細胞膜を伸展させたりできる「細胞生物研究用マイクロマシン」の実現を夢見ています。
X線構造解析においては、タンパク質のきれいな結晶が必要です。結晶化しにくいタンパク質が、Xpaタンパク質との融合によって結晶化しやすくなるようなことがあれば、Xpaタンパク質は結晶化促進ツールとして構造生物学[14]分野での利用が考えられます。また、本研究のように、解析に耐えるタンパク質結晶を細胞内で自発的につくることができれば、細胞まるごとのX線構造解析が可能になります。とくに精製や再構成の難しいタンパク質会合体の構造解析に有利であると期待できます。
原論文情報
- Hidekazu Tsutsui,Yuka Jinno,Keiko Shoda, Akiko Tomita, Makoto Matsuda, Eiki Yamashita, Hiroyuki Katayama, Atsushi Nakagawa and Atsushi Miyawaki, "A diffraction-quality protein crystal processed as an autophagic cargo", Molecular Cell, doi: 10.1016/j.molcel.2015.02.007
発表者
理化学研究所
脳科学総合研究センター 細胞機能探索技術開発チーム
チームリーダー 宮脇 敦史 (みやわき あつし)
客員研究員 筒井 秀和 (つつい ひでかず)
(現:北陸先端科学技術大学院大学 マテリアルサイエンス学部 准教授)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.オートファジー(自食)、選択的オートファジー
オートファジーには2種類あり、1つは不要なタンパク質や細胞内小器官などを大規模に、そして非選択的に分解する「非選択的オートファジー」。もう1つは、ユビキチンなどの特定の目印で標識したタンパク質を選択的に分解する「選択的オートファジー」。 - 2.リソソーム
細胞小器官の一種で、膜に包まれた構造の内部に加水分解酵素を持ち、オートファジーなどによって取り込まれた生体高分子を加水分解する。 - 3.細胞質
細胞は外から内に向かって、細胞膜、細胞質、核で構成される。細胞質は、細胞内領域の中で核以外の部分。 - 4.改変体
遺伝子工学技術を使って、アミノ酸置換などの導入によってできたタンパク質。元々のタンパク質とは性質が異なる場合が多い。 - 5.透過型電子顕微鏡
英語名はTransmission Electron Microscopy(TEM)。観察する試料に電子線をあて、試料を透過する電子が作る干渉像を観察する電子顕微鏡。 - 6.ユビキチン、p62、LC3
ユビキチンは76個のアミノ酸からなるタンパク質で、さまざまなタンパク質に付加されて生体反応の目印として使われる。特に、不要なタンパク質の除去の過程では、ユビキチンが付加されたタンパク質はp62やLC3などのタンパク質を含む複合体と結合することで、オートファジーによって認識され分解される。 - 7.X線回折構造解析
物質の結晶にX線をあて、その回折(光が原子にぶつかってどのように曲げられるか)の結果を解析して物質構造を原子のスケールで解析すること。 - 8.アミロイド斑
アルツハイマー病患者の脳内に蓄積するアミロイドβタンパク質の凝集体。 - 9.プリオン凝集
プリオン病は脳組織がスポンジ状になる進行性の病気で、プリオンとよばれるタンパク質の分解異常によって、異常なプリオン凝集が脳組織に蓄積することで発症すると考えられている。 - 10.脂質膜
生体の膜構造で、主にリン脂質が親水性の部分を内側にして二重の構造を形成している。 - 11.大型放射光施設「SPring-8」
兵庫県の播磨科学公園都市にある世界最高性能の大型放射光施設。その運転管理と利用者支援は高輝度光科学研究センター(JASRI)が行っている。SPring-8の名前は Super Photon ring 8 GeVに由来する。放射光とは、電子を光とほぼ同速まで加速しながら磁石によって進路を曲げた時に発生する、細く強力な電磁波のこと。 - 12.分子進化
ダーウィンが唱えた動物の進化のように、タンパク質などの分子もそれらが働く生体環境の変化によって、分子のある特徴が進化するという考え方。またその過程を研究する学問分野。 - 13.核形成
物質が結晶構造をつくるにはその核となる構造が必要であるが、この核構造が形成される過程のこと。 - 14.構造生物学
さまざまな物質の構造を、X線回折など主に物理的現象を利用して、解析し同定する学問分野。

図1 サンゴ採集現場(2002年、沖縄)

図2 キクメイシサンゴ
ブラックライト(青紫色の光)照射で写真撮影。ここから緑色蛍光タンパク質「KikG」の遺伝子をクローニングした。KikGから紫(外)線依存的色変換型のKikGRが作製された。

図3 Xpaタンパク質
Xpaの細胞内結晶に紫色のレーザーを照射すると緑から赤への色変換が起こる。スケールバーは5ミクロン
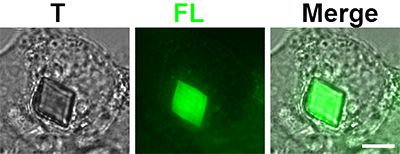
図4 HEK293細胞の細胞質にできたXpaタンパク質の結晶
スケールバーは5ミクロン。T:透過画像。FL:蛍光画像。Merge:TとFLを重ね合わせた画像。
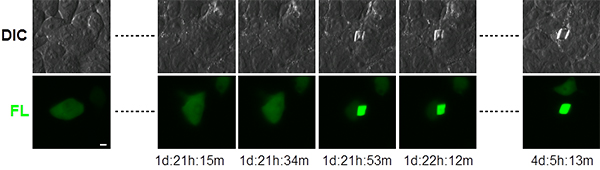
図5 Xpaタンパク質を発現するHEK293細胞のタイムラプスイメージング
細胞質全体に広がる緑色蛍光が瞬時に集まって結晶に成長する様子が分かる。スケールバーは5ミクロン。DIC:微分干渉画像、FL:蛍光画像。最下段に観察時間を「日:時:分」で表す。

図6 細胞質内にXpa結晶を抱えるHEK293細胞の透過型電子顕微鏡画像
スケールバー:(左)5ミクロン、(中)0.2ミクロン、(右)0.1ミクロン。結晶を取り囲む膜構造を矢印で示す。
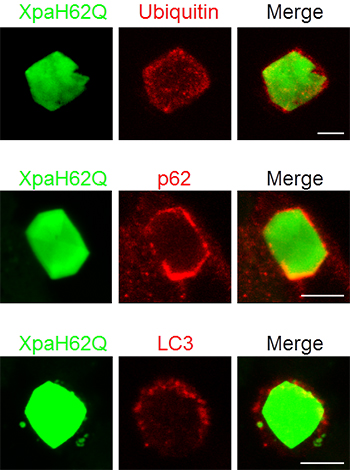
図7 Xpa改変体の結晶がユビキチン、p62、LC3で標識されている様子
結晶自身の緑色蛍光と免疫組織染色の赤色蛍光を示す。免疫組織染色の赤色蛍光との区別をつける都合上、色変換が起こらないXpaH62Qの結晶を材料にして実験を行った。XpaH62Qが一過的にユビキチン、p62、LC3で標識されていることが分かる。
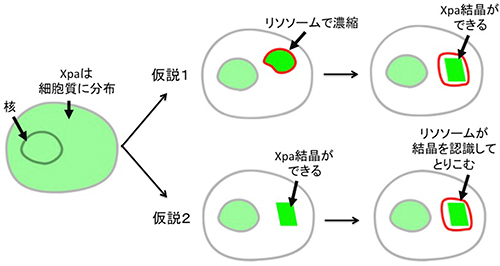
図8 Xpaタンパク質の細胞質内結晶生成に関する2つのモデル
- (上) 非選択的オートファジーによってリソソームで濃縮。
- (下) 細胞質でできた結晶が選択的オートファジーによってリソソーム膜で隔離。

図9 細胞1個から決定されたXpa4量体の立体構造
