要旨
理化学研究所(理研)バイオリソースセンター疾患ゲノム動態解析技術開発チームの阿部訓也チームリーダー、杉本道彦客員研究員とライデン大学による共同研究グループ※は、ヒト型の多能性幹細胞に近い性質を持つマウスエピブラスト幹細胞(Epiblast stem cell: EpiSC、以下Epi幹細胞)[1]の樹立効率を飛躍的に高めるとともに、樹立した細胞株を安定に維持する培養技術を開発しました。
哺乳類の胚[2]には、さまざまな細胞や組織に分化できる多能性[3]を持つ細胞が存在します。マウスES細胞(胚性幹細胞)は、マウスの着床前胚の多能性細胞から樹立されます。胚が子宮に着床[4]した後、多能性細胞はエピブラストと呼ばれる細胞へと発達します。Epi幹細胞は、マウスのエピブラストから樹立した多能性幹細胞です。多能性幹細胞には、未分化な「ナイーブ型」と分化が進んだ「プライム型」があり、マウスES細胞がナイーブ型であるのに対し、Epi幹細胞はプライム型です。また、Epi幹細胞は、マウスES細胞よりもヒトES細胞やヒトiPS細胞(人工多能性幹細胞)に性質が近いことからヒト型多能性幹細胞とも呼ばれ、ヒトES細胞やヒトiPS細胞の特徴を知るための重要なモデル細胞と言われています。しかし、Epi幹細胞はその樹立効率が低く、また安定に維持しながら培養することが困難でした。
共同研究グループは、シグナル分子であるWntタンパク質[5]がナイーブ型多能性幹細胞の未分化性を維持することに着目しました。Wntタンパク質の発現を阻害することでナイーブ型多能性幹細胞の増殖を抑制し、プライム型のEpi幹細胞の形成を促進できるのではないかと考えました。Wntタンパク質の分泌を抑制する低分子化合物を添加してEpi幹細胞の樹立を試みたところ、従来0~20%だった樹立効率が90~100%と大幅にアップしました。また、通常のEpi幹細胞は、培養中に自発的に分化した細胞が常に混在しており、未分化性を維持したまま培養することが困難でしたが、Wntタンパク質の発現の阻害により、分化細胞の出現が抑制され、未分化状態の細胞からなる均質な細胞集団を得ることもできました。さらに、阻害剤添加により樹立したEpi幹細胞は、多様な細胞へと分化する能力である、分化多能性を維持していることを確認しました。
今後、Epi幹細胞の解析を通じて、ヒト型多能性幹細胞のシグナル分子作用機構の解明、分化制御技術の開発、ヒトES細胞やヒトiPS細胞の樹立効率向上、高品質化に貢献すると期待できます。なお、今回樹立した均質な性質を持つ新規Epi幹細胞は、今後、理研バイオリソースセンターから学術機関や企業へ提供される予定です。
本研究は、文部科学省新学術領域研究「生殖細胞のエピゲノムダイナミクスとその制御」、「哺乳類初期発生の細胞コミュニティー」などの支援を受けて行われ、成果は米国の科学雑誌『Stem Cell Reports』(4月14日号)に掲載されるのに先立ち、オンライン版(3月26日付け:日本時間3月27日)に掲載されます。
※共同研究グループ
理化学研究所 バイオリソースセンター 疾患ゲノム動態解析技術開発チーム
チームリーダー 阿部 訓也(あべ くにや)
客員研究員 杉本 道彦(すぎもと みちひこ)
ライデン大学 医学センター
准教授 Susana Chuva de Sauza Lopes(スザナ・シューバ・サウザ・ロペス)
背景
哺乳類の胚には、多能性(将来さまざまな細胞や組織に分化し体全体を形成する能力)を持つ細胞が存在します。マウスの着床前胚である胚盤胞は、内部細胞塊と呼ばれる多能性細胞を含み、ここからES細胞(胚性幹細胞)が樹立されます。胚が子宮に着床した後、多能性細胞はエピブラストと呼ばれる細胞へと発達していきます。マウスのエピブラストからはエピブラスト幹細胞(Epi幹細胞)という多能性幹細胞を樹立できます。多能性幹細胞の状態には、未分化な「ナイーブ型」と分化が進んだ「プライム型」があり、マウスES細胞が未分化なナイーブ型であるのに対し、Epi幹細胞はプライム型と呼ばれます。(図1)。
Epi幹細胞は、マウスES細胞よりも、ヒトES細胞やヒトiPS細胞(人工多能性幹細胞)に性質が近いヒト型の多能性幹細胞です。そのため、ヒトES細胞やヒトiPS細胞の特徴を知るための重要なモデル細胞とされています。しかし、Epi幹細胞には、マウスES細胞に比べて樹立効率が低く、細胞株を安定して維持することが難しいといった難点がありました。
研究手法と成果
共同研究グループは、Epi幹細胞をより簡便に効率良く樹立でき、かつ安定して維持することが可能な培養技術の開発に挑みました。細胞の増殖や分化を司るシグナル分子であるWntタンパク質が、ナイーブ型多能性幹細胞の未分化性を維持することに着目し、Wntタンパク質を阻害することによりナイーブ型多能性幹細胞の増殖を抑制し、逆にプライム型のEpi幹細胞の増殖を促進できるのではないかと考えました。そこで、Wntタンパク質の分泌を抑制する低分子化合物を培地に添加して、Epi幹細胞の樹立を試みました。
子宮に着床した胚は、エピブラスト、臓側内胚葉、胚体外外胚葉の3種の組織からなり、図1右のような形態を示します。これまでは、胚の各組織を分離しエピブラストだけを採り出して培養することでEpi幹細胞を樹立していました。この時期の胚は、非常に小さいので、エピブラストのみを取り出すには熟練を要します。採り出したエピブラストを培養し続けると、ナイーブ型多能性幹細胞が形成するドーム状の細胞塊(コロニー)とは異なる、フラットな形態のコロニーが形成されます。しかし、それらの多くは維持・培養できず、Epi幹細胞となるのは0~19%の程度です。それに対して、培養開始時にWntタンパク質の分泌を抑制する低分子阻害剤を加えたところ、エピブラストの90~100%がEpi幹細胞となり、樹立効率が飛躍的に向上しました。また、エピブラストを含む胚の組織断片ごと採り出して培養したところ、樹立効率を損なわずEpi幹細胞を樹立できたことから、エピブラストと他の組織を分離する必要もなく、簡便にEpi幹細胞を樹立できることがわかりました(図2)。
通常のEpi幹細胞は、培養中に自発的に分化した細胞が混在するため、未分化性を維持したまま培養することが困難でした。Wntタンパク質の分泌阻害剤を入れた場合は、分化細胞の出現が抑制され、未分化性を維持した均質なEpi幹細胞の培養が可能となりました。また、阻害剤添加により樹立したEpi幹細胞は、阻害剤を除いて分化を誘導すると、多様な細胞へと分化することが可能であり、分化多能性を維持していることを確認しました(図3)。
阻害剤を添加したEpi幹細胞と無添加のEpi幹細胞とで遺伝子発現を比較したところ、Wnt阻害剤により、200余りの遺伝子の発現が低下しており、それらの多くは細胞分化に関わる遺伝子でした。実際に、中胚葉や内胚葉[6]への分化に必要な遺伝子の発現が阻害剤によって抑制され、より均質な細胞集団であることが再確認されました(図4)。
今後の期待
多能性の維持に関わるシグナル分子Wntの阻害剤を用いることで、より簡便に、より効率良く、ヒト型多能性幹細胞であるEpi幹細胞を樹立することが可能になりました。この方法により樹立したEpi幹細胞は、均質な未分化状態を保ち、かつ旺盛な分化多能性を維持した高品質な幹細胞株であることが分かりました。近年、ナイーブ型多能性幹細胞であるマウスES細胞の樹立・維持は、以前に比べ飛躍的に容易になりました。これはERKキナーゼ、GSK3酵素に対する2種の混合阻害剤「2i」[7]が使われるようになったためです。今回、共同研究グループが用いたWnt阻害剤は、2iとは全く異なるものですが、多能性幹細胞の樹立や維持を容易にするという意味では同等の意義を持ちます。今後、プライム型多能性幹細胞を用いたさまざまな研究に波及していくと考えられます。
これまでのEpi幹細胞集団の中には、Wntシグナルにより部分的に分化した細胞が混在していたため、Epi幹細胞本来の性質や、同一細胞株の中での不均一性や異なるEpi幹細胞株間の違いなどを正確に比較解析できませんでした。今後はWntの影響を排除することにより、より厳密に各細胞株内、細胞株間の差異を調べることが可能になると思われます。
Epi幹細胞はヒト型多能性幹細胞であり、Wntシグナルの阻害が、ヒトES細胞やヒトiPS細胞の樹立、維持にも同様な効果を持つ可能性があります。今回開発した培養技術を用いて、より均質な細胞群を樹立・解析し、ヒト−マウスに共通なプライム型多能性幹細胞の本質的な特徴や、ヒト、マウスそれぞれの種に特異的な幹細胞特性を明らかにしていくことは、哺乳類発生プロセスに関する基礎的理解をより深めると考えられます。また、より安定したプライム型多能性幹細胞の維持培養法や効率的な分化誘導法も開発可能となり、基礎、応用の両面で大きなインパクトをもたらすと期待できます。なお、今回樹立した均質な性質を持つ新規Epi幹細胞は、今後、理研バイオリソースセンターから学術機関や企業へ提供される予定です。
原論文情報
- Michihiko Sugimoto, Masayo Kondo, Yumiko Koga, Hirosuke Shiura, Rieko Ikeda, Michiko Hirose, Atsuo Ogura, Ayumi Murakami, Atsushi Yoshiki, Susana M. Chuva de Sousa Lopes, Kuniya Abe, "A Simple and Robust Method for Establishing Homogeneous Mouse Epiblast Stem Cell Lines by Wnt Inhibition", Stem Cell Reports, doi: http://dx.doi.org/10.1016/j.stemcr.2015.02.014
発表者
理化学研究所
バイオリソースセンター 疾患ゲノム動態解析技術開発チーム
チームリーダー 阿部 訓也(あべ くにや)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.エピブラスト幹細胞(Epi幹細胞)
エピブラストは着床後すぐの胚に存在する多能性細胞からなる細胞層。この細胞層からさらに外胚葉、中胚葉、内胚葉が作られ、将来の体全体が形成される。Epi幹細胞(Epiblast stem cell:EpiSC)は、マウスのエピブラストから樹立される。 - 2.胚
胚子(はいし)とも呼ぶ。発生過程の初期のステージにある個体を指し、マウスの場合、子宮の中で発達する。器官原基の形成が認められるステージ以降は胎仔(胎児)と呼ばれる。 - 3.多能性
分化多能性とも呼ぶ。多細胞生物の初期の胚は3つの胚葉(外胚葉、中胚葉、内胚葉)によって形成されているが、これらの三胚葉から、さらにさまざまな細胞が分化し、個体全体が形成される。細胞が三胚葉それぞれに分化する能力を持つ場合、多能性を持つという。ES細胞やEpi幹細胞のような幹細胞は、三胚葉のすべてに分化する能力を持つため、多能性幹細胞と呼ばれる。 - 4.着床
胚盤胞が母親の子宮の内膜に接着し、定着することを言い、マウスの場合は、受精後4.5日前後に起きる。 - 5.Wntタンパク質
ショウジョウバエの形態形成に関与する分泌タンパク質として発見されたが、その後、細胞増殖、分化や細胞運動などの重要な細胞機能の制御を行う分子であることが明らかになった。多能性幹細胞の増殖、分化の制御にも重要な役割を持つ。 - 6.中胚葉、内胚葉
哺乳類などの三胚葉性動物は、神経や表皮などになる外胚葉、消化管や肺、肝臓などの臓器をつくる内胚葉に加えて、2つの胚葉の間に形成され、循環系や筋肉などを作る中胚葉からなる。 - 7.混合阻害剤「2i」
ERKキナーゼ、GSK3酵素は、多能性を維持するために必要な遺伝子群の発現に抑制的に働く。2iは、この2種の酵素の活性を阻害する2種類の低分子化合物の混合物の通称で、この阻害剤を使うことにより、ナイーブ型多能性幹細胞であるマウスES細胞の樹立や維持が飛躍的に容易になった。
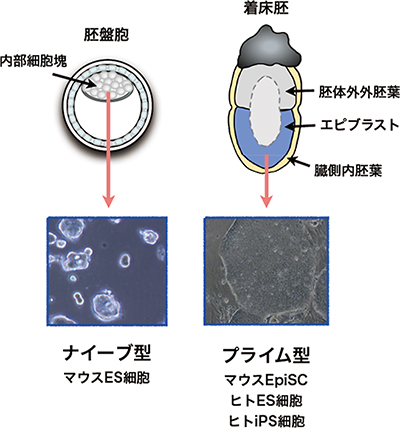
図1 マウス初期胚と多能性幹細胞
- 左: 受精後3.5日の着床前胚を胚盤胞と呼ぶ。中空のボール状の構造の中に、内部細胞塊と呼ばれる多能性細胞の塊があり、ここからナイーブ型のマウスES細胞が樹立される。
- 右: マウス胚の着床は、受精後4.5日ごろに起き、着床後の胚は、エピブラスト、胚体外外胚葉、臓側内胚葉の3種の組織で構成される。エピブラスト(青色部分)から、Epi幹細胞が樹立される。Epi幹細胞は、ヒトES細胞、ヒトiPS細胞とよく似た性質を持つことから、プライム型に分類される。
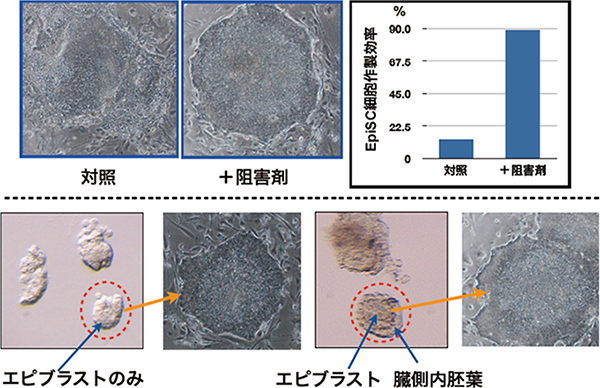
図2 Wnt阻害剤を用いたEpi幹細胞の高効率樹立法
エピブラストを培養する際に、Wntタンパク質の分泌阻害剤を添加することにより、Epi幹細胞の樹立効率が飛躍的に向上した。また、従来はエピブラストのみを採り出し培養することによってEpi幹細胞を樹立していたが、Wnt阻害剤を加えた場合はエピブラストと他の組織を分離する必要もなく、簡便にEpi幹細胞を樹立することが可能となった。
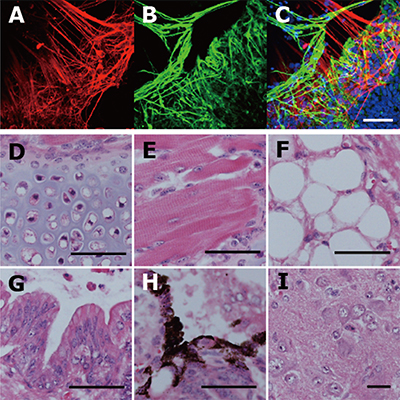
図3 Wnt阻害剤を用いて樹立したEpi幹細胞の分化多能性
Wnt阻害剤を用いて樹立したEpi幹細胞の分化多能性を試験管内分化(A-C)と奇形腫形成(D-I)の2つの方法で調べた。その結果、Epi幹細胞は旺盛な分化多能性を維持していることが確認された。
- (A-C)試験管内で分化した神経細胞。神経特異的マーカーである2種のタンパク質であるTUBB3(A)、NESTIN(B)が検出された。CはAとBを重ねた画像。
- (D-I)奇形腫中に形成された分化細胞。軟骨(D)、骨格筋(E)、脂肪細胞(F)、胃腸管上皮(G)、メラニン細胞(H)、神経組織(I)。
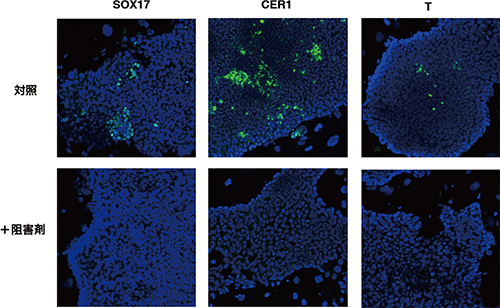
図4 Wnt阻害剤による均質なEpi幹細胞の樹立
通常の方法で樹立したEpi幹細胞は、細胞集団中に不均一な分化マーカータンパク質(SOX17, CER1, T)の発現が検出されるが、Wnt阻害剤を投与することにより、これらの分化マーカーの発現が抑制され、より均質な幹細胞が得られた。
