2015年7月15日
理化学研究所
東京医療センター
マウスの難聴進行抑制に関与する遺伝子情報を網羅的に収集
-難聴進行に関わる遺伝子探索の手がかりとなるデータを公開-
要旨
理化学研究所(理研)統合生命医科学研究センター医科学数理研究グループの角田達彦グループディレクター、宮冬樹リサーチアソシエイトおよび東京医療センターの松永達雄室長、務台英樹研究員らによる共同研究グループは、難聴マウスのエピジェネティクス[1]作用薬剤に応答する全ゲノムの遺伝子発現変動情報を収集し、そのデータを全世界に公開しました。
難聴は有病率の高い疾患の一つで、65歳以上の難聴の有病率は30%を超えると言われており、日本では約1,000万人が難聴と推計されます注1。聴力が衰えると、社会生活における他者とのコミュニケーションなどに多くの問題を生じ、生活の質を維持することが困難となります。進行性・加齢性の難聴の原因には生活習慣などの環境因子と遺伝的要因が複合的に関わっていると考えられています。これまでに発症に関連する因子の一部は明らかになっているものの、不明な点も多く、難聴進行のメカニズムの解明、難聴予防・治療法の開発が急務となっています。
共同研究グループは以前、早期に難聴が進行するモデル動物[2]であるDBA/2Jという系統のマウスに対して、エピジェネティクス作用薬剤であるLメチオニンとバルプロ酸の2種を同時に8週間投与することで、難聴の進行が統計的に有意に抑制されることを発見しました注2)。そこで、共同研究グループは、エピジェネティクス作用薬剤を投与されて難聴進行が抑制されたマウス群と非投与のマウス群の全ゲノム中の遺伝子の発現[3]状態を網羅的に調査し、その全発現データを世界中の研究者が自由に利用できる形で公開注3)しました。
本研究により、エピジェネティクス作用薬剤による難聴の進行抑制時に発現変動する遺伝子が網羅的に明らかになりました。難聴進行抑制メカニズムや難聴そのもののメカニズムの解明、難聴の薬剤による予防や治療ターゲットの探索にも繋がっていくことが期待できます。
本研究結果は、欧州のオンライン科学雑誌『Genomics Data』(7月2日付け)に掲載されました。
- 注1) 総務省統計局 平成27年1月確定値に基づく。
- 注2) 米国科学雑誌PLoS ONE 2015年4月14日号、Mutai H, Miya F, Fujii M, Tsunoda T, Matsunaga T. Attenuation of Progressive Hearing Loss in DBA/2J Mice by Reagents that Affect Epigenetic Modifications Is Associated with Up-Regulation of the Zinc Importer Zip4. PLoS ONE. 10, e0124301 (2015).
- 注3) 米国国立衛生研究所(NIH)の国立生物工学情報センター(NCBI)の公共データベースGene Expression Omnibus(GEO)(英語)に掲載。
背景
難聴は有病率の高い疾患の一つで、65歳以上の有病率は30%を超えると言われており、日本では約1,000万人が難聴と推計されます。聴力が衰えると、社会生活における他者とのコミュニケーション、音楽などの趣味、緊急時の情報伝達などに多くの問題を生じ、生活の質を維持することが困難となります。進行性・加齢性の難聴の原因には生活習慣などといった環境因子と遺伝的要因が複合的に関わっていると考えられており、これまでに発症関連因子の一部は明らかになっているものの、不明な点も多く、難聴進行のメカニズムの解明、そして難聴予防・治療法の開発が急務となっています。
共同研究グループは以前、早期に難聴が進行するモデル動物であるDBA/2Jという系統のマウスに対して、エピジェネティクス作用薬剤であるLメチオニンとバルプロ酸の2種類を同時に8週間投与することで、難聴の進行が統計的に有意に抑制されることを発見しました注1)。そこで今回、共同研究グループは、その難聴の進行抑制に関与している遺伝子を探索することと、そのデータを広く他の研究者にも活用してもらうことを目的とし、そのエピジェネティクス作用薬剤を投与されて難聴が抑制されたマウス群と非投与のマウス群の全ゲノム中の遺伝子の発現状態を網羅的に調査することにしました。
研究手法と成果
共同研究グループはまず、難聴が発症し始める時期である生後4週齢のDBA/2Jマウスに、1日1回、マウスの体重1kg当たり500mgのLメチオニンと300mgのバルプロ酸を8週間投与し続けました。そして、投与前の4週齢マウスと、8週間の投与を行った12週齢のマウス、薬剤非投与群の12週齢のマウスの3種類のDBA/2Jマウスを準備しました(図1)。次に、それらのマウスの内耳の蝸牛(かぎゅう)[4]での遺伝子発現を調べるため、マイクロアレイ[5]と呼ばれる全ゲノム中の遺伝子発現を調べることができる微小チップを使い、このマウスの蝸牛のmRNA量(遺伝子発現量)を測定しました(図1)。
結果として、少なくとも薬剤投与または非投与の一方のマウスで発現が見られた遺伝子として15,489遺伝子の発現データを収集しました。そのうち49種の遺伝子は薬剤投与時に遺伝子発現量が統計的に有意に上昇していた一方で、195種の遺伝子は薬剤投与時に遺伝子発現量が統計的に有意に減少していることが分かりました(図2)。
共同研究グループは、今回のデータを公表すると同時に、米国国立衛生研究所(NIH)の国立生物工学情報センター(NCBI)のGene Expression Omnibus(GEO)という公共データベースに、この薬剤投与・非投与のマウスの全ゲノム遺伝子発現データを提供し、世界中の難聴を専門とする研究者が誰でも自由に無償で活用できる形で公開しました。
今後の期待
共同研究グループは、エピジェネティクス作用薬剤による難聴の進行抑制時に発現変動する遺伝子を網羅的に明らかにしました。また、調査した難聴の進行を抑制する薬剤を投与したマウスと未投与のマウスの全ゲノム遺伝子発現情報に関するデータを全世界に公開しました。
本研究で発見した遺伝子のうち、どの遺伝子が実際に難聴の進行抑制に関与しているかは現時点では確定的ではありません。しかし、一例として薬剤投与マウス群で非投与マウス群に比べて発現が上昇していたSlc39a4(別名Zip4)という遺伝子が薬剤による難聴進行抑制に強く関与しているのではないかと共同研究グループは推測しています。Slc39a4という遺伝子は体の中で亜鉛の細胞への取り込み機能に関与していることが知られていて、亜鉛が欠乏した食料を与えたマウスでは難聴が発症することや、血中の亜鉛濃度が低下している老人性難聴または耳鳴の患者に対して亜鉛サプリメント摂取が症状の改善に有効であるという報告から、亜鉛と正常な聴覚の機能との強い関連性が知られているためです。
このSlc39a4遺伝子のように、今回遺伝子発現の変動が見られた遺伝子群には難聴との関連性がある遺伝子が多数含まれている可能性が大きく、さらにそれらの遺伝子の機能と難聴との関連性を調査することで難聴のメカニズムの解明が進むことが期待できます。さらに、共同研究グループが公開したデータを世界中の難聴を専門とする研究者がさらに詳しく解析することで、難聴抑制に関わるメカニズムの更なる解明や、将来的に難聴の予防法や治療法の開発に繋がることが期待できます。
原論文情報
- Fuyuki Miya, Hideki Mutai, Masato Fujii, Keith A. Boroevich, Tatsuo Matsunaga, Tatsuhiko Tsunoda, "Gene expression profiling of DBA/2J mice cochleae treated with L-methionine and valproic acid", Genomics Data, doi: 10.1016/j.gdata.2015.06.022
発表者
理化学研究所
統合生命医科学研究センター 医科学数理研究グループ
グループディレクター 角田 達彦(つのだ たつひこ)
リサーチアソシエイト 宮 冬樹(みや ふゆき)
東京医療センター
耳鼻咽喉科/感覚器センター/臨床遺伝センター
室長 松永 達雄(まつなが たつお)
研究員 務台 英樹(むたい ひでき)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
東京医療センター 事務部(担当:塚野)
Tel: 03-3411-0111 / Fax: 03-3412-9811
stsukano@ntmc.hosp.go.jp(※[at]は@に置き換えてください。)
補足説明
- 1.エピジェネティクス
染色体上(ゲノム)の遺伝子情報を持つDNAの塩基配列(A, T, G, Cの4種類の塩基と呼ばれる物質の連続配列でヒトの場合、約30億塩基存在する)には変化を伴わず、ゲノムが何からの変化を受けること。主なものとしては、DNAの配列は変わらないのにメチル基というものがDNAに結合する「DNAメチル化」、ヒストンという染色体を構成する物質がメチル化やアセチル化・リン酸化と呼ばれる変化を起こす「ヒストンの化学的修飾」などがある。今回の研究で用いたLメチオニンやバルプロ酸などの「エピジェネティクス作用薬剤」とは、このようなメチル化やアセチル化などの変化を引き起こすことが知られている薬剤のこと。 - 2.モデル動物
疾患患者と同様または類似の病態を示し、特定の疾患研究に使われる動物のこと。ヒトでは直接研究できない体内の反応などはモデル動物を使うことで調査が可能となる。今回の研究で使われたDBA/2Jという特殊なマウスは、早ければ生後3週間目程度から難聴が進行し始める。このマウスは少なくとも Cdh23と Fscn2と呼ばれる2つの遺伝子に異常を持っていることが知られており、難聴の研究によく用いられる。 - 3.遺伝子の発現
DNA配列のうち一部は重要な働きをする特定のタンパク質の設計図となっており、そのDNAの部分を遺伝子と呼ぶ。遺伝子領域のDNAからは、最初にmRNA(メッセンジャーRNA)と呼ばれる物質が作られ、ほとんどの場合はそのmRNAを元にして最終産物としてタンパク質が作られる。つまり、DNAからmRNAがたくさん作られている場所は、その遺伝子DNAの場所に書かれている設計図のタンパク質がたくさん作られることになる。「遺伝子の発現」とは、この遺伝子領域のDNAからmRNAが作られる過程のことを指し、遺伝子が多く発現していれば、通常はそれに伴って作られるタンパク量も増加する。薬剤を加えた時のmRNAの発現量の変化を調べることで、DNAのどの場所の遺伝子が薬剤に応答する重要な遺伝子(タンパク質)であるかを調査することができる。 - 4.蝸牛(かぎゅう)
内耳にある聴覚を司る感覚器官。難聴患者の多くは蝸牛に何らかの機能不全が生じている。 - 5.マイクロアレイ
遺伝子の発現を全ゲノムに渡り網羅的に測定することができる小さなチップのこと。チップ上には全遺伝子に対応した短いDNAが数万個貼り付けてあり、そこに自分の検体のmRNA由来の溶液を注入すると、チップ上の対応する遺伝子のDNAと結合する。結合時に光を発するように工夫されており、その光量を高感度スキャナーで測定することで検体の全遺伝子発現量を一度に調べることができる。
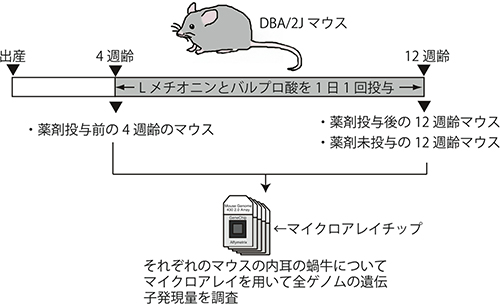
図1 実験の全体概要図
難聴が発生し始める生後4週齢のDBA/2Jマウスに対してLメチオニンとバルプロ酸を1日1回投与した。投与前の4週齢マウスと、8週間の薬剤投与を行った12週齢のマウス、そして薬剤非投与群の12週齢のマウスの3種類のDBA/2Jマウスを準備し、マイクロアレイチップを用いてそれぞれの内耳の蝸牛におけるmRNA量(遺伝子発現量)を測定した。
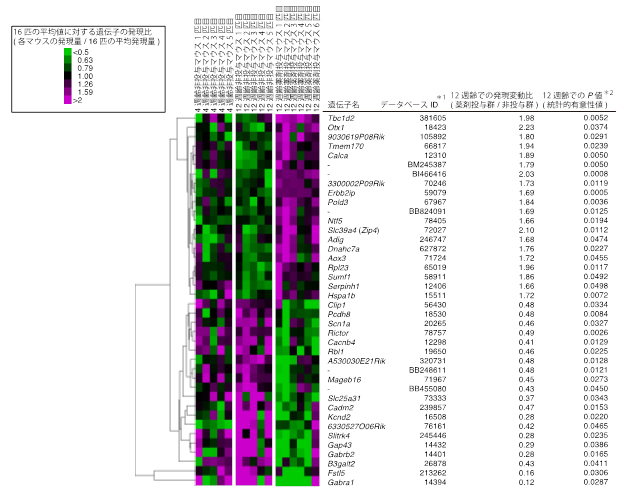
図2 12週齢の薬剤投与と非投与マウス間で統計的有意差が見られた遺伝子
12週齢の薬剤投与と非投与マウス間で統計的有意差が見られた発現上昇遺伝子と発現現象遺伝子の各上位20遺伝子。データベースIDとはEnzrezまたはGenBankというデータベースにおける遺伝子ID番号。検定にはt検定を用いており、P値が0.05より小さいものを有意とした。
