要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センター標識化学チームの土居久志チームリーダー、健康・病態科学研究チームの渡辺恭良チームリーダーらと、武田薬品工業株式会社(武田薬品)ジャパンコンシューマーヘルスケアビジネスユニット研究開発部の二宮伸二部長らの共同研究グループ※は、チアミン[1](ビタミンB1)とフルスルチアミン[1](ビタミンB1誘導体)を炭素の放射性同位体(炭素11:11C)[2]で標識する有機合成法を確立し、生体ラット内でのビタミンB1とビタミンB1誘導体の動態をPET[3]で可視化することに世界で初めて成功しました。
ビタミンB1は物質として初めて報告されたビタミンであり、1910年、理研の設立者の一人である鈴木梅太郎[4]により、米糠(こめぬか)の抽出物としてオリザニン(現在の化合物名はチアミン)と命名されました。ビタミンB1は脚気の予防・治療薬であり、また疲労改善などの有効性も着目され、服用に適したビタミンB1の誘導体が多数開発・発売されてきました。なかでも武田薬品が1961年に発売したビタミンB1誘導体であるフルスルチアミンは、商業的に大きな成功を収めています。
一方、ビタミンは生物学的に重要な生体分子であるにも関わらず、摂取したビタミンやその誘導体が体内のどこに集積し、どのように効果を発揮するのかなど、個体レベルでの作用機序については不明な点が多く残されています。そこで共同研究グループは、ビタミンB1とビタミンB1誘導体のラット体内での動態を解析するため、これらの化合物の炭素骨格に11Cを組み込む有機合成法の開発に取り組みました。半減期が20.4分と超短寿命の11Cによる標識を実現するためには、(1)クロスカップリング型炭素−炭素結合法[5]に基づく11C-標識反応の迅速化、(2)11C-標識した化合物(11C-標識PETプローブ[3])の放射線分解の抑制、(3)動物およびヒトに投与可能な高純度溶液の調製などの課題がありました。それらを克服することで、ビタミンB1とビタミンB1誘導体の11C-標識PETプローブの合成に世界で初めて成功しました。合成した11C-標識PETプローブをラットに投与しPET撮像を行った結果、体内動態の追跡に有効であることが実証されました。今後、11C-標識PETプローブを用いた臨床研究により、ビタミンB1およびその誘導体の疲労回復効果の解明を進めることを検討しています。またビタミン以外の機能成分のPETプローブ化にも取り組み、健康補助食品の開発促進や有効性の客観的評価法の確立をめざします。
本研究は、米国化学会の科学雑誌『The Journal of Organic Chemistry』(6月19日付け)に掲載されました。
※共同研究グループ
理化学研究所
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門
イメージング化学研究グループ 標識化学研究チーム
チームリーダー 土居 久志(どい ひさし)
リサーチアソシエイト 馬渡 彩(まわたり あや)
イメージング応用研究グループ 健康・病態科学研究チーム
チームリーダー 渡辺 恭良(わたなべ やすよし)(センター長)
研究員 野崎 聡(のざき さとし)
分子イメージング科学研究センター(現:ライフサイエンス技術基盤研究センター)
分子イメージング創薬化学研究チーム
チームリーダー 鈴木 正昭(すずき まさあき)(研究当時)
リサーチアソシエイト 金澤 奨勝(かなざわ まさかつ)(研究当時)
武田薬品工業(株)
ジャパンコンシューマーヘルスケアビジネスユニット 研究開発部
課長代理 野村 之博(のむら ゆきひろ)
プロダクトマネージャー 秋元 浩二(あきもと こうじ)
主席部員 北吉 正人(きたよし たかひと)
部長 二宮 伸二(にのみや しんじ)
背景
チアミン(ビタミンB1)は糖質の代謝や神経伝達に関わり、欠乏すると脚気を引き起こすなど、ヒトにとって欠かせないビタミンの1つです。ビタミンB1は物質として初めて報告されたビタミンであり、1910年、理化学研究所の設立者の一人であった鈴木梅太郎により、米糠(こめぬか)由来の抗脚気成分としてオリザニン(現在の化合物名はチアミン)と命名されました。
ビタミンB1は体内で生合成できませんが、通常は食事に含まれる量で充分な摂取が可能です。ただし、経口摂取されたビタミンB1は腸で吸収されるものの、ビタミンB1は水溶性物質のため腸管上皮からの吸収率が低く、さらに分解されやすい性質があります。そのため服用に適した薬剤として、脂溶性を高めて腸管吸収を促進し、安定性や薬剤香気等を改善したビタミンB1誘導体が多数開発されてきました。例えば、武田薬品が抗疲労剤として開発したフルスルチアミンは、1961年の販売開始以来、商業的にも最も大きな成功を収めたビタミンB1誘導体として知られています。このように、ビタミンB1やビタミンB1誘導体は医薬品・栄養補助食品として重要な分子ですが、腸管で吸収された後、体内のどこに集積して、どのように作用を発現しているかなど、個体レベルでの作用機序には不明な点が多く残されています。
体内に取り込んだ分子を定量的かつ非侵襲に追跡する方法として、標的となる分子を放射性同位体で標識し、可視化するPETという画像解析法があります。なかでも炭素の放射性同位体(炭素11:11C)を使った標識法は、分子本来の化学構造を変えずにPETプローブ化できるため、標的分子そのものの体内動態を追跡するのに有効です注)。しかし11Cは半減期が20.4分と超短寿命であるため、充分な放射活性を保つPETプローブを得るには、炭素-炭素結合反応(ここではクロスカップリング法)を含む複数段階の有機合成反応を迅速に行い、生体投与に適した状態にする一連の作業をなるべく1時間以内に完了する必要があります。そのため、通常の一般的な合成反応(反応時間が数時間から数十時間)のほとんどはPETプローブ合成に適さず、新たな化学合成法の開発が課題となっていました。
注)2011年12月2日プレスリリース「放射性同位体11Cで尿酸を標識することに成功」
研究手法と成果
共同研究グループは、チアミンとフルスルチアミンの生体内での動態を解析するため、これらの化合物の炭素骨格に11Cを組み込む有機合成法(11C-標識化)の開発を試みました。そこで、本研究では、チアミンとフルスルチアミンの構造中に存在するメチル基(図1)に注目しました。このメチル基を11Cを含む[11C]メチル基で標識することを目的として、基本反応となる高速C-[11C]メチル化法[6]の改良と、化学合成法の最適化を行いました。
図2のように、まず、ヒドロキシエチルチアゾールのトリブチルスズ化合物(図2中の1)を出発原料として、理研が開発したパラジウム(Pd0)触媒を用いた高速C-[11C]メチル化反応(反応時間3分)により、目的の[11C]メチル化体([11C]-2)を86%の高収率で合成できる化学的手法を開発しました。次に、ハロゲン化メチルピリミジン(図2中の3)を用いたベンジル化反応(反応時間7分)により、目的の11C-標識チアミン([11C]-4)を得ることに成功しました。この[11C]-4を、さらに塩基性条件下でテトラヒドロフルフリルブンテ塩(図2中の5)と反応させて(反応時間3分)、ジスルフィド基[7]を有する最終産物の11C-標識フルスルチアミン([11C]-6)に変換できました。
しかし、合成した11C-標識フルスルチアミン([11C]-6)の安定性を調べた結果、放射線分解により、再び11C-標識チアミン([11C]-4)に戻ってしまうことが分かりました。この原因として、放射線分解により発生したラジカル[9]が11C-標識フルスルチアミン([11C]-6)のジスルフィド結合の解離を引き起こしているものと考えられました。そこで、ラジカルを捕捉する抗酸化物質であるクエン酸やアスコルビン酸を添加したところ、放射線分解を抑制できることが分かりました。さらに、水溶性のチアミンを短時間で確実に分離精製する手法により、高純度投与溶液の調剤法も確立しました。これらの結果、11C-標識チアミンおよび11C-標識フルスルチアミンといった11C-標識PETプローブの合成を、それぞれ60分、および70分以内で達成することができました。
次に、これらチアミンおよびフルスルチアミンの11C-標識PETプローブをラット静脈に投与し、PET撮像を行いました。チアミンは速やかに全身に行き渡り、その後、肝臓や腎臓からの排出プロセスに移行する様子が観察されました(図3-a)。一方、フルスルチアミンは、投与初期は心臓に集積するなど、チアミンと異なる体内動態をとることが初めて明らかになりました(図3-b)。
今後の期待
今後は、本研究で開発した11C-標識PETプローブを臨床研究に応用展開し、チアミンの体内動態とビタミンB1欠乏時の諸症状の関連性や、フルスルチアミンの疲労回復効果の解明を進めることを検討します。
また本研究における11C-標識の実現にあたっては、通常の有機化学の反応条件ではみられない多くの課題を、基礎化学である有機合成化学的方法論に基づいて解決しました。今回の成功例を踏まえて、高速C-[11C]メチル化反応をはじめとした11C-標識法が、ビタミン以外のさまざまな生体分子に適用可能か検討を進めていきます。これにより、薬剤をはじめ、食品に含まれる成分が、ヒトの健康に実際にどのように作用しているかをPETにより検証・評価していく予定です。
原論文情報
- Hisashi Doi, Aya Mawatari, Masakatsu Kanazawa, Satoshi Nozaki, Yukihiro Nomura, Takahito Kitayoshi, Kouji Akimoto, Masaaki Suzuki, Shinji Ninomiya, and Yasuyoshi Watanabe, "Synthesis of11C-Labeled Thiamine and Fursultiamine for in Vivo Molecular Imaging of Vitamin B1 and Its Prodrug Using Positron Emission Tomography", The Journal of Organic Chemistry, doi: 10.1021/acs.joc.5b00685
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 イメージング化学研究グループ 標識化学研究チーム
チームリーダー 土居 久志(どい ひさし)
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 イメージング応用研究グループ 健康・病態科学研究チーム
チームリーダー 渡辺 恭良(わたなべ やすよし)
 土居 久志
土居 久志
お問い合わせ先
理化学研究所 ライフサイエンス技術基盤研究センター
広報・サイエンスコミュニケーション担当 山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.チアミン、フルスルチアミン
チアミンは水溶性ビタミンの一種で、ビタミンB1とも呼ばれる。炭水化物や脂肪などの代謝に関わり、不足すると細胞のエネルギー産生に支障をきたす。水溶性であるため、調理時の水洗いなどで失われやすく、また体内に吸収されにくい。フルスルチアミンは武田薬品が1961年に発売したビタミンB1誘導体で、腸管から吸収されやすく、細胞内でチアミンに復元される。 - 2.炭素の放射性同位体(炭素11:11C)
炭素の同位体。安定同位体である炭素12の原子核が6個の陽子と6個の中性子からなるのに対し、6個の陽子と5個の中性子からなる。陽電子を放出して安定なホウ素11になるため、PETプローブの標識に用いられる。半減期20.4分。 - 3.PET、PETプローブ
PETはPositron Emission Tomographyの略で、陽電子放射断層画像撮影法と呼ばれる。陽電子を放出する放射性同位体を薬剤などの分子に組み込んで個体に投与し、体内で崩壊して放出されるγ線を測定してその分子の体内分布を見る方法。PETで投与する分子をPETプローブ、あるいはPET分子プローブと呼ぶ。 - 4.鈴木梅太郎
1874~1943年。農芸化学者。東京帝国大学教授であった1910年、米糠からオリザニンを抽出した。1916年に理研の設立に参画。合成酒の製造研究なども行った。 - 5.炭素−炭素結合(クロスカップリング)法
クロスカップリングは、異なる分子同士を結合させて新たに一つの分子を生成する反応。本反応は2010年のノーベル化学賞の受賞対象ともなった(Richard F. Heck、根岸英一、鈴木章の3名が受賞)。炭素と炭素を結合させるクロスカップリング反応は有機合成に非常に重要である。なお、本反応にかかる時間は一般的には数時間以上が必要である。 - 6.高速 C-[11C]メチル化法
Pd(パラジウム)などの有機金属触媒を用いることで、わずか5分で最小の炭素置換基である[11C]メチル基を炭素骨格上に導入する合成手法。理研グループが主体となって独自に開発してきたもの。 - 7.ジスルフィド基
2つの硫黄(S)原子がつながった官能基。 - 8.遠隔操作型標識用合成装置
放射線被曝を防ぎ、安全かつ円滑に化学合成を行うための装置。なお、標識用合成装置という用語は私達の研究グループで用いているものであり、一般には自動合成装置と呼ばれることが多い。当グループでは有機合成化学者の視点から、合成法が一般化・自動化されたものを扱う「自動合成装置」と、新たな標識法の確立など研究目的に用いる「標識用合成装置」を使い分けている。 - 9.ラジカル
不対電子をもつ原子や分子。不対電子を持った状態は不安定であるため、まわりの原子や分子とすぐに反応する。
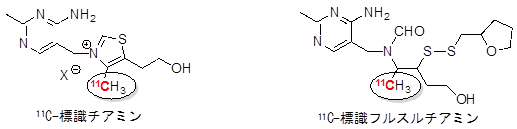
図1 目的の11C-標識チアミンおよびフルスルチアミンの構造式
チアミンとフルスルチアミンは、それぞれ2つのメチル基を持つ低分子有機化合物である。本研究では、高速C-[11C]メチル化法に適した11C-標識部位として、丸で囲んだメチル基を選択した。
![高速C-[11C]メチル化反応を用いたチアミンおよびフルスルチアミンの11C-標識体の合成の図](/medialibrary/riken/pr/press/2015/20150731_3/fig2.jpg)
図2 高速C-[11C]メチル化反応を用いたチアミンおよびフルスルチアミンの11C-標識体の合成
- 上) トリブチルスズ化合物(1)を出発原料に用いて、高速C-[11C]メチル化反応により[11C]メチル化体([11C]-2)を合成した(反応時間3分)。続いて、ベンジル化反応により、目的の11C-標識チアミン([11C]-4)を合成(反応時間7分)した後、この[11C]-4を、ジスルフィド化反応により、最終目的の11C-標識フルスルチアミン([11C]-6)へと変換した(反応時間3分)。
- 下) PETプローブ合成用の遠隔操作型合成装置[8]。PETプローブの合成は放射性条件下で行われるため、遮蔽構造を備えた合成装置が用いられる。上記のベンジル化反応ならびにジスルフィド化反応は有機化学の分野では一般的な化学反応であるが、合成装置を用いてわずか数分の反応時間で、かつ、連続合成を実現するには、反応条件の最適化など多くの試行錯誤が必要であった。
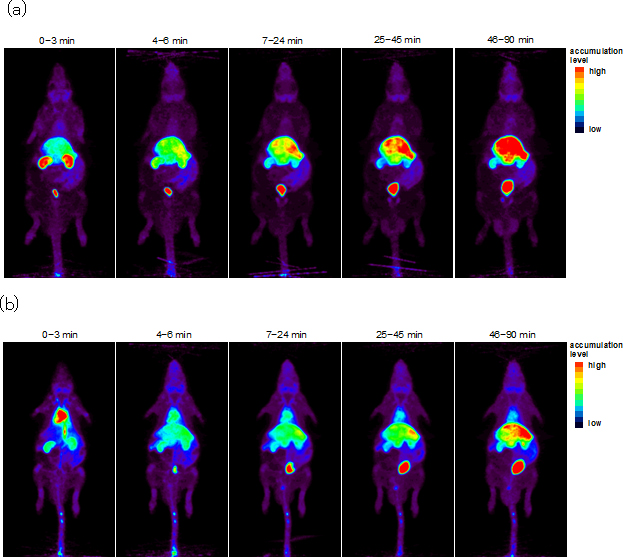
図3 ラット全身のPETイメージング
- (a) 11C-標識チアミンの投与結果
- (b) 11C-標識フルスルチアミンの投与結果。各写真の上の数字は、PETプローブ投与後の撮像時間帯を示す。
