要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センター細胞動態解析ユニットの清末優子ユニットリーダーと、光量子工学研究領域画像情報処理研究チームの横田秀夫チームリーダー、山下典理男特別研究員、森田正彦特別研究員らの国際共同研究グループ※は、最新の高速高解像度蛍光顕微鏡技術である「格子光シート顕微鏡[1]」で得られる膨大な三次元画像データを自動解析する計算処理技術を開発しました。その結果、従来のデータ解析法では捉えることができなかった、細胞分裂時の微小管の動きを解析することに成功しました。
細胞の生命現象を理解するには、生きた細胞内部の微細な構造が激しく動く様子を捉える必要があります。国際共同研究グループは2014年に、細胞内の微小管[2]の伸長を可視化するEB1-GFP融合タンパク質[3]と、高速性と高い解像度を備えた格子光シート顕微鏡を利用し、細胞分裂時の微小管の動きを三次元的に追跡しました。しかし、格子光シート顕微鏡がもたらすデータは膨大で、従来行われていた研究者の視覚と手作業に頼る分析では、データを精密に解析できませんでした。
そこで国際共同研究グループは、これまでに開発してきた大容量画像処理システムVCAT5[4]と幾何学的な数理計算処理技術を組み合わせることで、膨大な画像データの自動解析法を開発しました。開発した手法を用いてHeLa細胞[5]の分裂時の、微小管の伸長開始点や到達点、伸長の角度等を詳細に解析したところ、細胞生物学で議論が続いている非中心体性微小管[6]の存在を裏付ける結果が得られました。今後、格子光シート顕微鏡は細胞分裂研究にとどまらず、細胞動態解析のための中心的な技術として広く役立つと期待できます。
本研究は、米国の科学雑誌『Journal of Biomedical Optics』の下村脩博士の功績(GFPの発見)を記念する特集号(10月号)掲載に先立ち、オンライン版(11月3日付け)に掲載されました。
※国際共同研究グループ
理化学研究所
ライフサイエンス技術基盤研究センター 細胞動態解析ユニット
ユニットリーダー 清末 優子 (きよすえ ゆうこ)
光量子工学研究領域 画像情報処理研究チーム
チームリーダー 横田 秀夫(よこた ひでお)
特別研究員 山下 典理男(やました のりお)
特別研究員 森田 正彦(もりた まさひこ)
ハワード・ヒューズ医学研究所 ジャネリア・リサーチキャンパス
Betzig研究室
グループリーダー エリック・ベツィグ(Eric Betzig)
リサーチサイエンティスト ウェスリー・レガント(Wesley R. Legant)
リサーチサイエンティスト ビーチャン・チェン(Bi-Chang Chen)(現 台湾Academia Sinica)
背景
細胞分裂において、母細胞が複製したDNAが2つの娘細胞に正しく受け継がれるためには、多数の微小管で構成された細胞内構造(分裂装置)が正確に作動する必要があります(図1(a))。分裂装置は主に、2つの中心体から外側に伸びる星状体微小管と、2つの中心体の間に紡錘状の形状をつくる紡錘体微小管で構成されます。微小管は球状のタンパク質がつながった構造をしており、主に中心体を起点として生成されるとこれまで考えられてきました。しかし、近年では紡錘体微小管を起点として生成する「非中心体性微小管」の重要性が提唱されています。しかし、従来の技術では、微小管が密集する紡錘体内部における個々の微小管の動態を検出できず、非中心体性微小管の動態を詳しく解析することができませんでした。このように微細で動的な生命現象をとらえるには、生きた細胞のライブイメージングが欠かせません。生きている細胞の内部構造は微細かつ激しく動いているため、ライブイメージングには高い解像度と高速での撮影が求められます。さらに、GFP等の蛍光タンパク質を利用したライブイメージングでは、光を当てることによって生じる光毒性や蛍光タンパク質の蛍光褪色も大きな制約となるため、従来の技術では細胞の一部分のみを観察することしかできませんでした。
ハワード・ヒューズ医学研究所のベツィグらの研究チームが2014年に発表した格子光シート顕微鏡は、高速性と高解像度を兼ね備えた新しい顕微鏡技術です。この顕微鏡は1秒以内に200枚以上の光学切片像を撮影することで試料を高速スキャンし、細胞を丸ごと三次元画像化することができます。xyzいずれの方向にも高い解像度を達成したことで、歪みのない正確な三次元情報を得ることができる上、得られた三次元映像を回転させてあらゆる方向から詳しく観察することが可能です。さらに、理研の清末らの研究チームは、分裂装置を構成する微小管の伸長を観察するため、伸長する微小管の先端に結合して彗星(コメット)のような蛍光シグナルを発するGFP融合EB1タンパク質を発現する細胞を作製しました(図1b)。この細胞を格子光シート顕微鏡で撮影したところ、分裂装置を構成する微小管の伸長を三次元的に追跡できることが分かりました注)。しかし、格子光シート顕微鏡によって撮影された膨大な数の画像データは、従来行われていた研究者の視覚と手作業に頼る分析の限界を超えており、新たな解析手法が必要でした。
そこで、国際共同研究グループは、大容量画像処理システムVCAT5と幾何学的な数理計算処理を行うために新たに開発した解析プログラムを組み合わせることで、膨大な画像データと得られた数値情報の自動解析法の開発を目指しました。
注)2014年10月29日トピックス「格子光シート顕微鏡が明かす細胞分裂の仕組み」
研究手法と成果
国際共同研究グループは、微小管伸長と染色体をそれぞれ可視化するタンパク質であるEB1-GFPとH2B-TagRFPを発現するHeLa細胞を用い、格子光シート顕微鏡による細胞分裂過程のライブイメージングを行いました(図1b)。今回の研究では、微小管動態を高精度に解析するため、EB1-GFPチャネルのみを、最も高速で走査できるモードで撮影しました。データは、高解像度で細胞全体を三次元スキャンしながら0.755秒間隔で連続撮影したものです。これによって、細胞分裂装置全体にわたる微小管の伸長の動態を追跡しました。
格子光シート顕微鏡で得られた画像に、データ解析の精度を高めるための画像処理を行いました。分裂期細胞内部の紡錘体は、細胞膜から引っ張られることで任意の方向への回転が起こります。この回転は微小管の向きや伸長速度の測定に影響を与えるため、まず、画像上の中心体位置を同じ座標に固定することで補正を行いました(図2a)。さらに、画質の改善のため、大容量画像処理システムVCAT5を利用して、蛍光タンパク質の褪色や励起光の揺らぎによって生じる画像の輝度変化と、暗い背景部分の輝度のむらを調整(トップハット変換)し、EB1-GFPの微小なシグナルを強調しました(図2b,c)。これらの処理を施したデータを解析した結果、0.755秒間隔で連続撮影した合計56.625秒間の撮影から、細胞分裂の前半(前中期、中期)では1万を超えるEB1-GFPのシグナルと数千を超える微小管伸長軌跡を、後半(後期、終期)では、前半のおよそ3倍のシグナルを検出しました(図3)。
この膨大なデータを解析するため、幾何学的な数理計算処理を行うために新たに開発した解析プログラムを用い、複数の細胞からのデータの自動計算と集計、結果の表示の一連の処理を自動化しました。データ解析の結果、分裂装置を形成する微小管の伸長速度は細胞内の場所によって異なることが判明しました。主に中心体近傍から紡錘体の外側に向けて伸びる微小管の伸長は速く、紡錘体の内側に分布している微小管の伸長は遅い傾向にありました。さらに細胞分裂の後半になると、紡錘体の中間位置から伸長を開始する新たな微小管が多数生じ、このうち紡錘体中央部で向き合う微小管の多くが、中心体から離れた地点から伸長を開始していることが分かりました(図4)。
新たな微小管は非中心体性微小管である可能性が考えられましたが、中心体から伸びた既存の微小管の再伸長との区別ができないため、微小管伸長の方向から中心体性微小管と非中心体性微小管を見分けることを試みました。分裂装置の構造を70区画に分画し、各区画を通過する微小管の中心体軸に対する伸長角度を分析しました(図5)。中心体の周囲の微小管の伸長は、あらゆる角度をとることができます。一方、中心体から離れた地点では、中心体軸からの角度が大きすぎる微小管が中心体に由来するとは考えにくくなります。分析の結果、非中心体微小管が一定数存在するこが確認でき、また、この手法によりそれらの動態特性を分析できることが分かりました。これは、格子光シート顕微鏡による三次元画像データを、画像処理技術と数理処理技術の組み合わせにより自動解析することで、従来は観察できなかった現象が解析できたことを示します。
今後の期待
本研究では、格子光シート顕微鏡で得られる膨大な三次元画像データを自動解析する手法を開発しました。これによって、従来技術では捉えることができない細胞内微細構造の三次元動態の解析に、格子光シート顕微鏡が有効であることを実証しました。格子光シート顕微鏡を使った解析は、細胞分裂研究にとどまらず細胞動態解析のための中心的な技術として広く役立つと期待できます。
今後、染色体や細胞内膜構造など、より複雑な構造の動態を解析するには、より複雑なパターンとその動きを自動で正確に認識できる技術の確立、顕微鏡の改良によるシグナルの質の向上、画像処理技術による劣化シグナルの修復技術の向上が必要です。国際共同研究グループは、これらの計測技術の改良に加えて、より複雑で大量なデータから情報抽出を行うための自動解析技術を確立し、個体発生や、癌をはじめとする疾患メカニズムの解明を実現するため、より高度な細胞機能の解析を目指します。
原論文情報
- Norio Yamashita, Masahiko Morita, Wesley R. Legant, Bi-Chang Chen, Eric Betzig, Hideo Yokota, Yuko Mimori-Kiyosue, "Three-dimensional tracking of plus-tips by lattice light-sheet microscopy permits the quantification of microtubule growth trajectories within the mitotic apparatus", Journal of Biomedical Optics, Special Section on Protein Photonics for Imaging, Sensing, and Manipulation: Honoring Prof. Osamu Shimomura, a Pioneer of Photonics for Biomedical Research, doi: 10.1117/1.JBO.20.10.101206
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 生命動態情報研究グループ 細胞動態解析ユニット
ユニットリーダー 清末 優子(きよすえ ゆうこ)
光量子工学研究領域 エクストリームフォトニクス研究グループ 画像情報処理研究チーム
チームリーダー 横田 秀夫(よこた ひでお)
特別研究員 山下 典理男(やました のりお)
特別研究員 森田 正彦(もりた まさひこ)
お問い合わせ先
理化学研究所 ライフサイエンス技術基盤研究センター
広報・サイエンスコミュニケーション担当 山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.格子光シート顕微鏡
シート状の光によって試料を走査する新しいタイプの顕微鏡技術「光シート顕微鏡」のひとつで、従来法よりも高解像度化、高感度化を実現したもの。光シート顕微鏡法には、励起光を照射する領域が制限されるため、背景光が少なくS/Nの良い画像が得られるのと同時に、光毒性の低減、広い範囲をフルフレーム撮影するために高速化しやすい、といったアドバンテージがある。 - 2.微小管
細胞骨格の一つ。チューブリンと呼ばれる球状のタンパク質が線状に重合して形成される中空の管状フィラメント。 - 3.EB1-GFP融合タンパク質
清末らが2000年に報告した、伸長する微小管先端に結合する分子EB1にGFPを融合したキメラタンパク質。EB1は、微小管先端に短径25nm、長径100~500nmのコメット状に分布する。EB1-GFPの動きをライブイメージングすると微小管の伸長軌跡を知ることができるため、微小管ダイナミクスの解析ツールとして広く使用されている。EB1とはEnd-binging1の略。
下記サイトにて、EB1-GFPを用いた二次元ライブイメージングによる動画を閲覧できる。
Youtube:Timelapse movie of EB1 GFP in living fibroblasts(動画)
Youtube:Timelapse movie of EB1 GFP in a living myoblast cell(動画) - 4.大容量画像処理システムVCAT5
理研画像情報処理研究チームにおいて開発した多次元データ解析ソフトウェア。下記サイトからダウンロードできる。
VCAT5 - 5.HeLa細胞
1951年にヒトの子宮頸癌から分離され株化された培養細胞株。癌由来細胞であるため、正常なヒトの染色体数 (2n=46) よりも多い60本以上の染色体を持つ。光学顕微鏡による詳細な観察は難しいが、ヒトの病変から取り出された細胞等の観察にも適用できる技術開発のため、本研究では性能の評価材料として用いた。 - 6.非中心体性微小管
中心体は動物細胞に存在する細胞内小器官で、短い微小管から成る中心小体とその周辺に集積する周辺物質とから構成される。細胞内の微小管の多くは中心体から伸長すると考えられているが、中心体に依存せずに形成される微小管を非中心体性微小管と呼ぶ。中心体から離れた場所に分布する微小管重合開始促進能を有する分子を阻害すると細胞分裂に異常をきたすことから、非中心体性微小管も細胞分裂の制御に重要な役割を担っていると考えられている。
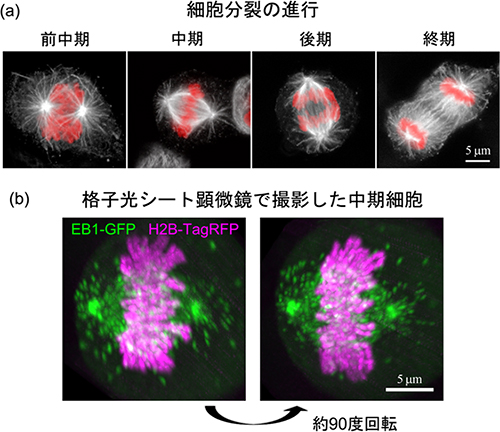
図1 細胞分裂像
(a)HeLa細胞の分裂期の各フェーズの典型的な形態。微小管の免疫染色(白)と染色体に局在するH2B-TagRFP(赤)の共焦点顕微鏡画像。
(b)格子光シート顕微鏡で撮影した細胞分裂中期の細胞の三次元画像例。垂直方向に約90度回転しても同様の解像度で観察することができる。EB1-GFPは緑、H2B-TagRFPはマゼンタで示す。
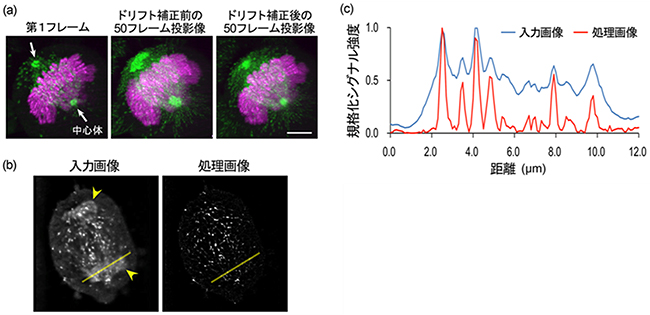
図2 高精度解析のための画質改善処理
(a) 紡錘体微小管の動きを補正するために中心体位置を測定して位置を固定化した(ドリフト補正)。
(b) 背景ノイズや赤色蛍光の漏れ込み(矢印)を低減してEB1-GFPからのシグナルの検出精度を向上するための三次元トップハット変換。
(c) (b)のライン上の輝度分布。トップハット変換後のスペクトルにはメリハリがみられることから、S/Nが向上したことがわかる。
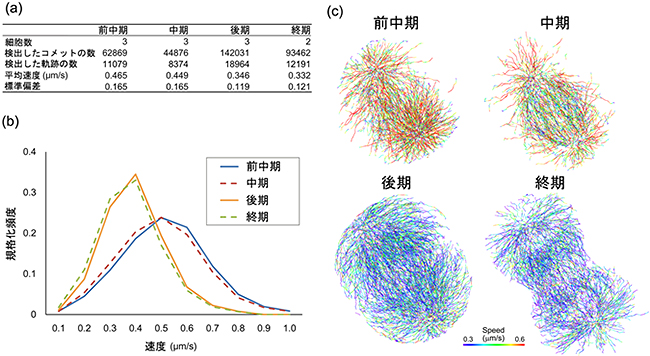
図3 EB1-GFPの動態の追跡結果
(a) 細胞分裂の異なるフェーズにある細胞のEB1-GFPの動態を追跡した結果の単純統計。検出したコメットと軌跡の数は、前期より後期のほうが多く、約3倍得られたことが分かる。
(b) 細胞分裂の異なるフェーズにおけるEB1-GFP移動速度の頻度分布。
(c) EB1-GFPによって可視化された微小管伸長の軌跡。
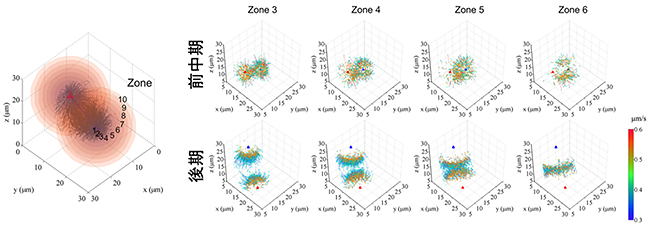
図4 細胞分裂前中期と分裂後期における微小管の伸長位置
細胞分裂期の前中期と後期にある細胞で、微小管伸長の開始地点によって軌跡をクラス分けし、3次元空間に表示した。分裂後期においては、分裂装置の中央付近で向き合う微小管の多くが中心体から離れた地点から伸長を開始していることが分かる。赤と青の三角は中心体位置を示す。
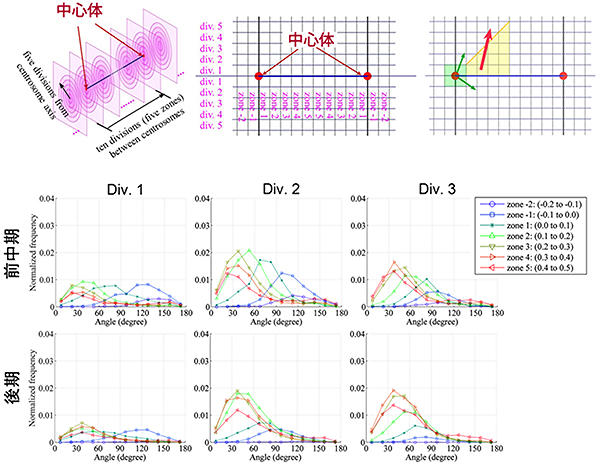
図5 微小管伸長の角度と非中心体性微小管の検出
(上図)分裂装置構造を、中心体軸と平行で半径が異なる円筒と中心体軸に垂直な平面とで70区画に分画した。微小管は直線的に伸びるため、右図の黄色のゾーンにおいて、もし、中心体軸に対する微小管の伸長角度が45度よりも大きい場合、その微小管は中心体を起点としているとは考えにくい。
(下図)各ゾーンを通過する微小管の中心体軸に対する角度。黄色の部分を通過する微小管の中に、伸長角度が45度を超えるものが存在している。これは、非中心体性微小管であると考えられる。
