要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センター微量シグナル制御技術開発特別ユニットの小嶋聡一特別ユニットリーダー(東京医科歯科大学大学院教授)、ラジャン・シュレスタ国際プログラム・アソシエイト(研究当時)(東京医科歯科大学大学院博士課程)と、今本細胞核機能研究室の今本尚子主任研究員、東京医科歯科大学生体材料工学研究所の影近弘之教授らの共同研究グループ※は、肝がんの再発を予防する世界初の薬として期待され、治験[1]が進められている「非環式レチノイド[2](一般名:ペレチノイン)」が、選択的に肝がん細胞の細胞死を引き起こす分子メカニズムを明らかにしました。
肝がん(肝臓がん)は、外科的切除などで治療した後も再発する確率が高く、極めて予後不良の疾患です。肝がん細胞を選択的に死滅させる非環式レチノイドは再発リスクを20%以下に抑える効果があり、肝がん再発予防薬として、現在、第Ⅲ相臨床試験[1]が行われています。小嶋特別ユニットリーダーらは2011年、非環式レチノイドが肝がん細胞に特異的に作用し、通常は細胞質に存在するタンパク質架橋酵素「トランスグルタミナーゼ(TG2)[3]」の細胞核への局在を引き起こし、細胞核で働く転写因子Sp1[4]を過度に架橋することを発見しました。その結果、がん細胞の生存に必須な増殖因子受容体遺伝子の発現が抑制され、肝がん細胞が死滅することを報告しました。しかし、非環式レチノイドがどのようなメカニズムで、TG2の核局在を誘導するのかは不明でした。 共同研究グループは、TG2を構成する4つのドメイン(領域)のうち、3番目のドメインに核内移行シグナル[5]、4番目のドメインに核外移行シグナル[5]が存在することを見出しました。さらに、非環式レチノイドはTG2に直接作用し、TG2と核内移行の運び屋タンパク質であるインポーチンとの複合体形成を約2倍に高めることで、がん細胞においてTG2の核局在を引き起こすことを発見しました。
正常細胞においてTG2が細胞核に局在することは、肝障害や神経変性疾患などの病態増悪の原因になることが知られています。今回の発見は、TG2の核局在を標的としたこれら疾患の新しい薬剤開発につながる可能性があります。
本研究は、日本学術振興会のCore-to-Coreプログラム「難治疾患に対する分子標的薬創製のための国際共同研究拠点の構築」(代表:東京医科歯科大学生体材料工学研究所 影近教授)および文部科学省科学研究費補助金の支援のもとに行われました。成果は、英国の科学雑誌『Cell Death & Disease』オンライン版(12月3日付け)に掲載されました。
※共同研究グループ
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門
イメージング応用研究グループ 微量シグナル制御技術開発特別ユニット
特別ユニットリーダー 小嶋 聡一(こじま そういち)
(東京医科歯科大学大学院医歯学総合研究科理研生体分子制御学分野連携教授)
国際プログラム・アソシエイト ラジャン・シュレスタ(Rajan Shrestha)
(研究当時)(東京医科歯科大学大学院博士課程)
国際プログラム・アソシエイト ロナク・シュレスタ(Ronak Shrestha)
今本細胞核機能研究室
主任研究員 今本 尚子(いまもと なおこ)
専任研究員 小瀬 真吾(こせ しんご)
東京医科歯科大学 生体材料工学研究所 薬化学分野
教授 影近 弘之(かげちか ひろゆき)
背景
日本の肝がん(肝臓がん)死亡者数は、2000年代前半をピークに緩やかに減少しつつありますが、いまだ年間の死亡者数が3万人を超えています。また世界的には肝がんは、全がん種の中で死因の第2位です注1)。肝がんは手術による外科的切除など初回の根治治療後も、二次性発がん[6]が年率(1年間の発がん率)約5%の割合で起こり、5年生存率は54.2~71.1%と極めて予後不良の疾患です。非環式レチノイド(一般名:ペレチノイン)は、国内第Ⅱ/Ⅲ相臨床試験において、C型肝炎ウイルス陽性肝細胞がんの根治術後の再発リスクを20%以下に減少させることが示されており注2)、世界初の肝がん再発予防薬として現在、第Ⅲ相臨床試験が行われています。
これまでの研究によって、非環式レチノイドは正常肝細胞には影響を与えず、肝がん細胞やその芽となる肝がん前駆細胞を選択的に死滅させることが分かっています。小嶋聡一特別ユニットリーダーらは2011年、非環式レチノイドが肝がん細胞に特異的に作用し、通常は細胞質に存在するタンパク質架橋酵素「トランスグルタミナーゼ(TG2)」の細胞核への局在を引き起こし、細胞核で働く転写因子Sp1を過度に架橋することを発見しました。その結果、がん細胞の生存に必須な増殖因子受容体遺伝子の発現が抑制され、肝がん細胞が死滅することを報告しています注3)。しかし、TG2がどのようなメカニズムで細胞核に局在し、非環式レチノイドがなぜその核局在を誘導できるのかは不明でした。
注1)日本肝臓学会「肝がん白書 平成27年版」
注2)Okita K1, Izumi N, Ikeda K, Osaki Y, Numata K, Ikeda M, Kokudo N, Imanaka K, Nishiguchi S, Kondo S, Nishigaki Y, Shiomi S, Ueshima K, Isoda N, Karino Y, Kudo M, Tanaka K, Kaneko S, Moriwaki H, Makuuchi M, Okusaka T, Hayashi N, Ohashi Y, Kumada H; Peretinoin Study Group., Survey of survival among patients with hepatitis C virus-related hepatocellular carcinoma treated with peretinoin, an acyclic retinoid, after the competion of a randomized, placebo-controlled trial., J Gastroenterol 2015 Jun;50(6):667-74. doi: 10.1007/s00535-014-0996-1
注3)Tatsukawa H, Sano T, Fukaya Y, Ishibashi N, Watanabe M, Okuno M et al. Dual induction of caspase 3- and transglutaminase-dependent apoptosis by acyclic retinoid in hepatocellular carcinoma cells. Mol Cancer 2011 Jan 9;10:4. doi: 10.1186/1476-4598-10-4.
研究手法と成果
TG2は687個のアミノ酸からなるタンパク質で、A、B、C、Dの4つのドメイン(領域)で構成されています(図1上)。共同研究グループはまず、どのドメインがTG2の核局在に必須であるかを調べるために、さまざまなドメインの組み合わせからなるTG2の変異タンパク質を遺伝子組換えにより作製しました。具体的には、TG2を構成する4つのドメインを1つずつ欠損させた変異遺伝子や、特定のドメインのみを発現する遺伝子を遺伝子工学的に作製しました。さらにこれらを、遺伝子組換えにより蛍光タンパク質(EGFP)の遺伝子と融合させることで、TG2の変異タンパク質の細胞内分布を蛍光顕微鏡で観察できるようにしました。
次に、肝がん細胞にTG2変異タンパク質を強制発現させた後に、非環式レチノイドで処理を行い、蛍光顕微鏡下で経時的に観察して、TG2が細胞質に局在するのにどのドメインが大切なのかを定量的に観察しました。その結果、1999年にフランスの研究チームがコンピュータ解析で予測したBドメインの259番目のアスパラギン酸から始まる5アミノ酸や、Dドメインの597番目のプロリンから始まる6アミノ酸は核内移行シグナルとしては重要ではなく、新たにCドメインの466番目のアラニンから始まる14アミノ酸(466AEKEETGMAMRIRV479)に核内移行シグナル(TG2 NLS)が存在することが分かりました。また、Dドメインの657番目から始まる8アミノ酸(657LHMGLHKL664)には核外移行シグナル(TG2 NES)が存在することから、これら2つのシグナルの働きにより、TG2が核と細胞質を行き来できることが示されました(図1下)。
非環式レチノイドによるTG2の核局在は、肝がん細胞を非環式レチノイドで処理を始めてから4~6時間後に起こり、TG2が核に局在した肝がん細胞は6~10時間後に死滅しました。一般的に、タンパク質が核内に移行する際にはインポーチンα/β[5]という運び屋タンパク質ファミリーと複合体を形成することが知られています。そこで、TG2とインポーチンとの結合を免疫沈降法[7]とPLA(Proximity Ligation Assay)法[8]で調べました。その結果、TG2がインポーチンα/βと複合体を形成し、非環式レチノイド処理をした肝がん細胞では、複合体の量が対照(エタノール処理)に比べて、約2倍に増えていることが分かりました(図2)。また、新たに同定したTG2の核内移行シグナルである14アミノ酸がペプチドとして大量に存在すると、複合体の形成が阻害されました。これは、核内移行シグナルペプチドがTG2と競合的にインポーチンα/βと結合することを示しており、TG2とインポーチンα/βの相互作用は核内移行シグナルを介していることが確認できました。
以上の結果により、非環式レチノイドは肝がん細胞内においてTG2に直接作用して、TG2と核内移行の運び屋であるインポーチンα/βとの複合体形成を促進し、肝がん細胞でのTG2の核局在を引き起こし、その結果として、転写因子Sp1の架橋不活性化を介するがん細胞死を引き起こすことを見出しました(図3)。
今後の期待
今回の成果は、TG2の核移行の制御が、抗がん剤の新たな標的となることを示唆します。TG2の核移行をより特異的に、より効率良く促進する作用を持つ分子の探索により、がん細胞を死滅させる抗がん剤の開発が期待できます。一方、正常な肝細胞では、過度のアルコール摂取や、メタボリック・シンドロームに起因する遊離脂肪酸の刺激によってTG2の核局在が起こり、正常肝細胞が死滅して肝障害が引き起こされることを、小嶋特別ユニットリーダーらが報告しています注4)この場合は、逆にTG2の核移行を阻害する薬の開発により、肝障害を抑えることができるようになると考えられます。
注4)2009年5月1日プレスリリース「タンパク質の架橋反応が細胞死を招き、アルコール性肝障害に」
原論文情報
- R Shrestha, H Tatsukawa, R Shrestha, N Ishibashi, T Matsuura, H Kagechika, S Kose, K Hitomi, N Imamoto and S Kojima, "Molecular mechanism by which acyclic retinoid induces nuclear localization of transglutaminase 2 in human hepatocellular carcinoma cells." Cell Death & Disease, doi:10.1038/cddis.2015.339
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 イメージング応用研究グループ 微量シグナル制御技術開発特別ユニット
特別ユニットリーダー 小嶋 聡一(こじま そういち)
(東京医科歯科大学大学院医歯学総合研究科理研生体分子制御学分野連携教授)
国際プログラム・アソシエイト ラジャン・シュレスタ(Rajan Shrestha)
(研究当時)(東京医科歯科大学大学院博士課程)
主任研究員研究室 今本細胞核機能研究室
主任研究員 今本 尚子(いまもと なおこ)
東京医科歯科大学 生体材料工学研究所 薬化学分野
教授 影近弘之(かげちか ひろゆき)
 小嶋 聡一
小嶋 聡一
 ラジャン・シュレスタ
ラジャン・シュレスタ
お問い合わせ先
理化学研究所 ライフサイエンス技術基盤研究センター
広報・サイエンスコミュニケーション担当 山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
東京医科歯科大学 広報部広報課
Tel: 03-5803-5833 / Fax: 03-5803-0272
Email: kouhou.adm[at]tmd.ac.jp ※[at]は@に置き換えてください。
補足説明
- 1.治験、Ⅲ相臨床試験
治験とは医薬品や医療機器の製造販売の承認申請をするために行われる臨床試験のこと。ヒトに対する作用を確認するために健常人を対象に行われる第Ⅰ相臨床試験(フェーズⅠ)から、承認のための最終試験として多数の患者を対象に行われる第Ⅲ相臨床試験(フェーズⅢ)など、段階を経て実施される。 - 2.非環式レチノイド
一般名:ペレチノイン、英語名:acyclic retinoid(略称:ACR)。興和株式会社が現在第Ⅲ相臨床試験を実施している世界初の肝がん再発化学予防候補薬(開発コード:NIK-333)。 - 3.トランスグルタミナーゼ(TG2)
タンパク質同士を共有結合させる架橋反応を触媒する酵素。タンパク質中のグルタミンを利用してペプチド結合を形成させるため、この名が付けられた。架橋反応にどのような生理学的な意味があるかは不明な点が多い。 - 4.転写因子Sp1
がん細胞を含むほとんどすべての細胞において、その細胞が生きていくために必要な増殖因子の受容体の遺伝子発現をつかさどる転写因子。転写因子とは、DNAに特異的に結合するタンパク質で、遺伝子の転写開始や調整に関与する。 - 5.核内移行シグナル、核外移行シグナル、インポーチンα/β
タンパク質が細胞質から細胞内に移行する際の荷札(タグ)となり、核内への運び屋タンパク質「インポーチンα/β」と複合体を形成する配列が核内移行シグナル。逆に、核内から細胞質に移行する際の荷札となり、核外への運び屋タンパク質エクスポーチンと複合体を形成する配列が核外移行シグナル。 - 6.二次性発がん
がんの治療を完全に終えた後に、再びがんが生じること。肝がんの場合、外科的切除あるいは経皮的ラジオ波凝固療法等での根治術後の再発率の高さが大きな問題となっている。 - 7.免疫沈降法
タンパク質Aとタンパク質Bが複合体を形成しているとき、タンパク質Aに対する抗体と、その抗体に標識した目印、例えばビオチンに結合するアビジンをつけたビーズとを反応させ、複合体-ビオチン-アビジンビーズを遠心機で沈降させ、沈降した複合体中にタンパク質Bが含まれていることをウエスタンブロットなどの方法で検出する分子相互作用検出法の1つ。 - 8.PLA(Proximity Ligation Assay)法
細胞や組織内におけるタンパク質間の相互作用を高感度に検出する方法。タンパク質Aとタンパク質Bのそれぞれに対する抗体を反応させた後、各抗体に対して異なる2種類のオリゴヌクレオチドで標識された二次抗体を結合させる。これらのオリゴヌクレオチドにリガーゼを作用させ、形成される環状ヌクレオチド構造を鋳型とした伸長反応によってシグナルを増幅して、タンパク質間の相互作用を生きた細胞の中で赤色蛍光のドットとして観察する方法。
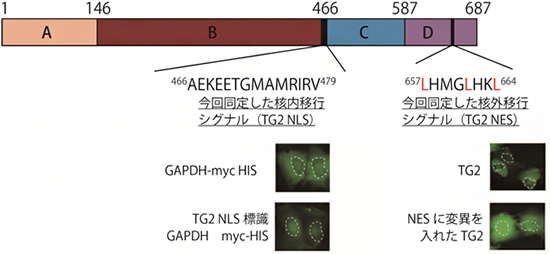
図1 トランスグルタミナーゼ(TG2)中の核内移行シグナルと核外移行シグナル
上図:TG2は、βサンドイッチ(Aドメイン)、酵素活性発現コア(Bドメイン)、βバレル1(Cドメイン)、βバレル2(Dドメイン)の4つのドメインからなる。その中で、Cドメインの466番目のアラニンから始まる14アミノ酸(466AEKEETGMAMRIRV479)に核内移行シグナル(TG2 NLS)が、Dドメインの657番目から始まる8アミノ酸(657LHMGLHKL664)に核外移行シグナル(TG2 NES)が存在する。
下画像:培養細胞で確認した核内シグナルと核外移行シグナルの作用。緑色はタンパク質の局在を、白の破線は細胞核の位置を示す。(左)細胞質に局在することが知られているグリセルアルデヒド三リン酸脱水素酵素(GAPDH)に、TG2の核内移行シグナル(TG2 NLS)配列を結合させると、細胞の核に移行するようになる(TG2 NLS標識GAPDH)。(右)Dドメインにある核外移行シグナルの3つのアミノ酸(L)をグルタミン(Q)に変異(657QHMGQHKQ664)させたTG2(NESに変異を入れたTG2)は、核内から核外に移行せずに核内にとどまる。
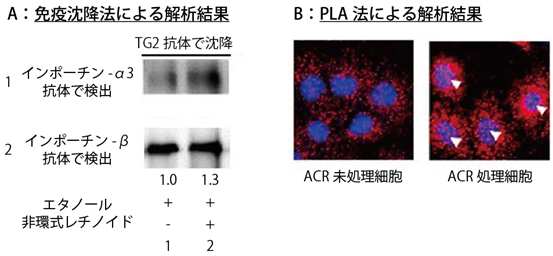
図2 肝がん細胞中でのトランスグルタミナーゼ(TG2)とインポーチンα/β複合体の形成
A)免疫沈降法による解析結果
TG2に対する抗体を用いて免疫沈降を行い、インポーチンαやインポーチンβ抗体で検出されるバンドが得られる。このことから、TG2とインポーチンα/βは複合体を形成していることが分かる。また、レーン1は対照(エタノール処理)で、レーン2が非環式レチノイド処理をしたものである。バンドの下の数値は、レーン1に対するレーン2のシグナルの相対的な強さを示す。対照に比べて非環式レチノイド処理をしたものは、得られるバンドが太くなり、複合体の量が増えていることが分かる。
B)PLA法による解析結果
PLA法によりTG2とインポーチンβが近くに存在し、相互作用している場所をピンク色のドットで検出すると、非環式レチノイド(ACR)未処理細胞に比べてACR処理細胞はドットの数が著しく増え、1部は細胞核で検出されている(白の△)。このことから生きている肝がん細胞で、TG2とインポーチンα/β複合体の形成が、ACR処理により増えることが示された。
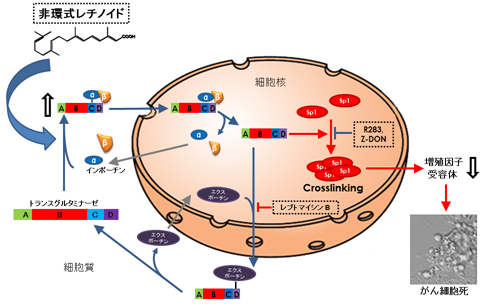
図3 非環式レチノイドが選択的に肝がん細胞の細胞死を引き起こす分子メカニズム
トランスグルタミナーゼ(TG2)は、Cドメインの466番目のアラニンから始まる14アミノ酸からなる核内移行シグナルを介して、核内への運び屋タンパク質インポーチンα/βと複合体を形成し、細胞核に移行する。一方、Dドメインの657番目から始まる8アミノ酸からなる核外移行シグナルは核外への運び屋タンパク質エクスポーチンと複合体を形成し、細胞質への移行を促進する。2つのシグナルの作用により、TG2は細胞質と細胞核の間を行き来している。非環式レチノイド(ACR)で処理すると、TG2とインポーチンα/β複合体の形成が促進され、TG2は細胞核に局在する。肝がん細胞の核に局在したTG2ゼは細胞増殖に関わる転写因子Sp1を架橋不活性化することで、がん細胞死を招く。
