要旨
理化学研究所(理研)横山構造生物学研究室の横山茂之上席研究員、柳沢達男研究員、理研環境資源科学研究センター生命分子解析ユニットの堂前直ユニットリーダーらの共同研究グループ※は、髄膜炎菌感染症の原因となる髄膜炎菌[1]の生存には、タンパク質「EF-P」が不可欠であることを発見しました。EF-Pは、アミノ酸「プロリン(Pro)」が連続する配列のために起こる遺伝情報翻訳の遅れを解消するタンパク質です。
髄膜炎菌感染症は、アフリカ、中東、欧米諸国で流行が続く致死率の高い病気で、治療には作用メカニズムの異なる多くの薬剤が必要です。EF-Pはほとんどの細菌に存在していますが、大腸菌、サルモネラ菌、枯草菌、緑膿菌などでは、菌の生存には不要なタンパク質として知られていました。
共同研究グループが髄膜炎菌由来のEF-Pを分子遺伝学的、生化学的手法により、詳しく調べた結果、髄膜炎菌の生存にEF-Pが不可欠であることが分かりました。
今後、EF-Pとそれに関連する酵素を標的として、ヒトの体内の常在細菌を殺すことなく、髄膜炎菌など特定の病原性細菌だけに効く、新規抗菌剤の開発につながると期待できます。
本研究は、文部科学省及び日本医療研究開発機構創薬等ライフサイエンス研究支援基盤事業(創薬等支援技術基盤プラットフォーム事業)、文部科学省ターゲットタンパク研究プログラム、科学研究費助成事業、公益財団法人倉田記念日立科学技術財団などの支援を受けて行われました。
成果は、米国の科学雑誌『PLOS ONE』(2月3日号)に掲載されました。
※共同研究グループ
理化学研究所
横山構造生物学研究室
上席研究員 横山 茂之(よこやま しげゆき)
研究員 柳沢 達男(やなぎさわ たつお)
環境資源科学研究センター
生命分子解析ユニット
ユニットリーダー 堂前 直(どうまえ なおし)
専任技師 鈴木 健裕(すずき たけひろ)
客員研究員 益田 晶子(ますだ あきこ)
国立感染症研究所 細菌第一部
主任研究員 高橋 英之(たかはし ひでゆき)
背景
髄膜炎菌感染症はアフリカ、中東、欧米諸国で流行が見られ感染すると敗血症[2]、髄膜炎[3]など重篤(じゅうとく)な症状になりやすく致死率の高い病気です。毎年30万人が感染し、抗生物質による治療が行われていますが、約3万人が死に至っています注1)。近年日本でも、予防として髄膜炎菌に対するワクチン接種が認可されました。しかし、薬剤耐性菌が出てくる可能性もあることから、より多くの作用メカニズムを持つ薬剤が必要です。
薬剤のターゲットとなるのは、多くの場合、細胞内のタンパク質です。タンパク質の合成は、メッセンジャーRNA(mRNA)が細胞質内にあるタンパク質合成装置のリボソームに結合することから始まります。細胞質には、20種類の天然アミノ酸が1個ずつ付加されたトランスファーRNA(tRNA)[4]があります。tRNAはリボソームに運ばれ、mRNAの情報に従って、アミノ酸同士が正確につなげられ、タンパク質が合成されます(翻訳)。
タンパク質の中には、「プロリン(Pro)」というアミノ酸が連続する配列「Pro-Pro配列」があります。例えば、大腸菌のタンパク質では、Pro-Pro配列が少なくとも1,400カ所以上含まれていることが知られています。この連続配列があると、タンパク質合成の際にリボソームの動きが遅れ、翻訳が止まりやすくなることが知られており、そのとき、リボソームの動きの遅れを防いで、翻訳を正常に保つ重要な役割を担っているのが、タンパク質「EF-P」です。EF-PはL字型構造をしており、すべての細菌に存在しています。
EF-Pが機能するには、EF-Pの先端にある特定のリシン残基(Lys34)にβリシンというアミノ酸が付加(βリシル化)されていることが重要であることを、2010年に横山茂之上席研究員、柳沢達男研究員らが明らかにしています注2)。ただし、βリシル化に関わる酵素は、大腸菌、サルモネラ菌、赤痢菌など細菌全体の3割弱にしか存在せず、残り7割以上の細菌には存在しません。一方、細菌全体の約1割の細菌由来のEF-Pでは、大腸菌EF-PのLys34に相当する位置にアルギニン残基(Arg32)が存在し、シュワネラ菌や緑膿菌ではArg32にラムノース[5]という単糖が付加(ラムノシル化)されていることが最近報告されました。しかし、Arg32を持つEF-Pが全て同じ修飾を受けるかどうかは不明でした。そこで共同研究グループは、EF-Pの翻訳後修飾に関わるβリシル化修飾酵素を持たない細菌のうち、髄膜炎菌感染症の原因菌である髄膜炎菌由来のArg32を持つEF-Pに着目し、解析を進めました。
EF-Pやその翻訳後修飾[6]に関わるタンパク質は、ヒトなどの真核生物には存在せず、細菌にのみ存在します。それらは、今まで調べられた細菌では生存に必須なタンパク質ではありませんでしたが、EF-Pやその翻訳後修飾に関わるタンパク質がないと生存できない病原菌が見出されれば、それらのタンパク質をターゲットとした抗菌剤は、ヒトやその体内に存在する腸内細菌、常在細菌に悪影響を及ぼさず、病原菌のみを退治できる可能性があり、創薬開発につながると考えられます。
注1)国立感染症研究所「髄膜炎感染症とは」
注2)2010年8月23日プレスリリース「核酸のように振る舞うタンパク質を明らかに」
研究手法と成果
共同研究グループはまず、髄膜炎菌を寒天培地100枚で培養し菌体を集めて粗抽出液にした後、3段階のカラムクロマトグラフィーという精製法により髄膜炎菌のEF-Pを精製しました。それを質量分析[7]などにより成分分析したところ、大腸菌のEF-PではLys34の位置に相当するArg32にラムノースが付加(ラムノシル化)されていることが分かりました(図1)。
次に、多くのPro-Pro配列を持つタンパク質の合成回復の系を解析しました。その結果、髄膜炎菌由来のEF-Pが活性を示すには、EF-Pへのラムノシル化修飾が重要であることが分かりました。EF-Pは、何も修飾されていないArg32では側鎖がリボソームの活性中心に届きませんが、ラムノシル化したArg32ではリボソームの活性中心付近にまで側鎖が届くようになります。このことから、EF-Pがラムノースの手を伸ばしてリボソームに作用し、タンパク質合成の遅れを解消していることが分かりました(図2、図3)。
さらに共同研究グループは、髄膜炎菌の染色体にある遺伝子を改変するなど、分子遺伝学的手法を用いた解析を進めました。当初、髄膜炎菌の染色体にあるEF-Pの遺伝子を欠損させることができなかったため、髄膜炎菌でEF-Pは必須であるという仮説を立てました。これを証明するために、EF-Pを「イソプロピル-β-チオガラクトピラノシド(IPTG)[8]」で誘導的に発現させるためのプラスミド[9]を髄膜炎菌に入れた後、染色体上にあるEF-Pの遺伝子を欠損させ、プラスミド上のEF-Pの遺伝子しか持っていない組換え髄膜炎菌を作製しました。そして、誘導物質(IPTG)のあり・なしの2条件下で髄膜炎菌の生育を調べました。
プラスミド上にあるEF-Pの遺伝子はIPTGで誘導されるプロモーター[10]から転写されるようになっています。IPTGがない場合は、ラクトースリプレッサー(リプレッサー)[11]がオペレーターDNA(mRNAの合成を制御する塩基配列)に結合し、プロモーターからの転写を抑えてしまい、その結果EF-Pが発現せず、髄膜炎菌は育成できませんでした。一方、IPTGがある場合は、IPTGがリプレッサーに結合しオペレーターDNAに結合できなくなります。そのため、プロモーターからの転写が起こるようになり、EF-Pが発現し、髄膜炎菌が育成しました。以上の実験により、EF-Pが髄膜炎菌の生存に不可欠であることが明らかになりました(図4)。
今後の期待
今回、EF-Pが髄膜炎菌の生存に必須であること、および、ラムノシル化修飾されたEF-Pは滞ったタンパク質合成を回復させることが分かりました。この知見を活用し、髄膜炎菌だけでなく、淋菌(りんきん)、百日咳菌、セパシア菌など病原性細菌由来のEF-P、およびその糖鎖修飾を阻害するような特定の細菌種に特化した薬剤を作ることが考えられます。それが実現すれば、生体維持に必要な常在細菌を殺さずに、特定の病原細菌だけの生存を抑えることができ、副作用のない有効な抗菌剤になる可能性があります。
今後、EF-Pおよびその翻訳後修飾に関わるタンパク質の構造と機能を解明することにより、創薬開発への貢献が期待できます。
原論文情報
- Tatsuo Yanagisawa, Hideyuki Takahashi, Takehiro Suzuki, Akiko Masuda, Naoshi Dohmae, Shigeyuki Yokoyama, "Neisseria meningitidis translation elongation factor P and its active-site arginine residue are essential for cell viability", PLOS ONE, doi: 10.1371/journal.pone.0147907
発表者
理化学研究所
上席研究員研究室 横山構造生物学研究室
上席研究員 横山 茂之(よこやま しげゆき)
研究員 柳沢 達男(やなぎさわ たつお)
 横山 茂之
横山 茂之
 柳沢 達男
柳沢 達男
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.髄膜炎菌
髄膜炎菌は淋菌と同じナイセリア属のグラム陰性双球菌で、大きさは0.6~0.8マイクロメートル(μm、1μmは1,000分の1mm)。ヒトのみを宿主とし、患者のみならず健常者の鼻咽頭からも分離される。くしゃみなどによる飛沫によりヒトからヒトへ伝播して、ときに大規模な流行を起こすことがある。気道粘膜上皮から侵入して血中に入り敗血症を起こし、さらには血管脳関門を通過して髄液にまで侵入することにより髄膜炎を起こす。髄膜炎の原因菌としてインフルエンザ菌や肺炎球菌が臨床的に注目されているが、流行性の髄膜炎を起こすのは髄膜炎菌のみであり、髄膜炎菌性髄膜炎は流行性髄膜炎とも呼ばれる。 - 2.敗血症
無菌である血液中に細菌が侵入、増殖し、全身に伝播することにより全身のいたるところで炎症が発生し、さまざまな障害を起こす症状。 - 3.髄膜炎
脳は髄膜という膜に包まれている。髄膜の中は髄液で満たされており、脳は髄液中に浮いている形になっている。髄液は血液脳関門(のうかんもん)と呼ばれる非常に密閉度の高いフィルターによって血液とつながっており、栄養分を血液から髄液へと運び、脳へ供給している。通常、血液脳関門を細菌が通過することはあり得ないが、何らかの原因で髄膜炎菌が血液脳関門をくぐり抜けて髄液中へ侵入し、増殖すると髄液中で炎症が起こり、脳が圧迫されて障害が起こる、いわゆる「髄膜炎」が発症する。 - 4.トランスファーRNA(tRNA)
メッセンジャーRNA(mRNA)の塩基配列であるアデニン(A)、グアニン(G)、シトシン(C)、ウラシル(U)は、翻訳の過程で3つが組(コドン)となって1つのアミノ酸を指定する。DNAの塩基配列であるA、G、C、チミン(T)の情報と、アミノ酸とを対応付けるアダプター分子がtRNAである。 - 5.ラムノース
天然に存在するデオキシ糖の1種である(単糖)。L-マンノースの6位のヒドロキシ基が水素原子に置き換わった構造を持ち、メチルペントース、あるいはデオキシヘキソースに分類される。D体、L体のエナンチオマー、α体、β体のアノマーが知られ、天然にはL体がみられる。 - 6.翻訳後修飾
タンパク質は生合成された後、リン酸化、糖鎖付加、脂質付加、メチル化、アセチル化、ユビキチン化などの修飾を受ける。これらの翻訳後修飾によってタンパク質の機能や活性が調節されている。 - 7.質量分析
原子や分子などを何らかの方法で気体状のイオンにして、そのイオンの質量を分析することにより、原子や分子の種類を推定する手法。イオンの検出量から、原子や分子の含有量を調べることができる。 - 8.イソプロピル-β-チオガラクトピラノシド(IPTG)
アロラクトース(2糖)の類似体として用いられ、ラクトースオペロン(ラクトース分解)の転写を誘導する。アロラクトースとは異なり、生体内では分解されないためラクトースオペロンは常に誘導された状態となる。IPTGはラクトースリプレッサーに結合してその働きを阻害し、ラクトースを分解するβ-ガラクトシダーゼ( lacZ)の発現を誘導する。 - 9.プラスミド
大腸菌などの細菌や酵母の核外に存在し、細胞分裂によって娘細胞へ引き継がれる染色体以外のDNAの総称。環状の2本鎖構造をとり、染色体のDNAとは独立して複製を行う。細菌の接合を起こすもの(Fプラスミドなど)、抗生物質に対する耐性を宿主にもたらすものなどがある。遺伝子工学分野においては、遺伝子組換えの際に多く用いられる。 - 10.プロモーター
転写の開始に関与する遺伝子の上流領域を指す。RNAポリメラーゼがプロモーターを認識、結合して転写が始まる。 - 11.ラクトースリプレッサー
ラクトースオペロン(ラクトース分解)においてプロモーターの下流すぐにあるオペレーターDNA(lacO)に結合し、RNAポリメラーゼ(酵素)がDNAをほどくのを防ぎ、プロモーターからの転写を抑える制御因子である。
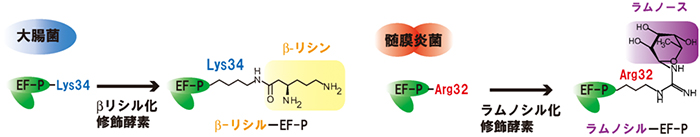
図1 EF-Pの翻訳後修飾(βリシル化とラムノシル化)
(左)大腸菌の場合、EF-PのLys34にβリシンが付加(βリシル化)されて活性型となる。(右)髄膜炎菌の場合、大腸菌ではLys34の位置にあるArg32にラムノースが付加(ラムノシル化)されて活性型となる。
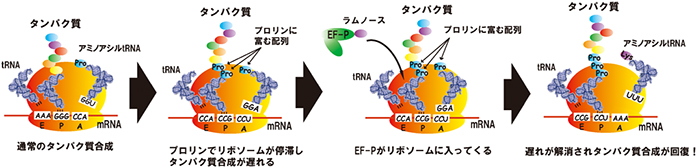
図2 髄膜炎菌由来のEF-Pタンパク質の機能
タンパク質合成装置のリボソーム上で、mRNAの情報に従ってtRNAが運んできたアミノ酸同士がつなげられ、タンパク質が合成される(翻訳)が、多くのPro-Pro配列があると、リボソームの動きが停滞しタンパク質合成が遅れる。しかし、先端にラムノースが付加ラムノシル化したEF-Pがリボソームに入り、活性中心付近に手を伸ばすことによって遅れが解消され、タンパク質合成が回復する。
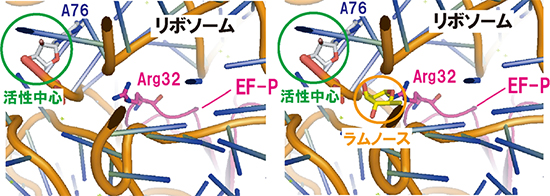
図3 リボソーム活性中心とラムノシル化したEF-Pのモデル
修飾されていないArg32の側鎖は、リボソームの活性中心(A76)から遠いが(左)、ラムノースが付加(ラムノシル化)されたArg32は活性中心付近にラムノースの手が届く(右)。
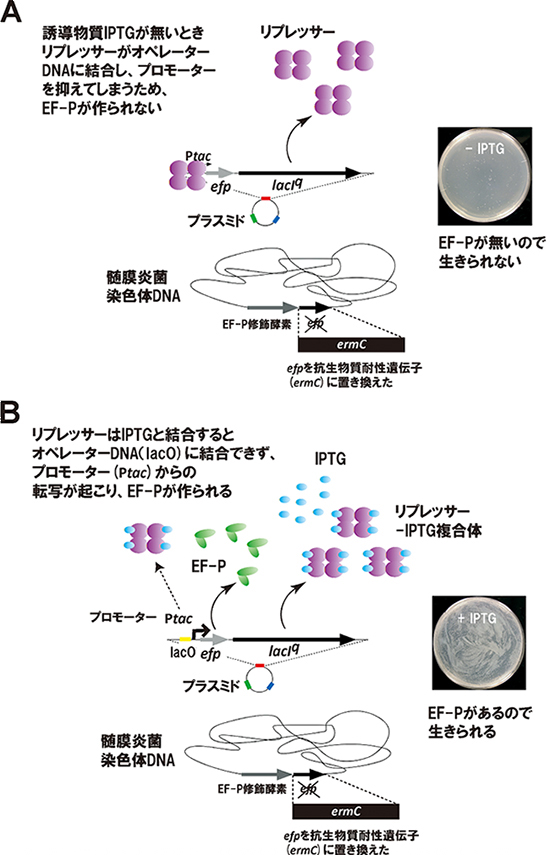
図4 EF-Pが髄膜炎菌の生存に不可欠であることを証明した
EF-Pが誘導物質(IPTG)に依存して発現するように組み替えた髄膜炎菌の模式図。誘導物質の有無の2条件で、寒天培地で生育させた。
A:誘導物質がないとき、リプレッサー(lacIq遺伝子産物)がオペレーターDNA(lacO、mRNAの合成を制御する塩基配列)に結合し、プロモーター(Ptac)からの転写を抑える。そのため、EF-Pは発現せず、髄膜炎菌は育成できない。
B:誘導物質があるとき、誘導物質がリプレッサーに結合しオペレーターDNAに結合できなくなる。そのため、プロモーターからの転写が起こり、EF-Pが発現し髄膜炎菌が育成できる。
