2016年3月11日
理化学研究所
金沢大学
科学技術振興機構
シナプスの微細構造まで鮮明に
-高屈折率の改良型透明化液で深部超解像イメージングを実現-
要旨
理化学研究所(理研)多細胞システム形成研究センター感覚神経回路形成研究チームの今井猛チームリーダー、柯孟岑(カ・モウシン)国際特別研究員、金沢大学新学術創成研究機構の佐藤純教授らの共同研究グループ※は、生体組織深部の超解像イメージングを可能とする新しい組織透明化試薬「SeeDB2(シーディービーツー)」を開発しました。SeeDB2と超解像顕微鏡[1]を用いて、マウスやショウジョウバエの脳の蛍光イメージングを行い、シナプス[2]の微細な3次元構造を大規模に解析できることを示しました。
神経細胞はシナプスと呼ばれる構造で互いに連絡し合い、脳内に神経回路を構成しています。しかし、その構造は1マイクロメートル(μm、1μmは1,000分の1mm)以下と小さく、従来の光学顕微鏡でその詳細を観察することは困難でした。また、近年、光の回折限界[3]を超える分解能[4]を持つ超解像顕微鏡が開発されていますが、厚みのある生体試料深部を観察することは困難でした。
2013年に感覚神経回路形成研究チームは、ハチミツや果物などに多く含まれるフルクトース(果糖)を用いて生体組織の微細構造を保ったまま透明化する試薬「SeeDB(シーディービー)[5]」を開発しました。今回、共同研究グループはX線造影剤の成分として知られる「イオヘキソール[6]」を用いることでこの方法を改良し、高解像イメージングのための透明化試薬SeeDB2を開発しました。SeeDB2は屈折率が高く、顕微鏡観察に用いるカバーガラスおよび対物レンズ浸液として用いるオイルの屈折率と完全に一致するため、深部でも画像がぼけることなく鮮明に観察できます。実際にSeeDB2で処理したマウス脳、ショウジョウバエ脳、卵母細胞、培養細胞など、さまざまな試料を共焦点顕微鏡[7]や超解像顕微鏡を用いて観察したところ、100μmを超える深部まで高解像画像が得られました。また、従来観察することが難しかったシナプスの微細構造を大規模かつ3次元的に捉え、定量解析することに成功しました。
本手法は、脳の神経回路図をシナプスレベルで解明する研究に役立つと期待できます。また、多くの精神疾患は神経細胞のシナプス構造に異常があるといわれており、将来的には精神疾患の病態やメカニズムの解明にも貢献すると期待できます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業、日本学術振興会(JSPS)科学研究費補助金、三菱財団の助成によって行われました。成果は、米国のオンライン科学雑誌『Cell Reports』(3月22日号)に掲載されるのに先立ち、オンライン先行掲載(3月10日付け:日本時間3月11日)されます。
※共同研究グループ
理化学研究所 多細胞システム形成研究センター
感覚神経回路形成チーム
チームリーダー 今井 猛(いまい たけし)
国際特別研究員 柯 孟岑(カ・モウシン)
研究員 藤本 聡志(ふじもと さとし)
染色体分配研究チーム
チームリーダー 北島 智也(きたじま ともや)
研究員 吉田 周平(よしだ しゅうへい)
金沢大学
新学術創成研究機構、JST CREST
教授 佐藤 純(さとう まこと)
医薬保健研究域附属脳・肝インターフェースメディシン研究センター
博士研究員 中井 康弘(なかい やすひろ)
技術補佐員 高山 理恵(たかやま りえ)
背景
私たちの脳機能を担う神経回路は膨大な数の神経細胞が、シナプスと呼ばれる構造を介して互いに連絡し合うことで成り立っています。そのため神経回路の機能や精神疾患の病態を理解するには、シナプスレベルで神経回路の構造を解析することが重要です。さらに、神経細胞は3次元的に張り巡らされているため、3次元的にシナプスの分布を調べる必要があります。
2013年に感覚神経回路形成チームは、ハチミツや果物などに多く含まれるフルクトース(果糖)を用いて生体組織の微細な構造を保ったまま透明化する試薬「SeeDB(シーディービー)」を開発しました注1)。SeeDBで試料を処理すると、光学顕微鏡で神経回路を3次元的に観察できます。しかし、光学顕微鏡には回折限界という制約があり、水平方向で光の波長の約半分に相当する約200ナノメートル(nm、1nmは100万分の1mm)、深さ方向で約500nmより細かい構造は観察できませんでした。シナプスの大きさは100nm~1μm程度であるため、従来の光学顕微鏡でその詳細を明らかにすることは困難でした。このため、シナプスの構造を3次元的に解析するには、分解能の高い電子顕微鏡[8]を用いて連続切断面を観察することが唯一の手段でした。しかし膨大な労力を必要とすること、さらにタンパク質の分布を調べることが困難であるなどの課題がありました。
近年、光学顕微鏡の回折限界を克服するため、さまざまな超解像顕微鏡が開発されており、2014年にノーベル化学賞の対象となりました。しかし、超解像顕微鏡などの高解像顕微鏡は球面収差[9]の影響を極めて受けやすいため、深部では像がぼけてしまい、サンプル表面でしか理想的な像を得ることができません。そこで、共同研究グループは、SeeDBと同様に微細な構造を保ちながら組織を透明にし、かつ高解像顕微鏡観察において深部でも球面収差を生じない光学特性を持つ透明化試薬の開発を試みました。
注1)2013年6月24日プレスリリース「簡便で生体試料にやさしい組織透明化試薬「SeeDB」を開発」
研究手法と成果
超解像顕微鏡をはじめとする高解像顕微鏡観察では、対物レンズ浸液の屈折率が高いほど分解能を高くできることが知られています。このため、通常は高屈折率のオイル(屈折率1.52)を浸液として用い、同じ屈折率のカバーガラスでサンプルを封入します。この条件では、光がサンプル表面においては1点に収束して高解像画像が得られます。しかし、従来の封入剤[10]や透明化試薬は屈折率が対物レンズ浸液のオイルより低かったため(1.33~1.46)、観察部位をサンプル深部に移動すると、屈折のために光が1点に収束しなくなり、像がぼけてしまいます(球面収差)(図1上段)。そこで共同研究グループは、球面収差を極限まで減らした組織深部の高解像イメージングを実現するため、SeeDBを改良し、浸液のオイルやカバーガラスと完全に同じ屈折率を持った新たな透明化試薬の開発を試みました。
共同研究グループは、従来CTスキャンなどでX線造影剤として医療目的で用いられてきた「イオヘキソール」という化合物に着目しました。イオヘキソールは水に良く溶け、屈折率が極めて高いという特徴があります。また、安全かつ安定な物質で、生体組織にほとんどダメージを与えないという特長もあります。イオヘキソールを基に、透明度が高く、生体の微細構造や蛍光タンパク質の安定性に優れた条件を決め、「SeeDB2(シーディービーツー)」を開発しました。
深部における分解能を計測したところ、SeeDB2では球面収差が極めて少ないために100μm以上の深さにおいても分解能が一定に保たれていました。例えば、STED顕微鏡[1]では深部でも水平方向で50nmの分解能が得られました。また、Airyscan(エアリースキャン)顕微鏡[1]では、水平方向の分解能で150nm、深部方向で350nmの分解能が得られました。一方、従来の透明化試薬やマウント剤を用いた場合には、深部ではこのような高い分解能が得られませんでした。同様の結果はマウス大脳皮質の試料でも確認されました(図1)。
続いて、マウス脳やショウジョウバエ脳でSeeDB2を試したところ、共焦点顕微鏡や種々の超解像顕微鏡で、深部まで高分解能の鮮明な画像を取得できました。例えば、神経細胞の樹状突起にはスパイン(樹状突起スパイン[11])と呼ばれるトゲ状の突起が多数ありますが、マウス脳ではこの樹状突起スパインや軸索末端の微細な構造まで詳細に観察できました(図2)。また、分解能が高いために神経細胞を密に蛍光標識しても軸索や樹状突起の1本1本を容易に区別することができました(図2)。ショウジョウバエ脳では、全脳高解像イメージングを行うことができました(図4左)。
さらに、SeeDB2を用いることでマウス卵母細胞における微小管の微細構造を観察できたほか、培養細胞の細胞小器官構造もより鮮明に観察できました。このようにSeeDB2は神経回路の研究だけではなく、細胞生物学の研究においても極めて有効であることが分かりました。
次に共同研究グループは、SeeDB2と超解像顕微鏡を用いてマウス大脳皮質の神経細胞におけるシナプスの定量解析を試みました。特に、学習や発達過程においてシナプス形成に重要な役割を果たすことが知られているNMDA型グルタミン酸受容体(NMDAR)に着目し、NMDARを欠損させた神経細胞のシナプス分布を解析しました。NMDAR欠損神経細胞の形態については既に低解像度での解析が行われていますが、本研究では超解像顕微鏡を用いることでより詳細かつ大規模にシナプス分布に関するデータを得ようと考えました。大脳皮質神経細胞において、興奮性シナプス[2]はスパイン先端にのみ局在することが知られていますが、抑制性シナプス[2]は樹状突起の幹の部分と一部のスパイン先端に局在するため、形態だけからは同定できません。そこで、抑制性シナプスのマーカータンパク質「ゲフィリン(Gephyrin)」に黄色蛍光タンパク質「EYFP」を融合したタンパク質を標識として用い、抑制性シナプスの局在の変化についても同時に詳細に解析しました。NMDAR欠損神経細胞におけるスパインの分布と形状について調べた結果、スパインの密度や長さは変わりませんが、野生型(対照群)と比べて先端が極端に大きなキノコ型のスパインの割合が増えていることが定量的に示されました。また、これらの大きなスパインには抑制性シナプスが多く局在していることが新たに分かりました。このように、大規模な3次元の超解像解析を行うと、一見すると分かりにくいシナプス構造の違いを定量的かつ鮮明に捉えることが可能です(図3)。
さらに共同研究グループは、SeeDB2と超解像顕微鏡を用いてショウジョウバエの視覚中枢の1つであるメダラ神経節の神経回路の解析を行いました。メダラ神経節は既に電子顕微鏡を用いた神経回路解析が行われていましたが、非常に労力を必要とすることから、その全体像の定量的解析は十分に行われていませんでした。メダラ神経節において動体視力に関わるMi1と呼ばれる神経細胞に着目して軸索末端構造を定量的に解析した結果、軸索終末がヘアピン状かつ三つ叉の構造を取り、その向きが各神経細胞ごとに異なっていることが分かり、これまでに知られていなかった形態学的な特徴を明らかにすることができました(図4右)。
今後の期待
SeeDB2と超解像顕微鏡を組み合わせると、シナプスの3次元構造のような立体的で微細な構造を極めて簡便かつ大規模に解析できます。この方法を用いることで私たちの脳機能の基盤や発達過程を明らかにする研究がより加速すると期待できます。
また、精神疾患の多くはシナプスの形成異常によって生じることが判明してきており、SeeDB2と超解像顕微鏡を組み合わせた研究は、精神疾患の病態や発症機構の解明においても効果を発揮するものと期待できます。
原論文情報
- Meng-Tsen Ke, Yasuhiro Nakai, Satoshi Fujimoto, Rie Takayama, Shuhei Yoshida, Tomoya S. Kitajima, Makoto Sato, and Takeshi Imai., "Super-resolution mapping of neuronal circuitry with an index optimized clearing agent", Cell Reports(3月22日号表紙に掲載予定、3月10日付オンライン先行掲載), doi: 10.1016/j.celrep.2016.02.057
発表者
理化学研究所
多細胞システム形成研究センター 感覚神経回路形成研究チーム
チームリーダー 今井 猛(いまい たけし)
国際特別研究員 柯 孟岑(カ・モウシン)
金沢大学新学術創成研究機構
教授 佐藤 純(さとう まこと)
 今井 猛
今井 猛
 柯 孟岑
柯 孟岑
 佐藤 純
佐藤 純
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
金沢大学総務部広報室広報係
Tel: 076-264-5024 / Fax: 076-234-4015
koho[at]adm.kanazawa-u.ac.jp(※[at]は@に置き換えてください。)
科学技術振興機構 広報課
Tel: 03-5214-8404 / Fax: 03-5214-8432
jstkoho[at]jst.go.jp(※[at]は@に置き換えてください。)
JST事業に関すること
科学技術振興機構 戦略研究推進部
川口 哲(かわぐち てつ)
Tel: 03-3512-3525 / Fax: 03-3222-2064
presto[at]jst.go.jp(※[at]は@に置き換えてください。)
補足説明
- 1.超解像顕微鏡、STED顕微鏡、Airyscan(エアリースキャン)顕微鏡
超解像顕微鏡とは、従来の光学顕微鏡とは異なる原理を用いて、回折限界によって決まる分解能の限界(約200nm)よりも細かい対象物を解像できる光学顕微鏡。超解像顕微鏡の1つであるSTED顕微鏡を開発したステファン・ヘル博士、PALM顕微鏡を開発したエリック・ベツィグ博士らは、2014年のノーベル化学賞を受賞した。STED顕微鏡では、通常の励起光レーザーに加え、焦点を取り囲むようにドーナツ型のレーザー光(STED光)を照射して蛍光を抑制し、結果的に蛍光を生じるスポットを回折限界よりも小さくする。これにより数10nm程度の分解能を実現できる。Airyscan顕微鏡はCarl Zeiss社が開発した超解像顕微鏡。通常の共焦点顕微鏡に特殊な検出器を備え、画像演算を組み合わせることで従来の1.7倍の解像度を実現する。比較的弱い励起光で超解像画像が得られるため、サンプルに対する褪色ダメージが少ないという特長がある。 - 2.シナプス、興奮性シナプス、抑制性シナプス
神経細胞は、軸索(出力を行う)や樹状突起(入力を行う)を伸ばして互いに連絡し合うことで神経回路を構成している( 図3左)。神経細胞が連絡する接続点のことをシナプスという。シナプスには興奮性の神経伝達物質をやりとりする興奮性シナプスと、抑制性の神経伝達をやりとりする抑制性シナプスとがある。これらによって、相手方の神経細胞を活性化させたり抑制したりしている。シナプスの機能は、脳発達や学習を含むあらゆる脳回路機能において重要である。 - 3.回折限界
光は波としての性質をもつため、理論上、波長の半分程度より細かい対象物を解像することができない。これを回折限界という。 - 4.分解能
2点の対象物を見分けることができる最小距離として定義される。アッベ(Abbe)やレイリー(Rayleigh)によって定式化されており、可視光(波長400~700nm)においては、最も高性能な光学顕微鏡を用いた場合でも、分解能の限界は200nm程度とされる。 - 5.SeeDB
2013年に理研の感覚神経回路形成研究チームが開発した組織透明化試薬。糖の1種フルクトースを主成分とし、簡便で組織形態にやさしいという特長を持つ。 - 6.イオヘキソール
ヨウ素を含む芳香族化合物で、もともとCTスキャンで血管などの構造を可視化するために副作用の少ないX線造影剤として開発された。ヨウ素がX線をよく吸収するためである。ヨード造影剤とも呼ばれ、オムニパークという商品名で使われている。今回の研究では、ヨウ素が屈折率を上げる効果を持つことに着目し、全く異なる目的に用いている。 - 7.共焦点顕微鏡
小さく絞ったレーザー光を走査して画像を取得するレーザー走査型蛍光顕微鏡の1種。蛍光シグナルを検出する際、集光面にピンホールを設置して焦点面由来の光だけを検出するため、深さ方向にもレーザー走査することで3次元的な蛍光像を得ることができる。 - 8.電子顕微鏡
通常の光学顕微鏡では可視光を試料に当てて観察するのに対し、電子顕微鏡では電子線を当てて観察する。電子線の波長は可視光よりもはるかに短いため、理論上0.1nm程度の分解能が得られる。標本の表面しか観察できないため、3次元情報を得るためには連続切断面の画像を連続的に取得して3次元構成する必要がある。 - 9.球面収差
レーザー顕微鏡では通常励起光が焦点で1点に収束するように設計されているが、サンプルの屈折率が設計値と異なる場合、光が1点に収束しなくなる(ぼける)。これを球面収差という。球面収差があると、像がぼけて分解能が悪くなるため、顕微鏡の設計上の解像力を発揮できない。 - 10.封入剤
顕微鏡観察の際に試料を浸す液体のこと。マウント剤とも呼ばれる。蛍光イメージングにおいてはグリセリン(屈折率1.46)と水(1.33)を含む溶媒がよく用いられる。 - 11.樹状突起スパイン
神経細胞の樹状突起につくられる数μm以下のトゲ状の小突起( 図3左)。区画化されており、樹状突起スパインの先端には興奮性シナプスがつくられる。抑制性シナプスも一部は樹状突起スパインに存在する。区画化されていることから樹状突起における情報処理や記憶形成の単位であると考えられている。さまざまな精神疾患において樹状突起スパインの形態異常がみられることが知られている。
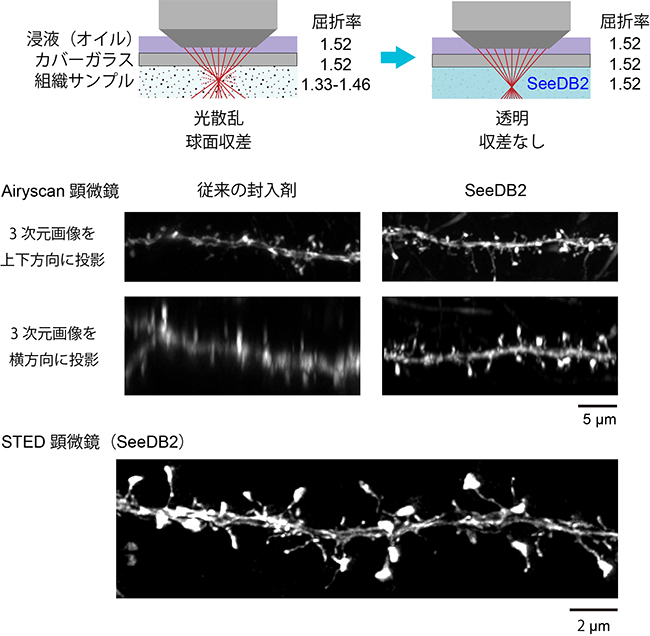
図1 SeeDB2の原理と2種類の超解像顕微鏡で撮影したマウス脳の樹状突起スパイン
上段:顕微鏡の分解能は対物レンズ浸液の屈折率が高いほど良いとされており、通常は屈折率1.52のオイルを用いる。カバーガラスの屈折率も同程度(1.52)である。設計上、試料の表面では光が1点に収束して高い解像度を得られるが、組織の深部を観察しようとすると、組織中の屈折率が最適値よりも低い(1.33-1.46)ために屈折して、光が焦点に収束しなくなる(球面収差)。しかしSeeDB2を用いると、試料の光散乱を除くとともに屈折率を最適値1.52に合わせることができるため、深部でも高解像度が得られる。
中段:蛍光タンパク質「EYFP」で標識したマウス大脳皮質5層錐体細胞の樹状突起スパインをAiryscan顕微鏡で撮影した画像。横の太い軸が樹状突起でそこから外に出ている小さなトゲ状の構造がスパインである。画像は深さ25~30μmで取得した。
下段:マウス大脳皮質5層錐体細胞のスパインをSTED顕微鏡で撮影した画像。画像(上下方向の投影像)は深さ約60μmで取得した。
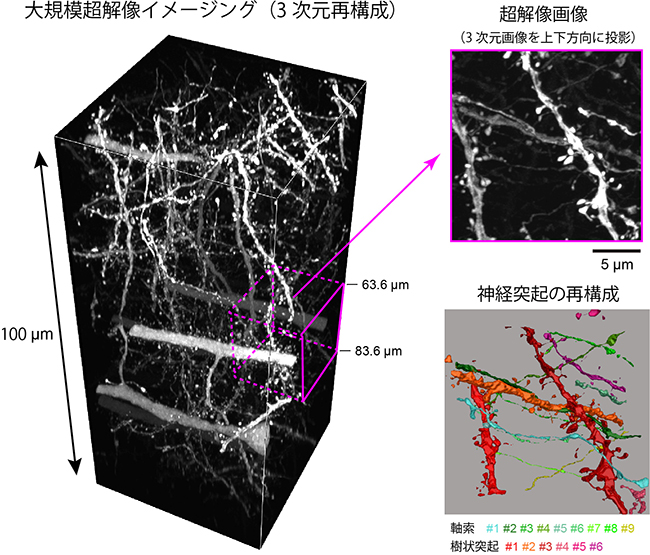
図2 マウス脳の神経回路の大規模超解像イメージング
Airyscan顕微鏡を用いるとSeeDB2処理した脳サンプルを用いて大規模超解像イメージングを行うことができる。右上は、深さ63.6~83.6μmの20μm四方の超解像蛍光画像で、右下は、同部分の全標識神経細胞を異なる色で再構成したものである。
YouTube:SeeDB2で透明化したマウス大脳皮質の超解像イメージング(動画)
YouTube:SeeDB2と超解像顕微鏡を用いた神経回路の再構成(動画)
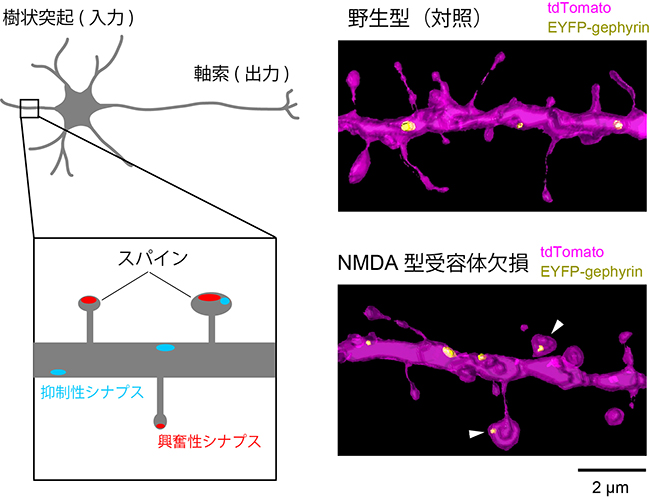
図3 マウス脳のNMDA型グルタミン酸受容体(NMDAR)欠損神経細胞のシナプス形態の解析
神経細胞の軸索・樹状突起とスパイン(トゲ状の突起構造)、興奮性・抑制性シナプスの模式図(左)。Airyscan顕微鏡を用い、樹状突起全体の超解像画像を取得し、シナプスの形態異常を調べることができる(右)。マウスの大脳皮質5層錐体細胞において、赤色の蛍光タンパク質「tdTomato」で神経細胞全体を標識し、EYFP-gephyrin(黄色)で抑制性シナプスを標識した。NMDAR欠損神経細胞(右下)では野生型(右上)に比べて、大きなスパインが増えていることが定量解析から判明した。また、NMDAR欠損神経細胞では抑制性シナプスの大きなスパインへの局在が増えていることも判明した(矢頭)。
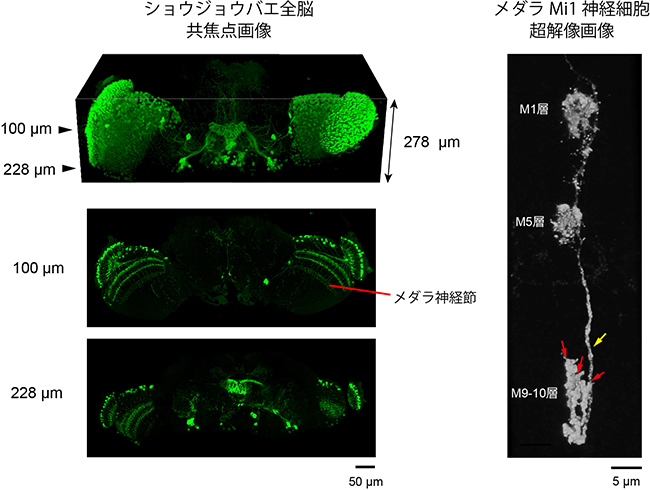
図4 SeeDB2を用いたショウジョウバエ脳のイメージング
左:一部の神経細胞を蛍光タンパク質(GFP)で標識したショウジョウバエ脳をSeeDB2(グリセリン浸対物レンズに最適化したSeeDB2の改変版)で透明化し、全脳イメージングしたもの。上段が3次元再構成で、下が各水平断面における蛍光画像。全脳にわたって同じ解像度で神経回路を可視化できる。
右:視覚中枢のメダラ神経節にあるMi1と呼ばれる神経細胞に着目して、SeeDB2を用いた超解像イメージングを行ったもの(深さ約100μm)。メダラ神経節は層構造をとるが、Mi1はM1層とM5層で樹状突起を形成し、M9-10層に軸索を伸ばす(黄色矢印)。軸索終末の形が特徴的で、ヘアピン状の構造を取り、その先端は3つ又に分かれている(赤矢印)。3つ又部分でシナプスを形成する。
YouTube:SeeDB2で透明化したショウジョウバエ全脳の高解像イメージング(動画)
