要旨
理化学研究所(理研)横山構造生物学研究室の横山茂之上席研究員らと、ライフサイエンス技術基盤研究センタータンパク質機能・構造研究チームの篠田雄大研究員、白水美香子チームリーダー、染谷友美上級研究員らの共同研究グループ※は、無細胞タンパク質合成法[1]を応用して、高品質の膜タンパク質を高収率で生産できる新しい技術を開発しました。
膜タンパク質は、細胞膜に埋め込まれた状態で存在し、細胞内外の情報や物質の交換など重要な機能を果たしており、創薬研究の重要な標的でもあります。一方で、従来の膜タンパク質合成法では、細胞での発現と細胞膜からの可溶化[2]が容易ではなく、それを乗り越える技術開発が求められていました。
今回、共同研究グループは、膜タンパク質が細胞で合成され、細胞膜に埋め込まれながら立体構造を形成する過程を、細胞を使わず、試験管内でほぼ再現する新しい技術を開発しました。この膜タンパク質の無細胞合成法では、膜タンパク質は、リボソーム(タンパク質を合成する場である細胞小器官)によって合成されると、脂質と相互作用しつつ、立体構造を形成して、その周りに細胞膜と同じような脂質で構成される脂質二重膜構造の小さな膜断片を形成します。膜タンパク質は、膜断片に組み込まれた状態のままであるため、さまざまな単離・精製法が適用可能で、高純度の精製標品を得ることができます。
これにより、これまでは立体構造や活性を犠牲にしなくては調製できなかった難しい膜タンパク質を、界面活性剤[3]による可溶化という過程を一度も経ることなく、正常な状態で高純度に大量調製し、さらに、結晶化、薬剤との結合の解析などが可能になり、抗体を作る免疫原としても用いることができます。
この技術により、膜タンパク質機能の本質的な理解や、新しい低分子医薬や抗体医薬の創出などに幅広く貢献でき、膜タンパク質の基礎研究から産業応用までパラダイムシフトを引き起こすと期待できます。
本研究は、文部科学省「ターゲットタンパク研究プログラム」(2007~2011年度)、文部科学省および日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業(創薬等支援技術基盤プラットフォーム事業)」(2012~2016年度)、日本学術振興会(JSPS)「科学研究費助成事業(科研費)」(2013~2016年度)の支援により行われました。
成果は、英国のオンライン科学雑誌『Scientific Reports』(7月28日付け)に掲載されました。
※共同研究グループ
理化学研究所
横山構造生物学研究室
上席研究員 横山 茂之(よこやま しげゆき)
研究員 寺田 貴帆(てらだ たかほ)
ライフサイエンス技術基盤研究センター 構造・合成生物学部門
タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(しろうず みかこ)
上級研究員 染谷 友美(そめや ともみ)
研究員 篠田 雄大(しのだ たけひろ)
研究員 大沢 登(おおさわ のぼる)
技師 新屋(野村)直子(しんや のむら なおこ)
技師 伊東 夏織(いとう かおり)
技師 石塚(桂)芳子(いしづか かつら よしこ)
放射光科学総合研究センター
利用システム開発研究部門生命系放射光利用システム開発ユニット
ユニットリーダー 山本 雅貴(やまもと まさき)
専任技師 平田 邦生(ひらた くにお)
専任技師 河野 能顕(かわの よしあき)
脳科学総合研究センター 神経膜機能研究チーム
チームリーダー 平林 義雄(ひらばやし よしお)
基礎科学特別研究員 石橋 洋平(いしばし ようへい)
東京大学大学院薬学研究科 機能病態学教室
教授 富田 泰輔(とみた たいすけ)
背景
細胞膜は脂質二重膜で構成されており、膜タンパク質は脂質二重膜に埋め込まれた状態で存在しています。膜タンパク質は、細胞外のシグナルを捕える受容体、細胞膜を介して物質の出入を担うチャネル、細胞同士の結合に関わる接着分子など、生命活動に重要な役割を果たしています。また、しばしば病気に関わっており、多くの医薬品が膜タンパク質を標的分子としています。
膜タンパク質を人工的に作るには、大腸菌で発現させる方法が広く用いられています。しかし、この方法には限界があり、特にヒト由来の膜タンパク質の場合、真核細胞(酵母、昆虫・哺乳動物細胞など)で発現させて調製する方法の方がよいと考えられてきました。ただし、細胞における細胞膜への組み込みの許容量が限られる、細胞に対して毒性が起きるなどの問題は残ります。
また、膜タンパク質を細胞で発現し、細胞膜に埋め込まれた状態の膜タンパク質を取り出すには、界面活性剤を用いて脂質二重膜から溶出する(可溶化)ことが必要です。膜タンパク質の周りは、その膜タンパク質に適した特徴的脂質で取り囲まれています。膜タンパク質のうち、受容体、チャネルなどは、特徴的脂質を含む「膜ドメイン」という領域に集まっており、しばしば、界面活性剤では可溶化が難しい「界面活性剤抵抗性膜ドメイン(DRM)[4]」に取り込まれます。このため、脂質二重膜から可溶化できないことが珍しくありません。強力な界面活性剤を使うと可溶化することはできますが、膜タンパク質の立体構造が壊れ機能を失います。反対に穏やかな界面活性剤を使うと、膜タンパク質がほとんど可溶化されず、ごくわずかしか脂質二重膜から抽出できません。通常は、多くの界面活性剤をスクリーニングして、比較的効率よく可溶化でき、かつ、比較的立体構造を破壊しないという妥協点を探しますが、質的・量的な問題を全て解決するのは困難でした。
これまで横山上席研究員らの研究グループは、細胞を使わない膜タンパク質合成方法の開発に挑んできました。2005年には界面活性剤を無細胞タンパク質合成時に加える方法を開発し、世界に先駆けて、リガンド結合活性を示すGタンパク質共役型受容体(GPCR)[5]を合成しました。続いて2009年、構造生物学への応用を目指して改良を進め、無細胞タンパク質合成反応に、脂質と界面活性剤を加え、微生物由来の膜タンパク質をリポソーム[6]に組み込んだ状態で調製することに成功し注1)、2011年には、その方法で調製した単細胞真核生物由来の膜タンパク質の結晶構造解析にも成功しました注2)。
注1)2009年9月16日プレスリリース「無細胞タンパク質合成系を活用した膜タンパク質合成方法の開発に成功」
注2)2011年6月29日プレスリリース「調製困難な膜タンパク質の1つ「ARII」の結晶構造を決定」
研究手法と成果
共同研究グループは、脂質と界面活性剤を混ぜてできた混合ミセルを無細胞タンパク質合成系に加えました。時間が経つと、混合ミセル中の脂質と界面活性剤は再配置します。脂質は脂質二重膜の構造をとった膜断片を形成していき、その過程で、膜断片に膜タンパク質が組み込まれます。混合ミセルの界面活性剤は、その脂質二重膜断片縁端の疎水性部分に結合して、水溶液との境界を覆うことによって、膜断片を安定化させていきます。界面活性剤で安定化された脂質二重膜断片は、界面活性剤濃度が高いと、小さな膜断片になり、界面活性剤濃度が低いと、大きな膜断片になります。界面活性剤の濃度をさらに低くしていくと、大きな膜断片が融合して、最後はリポソームを形成します。大きな膜断片やリポソームは遠心分離で沈殿するのに対し、小さい膜断片は沈殿せず、可溶性になります。
この違いから、膜タンパク質を大きな膜断片(あるいはリポソーム)に組み込む方法を、「P-MF(沈殿性膜断片)法」、一方、小さな膜断片に組み込む方法を、「S-MF(可溶性膜断片)法」と名付けました(図1)。
P-MF法、S-MF法で合成された膜タンパク質は、適切な脂質分子種を選びつつ相互作用し、フォールディング(折り畳み)しながら脂質二重膜環境に組み込まれていきます。膜タンパク質を取り巻いた脂質二重膜部分は、その周辺部を界面活性剤が覆った状態に維持されるため、正しい構造が形成・保持されます。この過程は、細胞での膜タンパク質合成と脂質二重膜への組み込みをうまく再現しています。このため、脂質を用いない、あるいは、界面活性剤ミセルを用いる無細胞合成法に比べて、細胞で発現させたものに近い自然な状態の膜タンパク質が得られます。さらに、あらかじめ完成した脂質二重膜やリポソームを加えて無細胞合成する方法と比べて、高い組み込み効率が得られ、また、正しい構造形成も行われると考えられます。
ここまでは、P-MF法、S-MF法で共通ですが、両者で決定的に異なるのは、S-MF法は界面活性剤による可溶化を行わずに試料を高純度に精製できるため、正しい立体構造や結合脂質を維持したままで、さまざまな用途に適用できることです。また、P-MF法に比べて、高純度で大量の生産に向いています。S-MF法では、可溶性の小さな膜断片は、そのまま、カラムクロマトグラフィー等の通常の精製方法を用いた精製ができ、高品質を維持したまま、高純度の膜タンパク質が得られます。
一方、P-MF法は、目的の膜タンパク質を精製するために界面活性剤を用いて可溶化する必要があります。この可溶化によって、せっかく形成した立体構造や高い活性が損なわれる可能性があります。また、天然の細胞膜の状態を再現すればするほど、可溶化効率が悪くなります。
このように、これまでは立体構造や活性を大幅に犠牲にしなくては調製できなかったような難しい膜タンパク質を、S-MF法により本来あるべき状態で高純度に大量調製することが可能になりました。さらに、界面活性剤による可溶化という過程を一度も経ること無く、結晶化、薬剤との結合の解析などが可能になります。
そこで、無細胞タンパク質合成法を使ってヒト膜タンパク質の合成を行いました。ヒト膜タンパク質として、GPCR、チャネル、膜内在性酵素、細胞接着因子などの合成を行ったところ、1mlの無細胞タンパク質合成反応液あたり、0.1〜1.0mg、平均で0.3mgに及ぶ大量のヒト膜タンパク質を合成できることが確認できました。
次に、これまで大量生産が困難だったクローディン-4[7]と呼ばれるヒト膜タンパク質の合成をS-MF法で行いました。すると、1mlの無細胞合成反応液あたり0.38mgのクローディン-4を調製することができました。続いて、得られたクローディン-4の生理活性を検証するため、クローディン-4結合分子として知られるウェルシュ菌由来の毒素断片C-CPE[8]に対する結合能を調べました。その結果、S-MF法で合成したクローディン-4は、細胞由来のクローディン-4と同様に毒素断片に対して非常に高い結合能を示し、安定な複合体を形成しました。この複合体を結晶化し、SPring-8[9]でX線を照射して、結晶構造解析可能な回折データが得られることを実証できました(図2)。
これは、S-MF法で生産した膜タンパク質が、機能的にも構造的にも細胞由来の膜タンパク質の性質を再現しており、かつ均質で高収量に調製できたことを示します。またS-MF法は、クローディン-4以外のクローディンファミリーでも同様に合成できることが確かめられました。
さらに、膜内在性酵素であるグルコシルセラミド合成酵素GlcT[10]について、細胞での発現では不可能であった、活性を示す試料を大量に調製することに成功しました。同じく膜内在性酵素であるγセクレターゼ複合体[11]の活性本体プレセニリンなど他のヒト膜タンパク質に適用できることを確かめました。このように、膜タンパク質の複合体の調製にも、S-MF法が有効であると考えられます。これに対してP-MF法では、遠心分離の操作のみで膜タンパク質を回収するので、精製する必要のない、初期の合成条件の検討や機能解析に適しています。
今後の期待
今回開発したS-MF法により、自然な状態の膜タンパク質を高純度で大量かつ迅速に得ることが可能になりました。膜タンパク質の立体構造情報は、膜タンパク質の機能を立体構造のレベルで深く理解するために重要であり、これまで試料調製が不可能だった重要な膜タンパク質の構造生物学に道を拓く成果です。またS-MF法で得られる膜タンパク質は、抗体医薬[12]の開発に必要なモノクローナル抗体などを得るための免疫原としての利用や、低分子医薬のスクリーニングにも応用できるため、膜タンパク質に対する新薬の開発が加速すると期待できます。
本研究成果により、膜タンパク質機能の本質的な理解や、新しい低分子医薬、抗体医薬の創出などに幅広く貢献でき、膜タンパク質の基礎研究から産業応用までパラダイムシフトを引き起こす基盤技術となることが期待できます。
原論文情報
- Takehiro Shinoda, Naoko Shinya, Kaori Ito, Yoshiko Ishizuka-Katsura, Noboru Ohsawa, Takaho Terada, Kunio Hirata, Yoshiaki Kawano, Masaki Yamamoto, Taisuke Tomita, Yohei Ishibashi, Yoshio Hirabayashi, Tomomi Kimura-Someya, Mikako Shirouzu & Shigeyuki Yokoyama, "Cell-free methods to produce structurally intact mammalian membrane proteins", Scientific Reports, doi: 10.1038/srep30442
発表者
理化学研究所
上席研究員研究室 横山構造生物学研究室
上席研究員 横山 茂之 (よこやま しげゆき)
ライフサイエンス技術基盤研究センター 構造・合成生物学部門 構造生物学グループ タンパク質機能・構造研究チーム
研究員 篠田 雄大 (しのだ たけひろ)
チームリーダー 白水 美香子 (しろうず みかこ)
上級研究員 染谷 友美 (そめや ともみ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
日本医療研究開発機構(AMED)戦略推進部医薬品研究課
Tel: 03-6870-2219
20-DDLSG-16 [at] amed.go.jp(※[at]は@に置き換えてください。)
補足説明
- 1.無細胞タンパク質合成法
生命体に依存しない人工的なシステムで、細胞からタンパク質合成に必要な成分一式を抽出し、これに目的のタンパク質をコードする遺伝子を合成装置が読み取れる形にして添加し、タンパク質を合成する技術。外部からさまざまな因子を加えることが容易であり、反応条件の変更や最適化も容易であるなど、多くの優れた特徴をもつ。理研では、膜タンパク質などの合成の難しいタンパク質を対象に開発を進めている。 - 2.可溶化
タンパク質の結晶構造解析では、精製カラムなどにより目的タンパク質を100%近い高純度にまで精製する必要がある。生細胞発現システムや本研究のP-MF法で発現させた膜タンパク質の場合、カラム精製の前に、界面活性剤を用いて脂質二重膜内に包埋された膜タンパク質を溶かし出す工程「可溶化」が必要となる。この工程で、溶かし出されたものを「可溶性画分」、溶かされなかったものを「不溶性画分」と呼び、超遠心分離(一般的には遠心加速度100,000 gでの分離)により、それぞれ遠心上清と沈殿として分離することができる。なお、この遠心分離により変性・凝集したタンパク質も不溶性画分として除去される。 - 3.界面活性剤
分子内に水になじみやすい部分と、油になじみやすい部分を持つ物質の総称。洗剤の主成分であり、油を水中に溶かす働きがある。水に溶けている界面活性剤の疎水性原子団は水に排除される傾向にあり、疎水性の高い脂質と水との界面に配向吸着するとその表面に配列するため、表面張力が低下する。この性質を利用し、脂質を水中に分散させることができる。同様に、疎水性の高い膜タンパク質を水中で可溶化状態に保つこともできる。 - 4.界面活性剤抵抗性膜ドメイン
膜ドメインとは、細胞膜上で局所的に特定の脂質が集積したものである。細胞膜上の膜タンパク質の局在化に関わっており、細胞内外のシグナル伝達を効率的に行う場などとして重要な役割を果たしている。このうち、コレステロールやスフィンゴミエリンなどが集積した膜ドメインは、一般的に膜タンパク質精製で用いるような緩和な界面活性剤では溶かすことができないことから、界面活性剤抵抗性膜ドメインと呼ばれる。 - 5.Gタンパク質共役型受容体(GPCR)
細胞膜受容体は細胞膜上に存在し、細胞の外から内へ情報を伝達する役割を果たしている。このうち、GPCRは1,000種類以上存在するといわれ、7回膜貫通型という特徴的な形をしている。現在市販されている薬の半数以上は、GPCRに作用するといわれている。GPCRはさまざまな疾患に関与しているため、創薬ターゲットとして非常に重要である。 - 6.リポソーム
細胞膜や生体膜の主成分であるリン脂質を用いて、溶液中で作製できる脂質二重膜のカプセル。 - 7.クローディン-4
クローディンは、細胞間接着の一種で密着結合を担う4回膜貫通型膜タンパク質。1998年、京都大学の月田承一郎博士らにより発見された。ヒトでは27種類のファミリー分子が報告されており、それぞれさまざまな疾病の治療標的分子などとして研究が進んでいる。中でも、クローディン-4は腫瘍細胞で高発現することから、がん治療における抗体医薬などの標的分子として期待されている。 - 8.ウェルシュ菌由来の毒素断片C-CPE
ウェルシュ菌が産生するエンテロトキシン( Clostridium perfringensenterotoxin)は、腸管粘膜に発現したクローディン-4を標的とし、食中毒性の下痢を引き起こす。エンテロトキシンから細胞障害活性を持つN末端側を除いたC末端側断片(C-CPE)は、ヒトクローディン-4に対して非常に高い親和性を持つことから、C-CPEを利用し、クローディン-4を標的とした創薬などへの応用が期待されている。 - 9.SPring-8
兵庫県播磨科学公園都市にある世界最高の放射光を生み出す、理研の大型放射光施設。その運転管理と利用者支援は高輝度光科学研究センター(JASRI)が行っている。SPring-8の名前はSuper Photon ring-8 GeVに由来する。 - 10.グルコシルセラミド合成酵素GlcT
3回膜貫通型膜タンパク質で、UDP-グルコースとセラミドからグルコシルセラミドを合成する転移酵素。ガングリオシドなど糖脂質の合成経路の最初の工程を担っている。共同研究者の平林博士らにより世界で初めてクローニングされた。 - 11.γセクレターゼ複合体
アルツハイマー型認知症の発症に関わるアミロイドβを産生する膜内プロテアーゼ複合体。四つの膜タンパク質(プレセニリン、Pen-2、Aph-1aL、ニカストリン)から構成される。プレセニリンは酵素活性を担うサブユニット。 - 12.抗体医薬
抗体を利用した分子標的医薬。代表例として、一部の乳がんで発現の上昇がみられる細胞増殖因子受容体を標的とする、抗体医薬トラスツズマブ(商標名:ハーセプチン)が知られている。目的物に特異的に結合する抗体を得るためには、高純度で本来の構造を維持したタンパク質を免疫原として使用することが重要である。
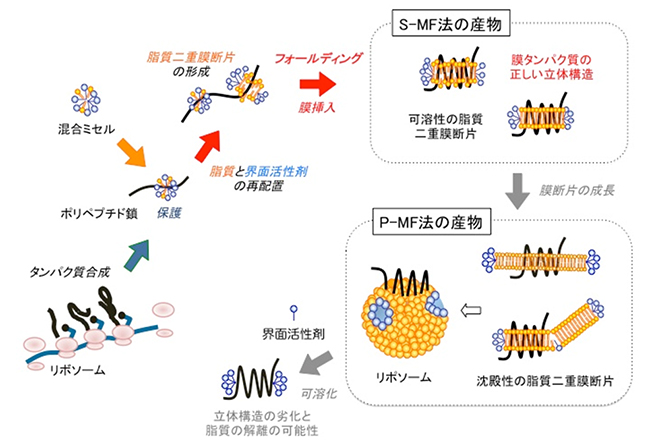
図1 無細胞膜タンパク質合成P-MF(沈殿性膜断片)法、S-MF(可溶性膜断片)法の概念図
脂質(橙色)と界面活性剤(青色)の混合ミセルを加えて開始された無細胞タンパク質合成において、メッセンジャーRNAの情報に従ってリボソームにより、ポリペプチド鎖(黒色)が合成される。それとともに、混合ミセルが、ポリペプチド鎖の疎水性領域に結合し、凝集しないように保護する。ポリペプチド鎖が伸びるのに伴い、脂質と界面活性剤が再配置し、脂質二重膜構造を形成する。ここで、本来の細胞に存在する脂質を加えておくと、膜タンパク質自身で、適切な脂質を選択して、所定の位置に結合する。これを繰り返し、全ての膜貫通領域が脂質二重膜断片に組み込まれ、膜タンパク質として、正しくフォールディングする(折り畳む)。
可溶性の小さな脂質二重膜断片の段階で断片の成長を止めるとS-MF法の産物が得られ、精製や結晶化のステップに進むことができる。さらに膜断片を成長させると、P-MF法の産物が得られる。最終的には、膜タンパク質を組み込んだリポソーム(プロテオリポソーム)が形成される。このプロテオリポソームは、機能解析や発現状態の確認などに用いられるが、膜タンパク質を精製する場合は、界面活性剤を用いて可溶化する必要がある。その際に界面活性作用の強い界面活性剤を用いた場合、立体構造の劣化と脂質の解離が心配される。

図2 ヒト由来クローディン−4のS-MF法による大量調製と結晶化
左図:大量調製されたクローディン-4のゲルろ過分析を表すグラフ。クローディン-4は、ウェルシュ菌由来の毒素断片(C-CPE)と安定な複合体を形成し、ゲルろ過分析で、対称性が高く、鋭いピークとして溶出された。
右写真:クローディン-4の結晶化。結晶の顕微鏡写真とクローディン-4結晶によるX線回折像。
