2016年8月18日
理化学研究所
日本医療研究開発機構
ヒトiPS-NKT細胞の抗腫瘍効果を生体内で示すことに成功
-iPSを用いたがん免疫療法の実現へ大きく前進-
要旨
理化学研究所(理研)統合生命医科学研究センター免疫細胞治療研究チームの藤井眞一郎チームリーダー、伊豫田智典研究員と免疫器官形成研究グループの古関明彦グループディレクター、山田大輔研究員らの研究グループは、iPS細胞技術で作製したヒトナチュラルキラーT(NKT)細胞[1]の抗腫瘍効果をマウスの生体内で示すことに成功しました。
研究グループはこれまでにNKT細胞の発見から、NKT細胞の活性化機構、細胞機能について研究を進めてきました。特に、NKT細胞の活性化後、多量に産生されるインターフェロンガンマ(IFN-γ)[2]により、自然免疫系ナチュラルキラー(NK)細胞および獲得免疫系キラーT細胞[3]を共に増殖促進・活性化させること(アジュバント作用[4])で抗腫瘍効果を発揮することを見出していました。
この原理を用いてNKT細胞標的がん治療の臨床試験が行われ、長期平均生存期間の延長効果が認められました。さらに、抗がん機能を持つNKT細胞のみを増殖させることができれば、抗がん効果をより効果的に最大化できると考えられます。
そこで、研究グループはiPS細胞技術を利用して、ヒトNKT細胞から抗がん効果の高いiPS細胞由来のNKT細胞(iPS-NKT細胞)を安定的かつ大量に作製する方法を確立しました。そして、ヒトiPS-NKT細胞が試験管内で6種類のヒト腫瘍細胞株全てを強力に殺傷できることが分かりました。また、マウスの生体内でも直接的に腫瘍細胞の増殖を抑制する効果があることが示されました。さらに、マウス生体内でアジュバント効果を発揮することも明らかになりました。今後、iPS-NKT細胞は効果の高いがん免疫療法に進展すると期待できます。
本研究は、国立研究開発法人科学技術振興機構(JST)の「CREST 人工多能性幹細胞(iPS細胞) 作製・制御等の医療基盤技術」及び、国立研究開発法人日本医療開発研究機構(AMED)の「再生医療実現拠点ネットワークプログラム(平成26年度までJST所管)」の支援を受けて行われました。本成果は、米国の科学雑誌『Stem Cells』に掲載されるのに先立ち、オンライン版(8月1日付け)に掲載されました。
背景
近年、がん免疫療法は、外科的手術療法、化学療法(抗がん剤、ホルモン投与)、放射線療法に続く治療法として注目を集めています。ナチュラルキラーT(NKT)細胞は、ナチュラルキラー(NK)細胞マーカーとT細胞抗原受容体(TCR)の両方を発現するT細胞の仲間です。NKT細胞は、活性化されると多量にインターフェロンガンマ(IFN-γ)を産生し、IFN-γが自然免疫系NK細胞および獲得免疫系キラーT細胞を共に増殖促進・活性化させること(アジュバント作用)で抗腫瘍効果を発揮することが知られています。
この原理を用いてNKT細胞標的がん免疫療法の開発が進められ、2001年から千葉大学において、進行性肺がん、上顎がん、頭頸部がん、口腔内黒色腫などに対してNKT細胞標的がん治療の臨床試験が行われました。その結果、特にIFN-γ応答がよい症例で、長期平均生存期間の延長効果が認められました。したがって、さらに機能的なNKT細胞を補充することができれば、この治療法の抗がん効果をより有効にすることができると考えられます。しかし、NKT細胞はヒト末梢血中に0.01%~0.1%しか存在せず、それらを試験管内で治療に必要な細胞数まで増殖させることは、現在の技術では困難なことが予想されました。
そこで、研究グループはiPS細胞技術を利用して、NKT細胞への分化能力を持つ多能性幹細胞を無制限に増殖させた後、治療に十分な質と量のNKT細胞を分化誘導し供給できるのではないかと考えました。
研究手法と成果
研究グループは、ヒト末梢血もしくはさい帯血由来のNKT細胞を前培養し、外来遺伝子がゲノムに挿入されない方法により、ヒトNKT細胞からiPS細胞を作製しました(NKT-iPS細胞)。さらに、NKT-iPS細胞からのNKT細胞への分化誘導は、ヒトiPS細胞からT細胞を分化誘導する方法注1)を改良することで成功しました(図1)。
次に、iPS-NKT細胞の機能を試験管内で調べました。リガンド刺激に応答してアジュバント効果に重要な働きをするIFN-γの産生能を調べたところ、元のNKT細胞よりも大きな産生能があることが分かりました(図2)。
また、直接的に腫瘍細胞を殺傷できるかを調べたところ、元のNKT細胞以上に6種類の腫瘍細胞株全てを、強力に殺傷できることが分かりました(図3)。
続いて、iPS-NKT細胞が生体内でも機能的であるかどうかを調べました。免疫不全マウスに腫瘍細胞株(K562)を移植すると、対照(非投与)群では移植した腫瘍細胞が増殖するのに対して、iPS-NKT細胞を投与した群では腫瘍細胞はほとんど増殖しないことが分かりました(図4)。これにより、iPS-NKT細胞は生体内で直接的に腫瘍細胞の増殖を抑制する機能があることが示されました。
最後に、iPS-NKT細胞が生体内でNK細胞を活性化するかどうかを調べました。免疫不全マウスに①末梢血(さい帯血)単核球だけを移植する群、②さらに樹状細胞と糖脂質も合わせて移植する群、③それらに加えてiPS-NKT細胞も移植する群を用意し、18時間後にNK細胞が免疫不全マウス生体内で活性化されているかを調べたところ、③のiPS-NKT細胞も移植した群が最もNK細胞が活性化されていることが分かりました。つまり、iPS-NKT細胞によりNK細胞が活性化されたことが示されました(図5)。したがって、iPS-NKT細胞は生体内でアジュバント効果を発揮することが分かりました。
注1)Vizcardo R,et al. Cell stem cell. 2013
今後の期待
本研究により、試験管内およびマウスの生体内でもiPS-NKT細胞が抗腫瘍細胞能を発揮することを示すことができました。特に、iPS-NKT細胞は元のNKT細胞と同じようにアジュバント効果を発揮するだけでなく、直接的な腫瘍細胞殺傷能も持っていることが分かったので、効果の高いがん免疫療法になると期待できます。
今後、免疫系ヒト化マウスを使って、自家・他家移植を模倣した実験系でHLA不適合での効果を解析していく予定です。他家移植でも十分な抗腫瘍効果が望めるようであれば、より多くの患者へiPS-NKT細胞を使ったがん免疫療法が実施できると考えられます。臨床応用に向けては、臨床グレードの細胞作製体制の確立、および非臨床試験による安全性確認を進めることで、1日も早い実現を目指します。
原論文情報
- Daisuke Yamada, Tomonori Iyoda, Raul Vizcardo, Kanako Shimizu, Yusuke Sato, Takaho A. Endo, Genta Kitahara, Momoko Okoshi, Midori Kobayashi, Maki Sakurai, Osamu Ohara, Masaru Taniguchi, Haruhiko Koseki, Shin-ichiro Fujii, "Efficient regeneration of human Vα24+ invariant natural killer T cells and their anti-tumor activity in vivo", Stem Cells, doi: 10.1002/stem.2465
発表者
理化学研究所
統合生命医科学研究センター 免疫細胞治療研究チーム
チームリーダー 藤井 眞一郎(ふじい しんいちろう)
研究員 伊豫田 智典(いよだ とものり)
統合生命医科学研究センター 免疫器官形成研究グループ
グループディレクター 古関 明彦(こせき はるひこ)
研究員 山田 大輔(やまだ だいすけ)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
AMED事業に関すること
日本医療研究開発機構 再生医療研究課
Tel: 03-6870-2220 / Fax: 03-6870-2242
saisei[at]amed.go.jp(※[at]は@に置き換えてください。)
補足説明
- 1.ナチュラルキラーT細胞(NKT細胞)
NK細胞マーカーとT細胞抗原受容体(T cell antigen receptor: TCR)を両方発現しているT細胞の仲間。T細胞のTCRが主要組織適合遺伝子複合体(major histocompatibility complex: MHC / human leukocyte antigen: HLA)クラスI分子拘束性に多様なペプチド抗原を認識するのに対して、NKT細胞のTCRはMHC/HLAではなくCD1dという糖脂質抗原を乗せる分子を認識する。したがってNKT細胞はHLAに拘束されることなく活性化されさまざまなサイトカイン、ケモカインを産生することができる。 - 2.インターフェロンガンマ(IFN-γ)
抗原刺激や微生物感染に応答してT細胞(ヘルパーT細胞:Th1細胞)などから分泌される。抗腫瘍作用、抗ウイルス能増強、マクロファージやNK細胞の活性化などさまざまな機能がある。 - 3.自然免疫系ナチュラルキラー細胞、獲得免疫系キラーT細胞
免疫系は主に自然免疫系と獲得免疫系に大別され、前者は病原微生物感染などに早急に対応する非特異的免疫応答機構である。好中球、マクロファージなどの食細胞やNK細胞、補体などが知られている。後者は自然免疫系から逃れたりした異物に対応する特異的免疫応答機構で、B細胞が産生する抗体(液性免疫)や抗原特異的T細胞(細胞性免疫)などが知られている。がん細胞に対しても免疫監視機構として知られている。発生したがん細胞は自然免疫であるNK細胞、NKT細胞、γδT細胞などにより殺傷される。そしてアポトーシスなどで生じたがん抗原を抗原提示細胞(樹状細胞など)が貪食し、獲得免疫であるT細胞へ提示することで活性化させる。活性化されたキラーT細胞がそのがん抗原を標的として細胞を殺傷する。このように自然免疫系と獲得免疫系が協調的に働くことで病原微生物感染、ウイルス、がんなどから身体を守っている。 - 4.アジュバント作用
一般的に、アジュバントとは抗原に対する免疫応答を増強するために抗原とともに注射される物質で、通常は抗体産生や細胞性免疫の強化に用いられる。研究グループはこれまでにNKT細胞が細胞アジュバントとして働くことが明らかにしてきた。
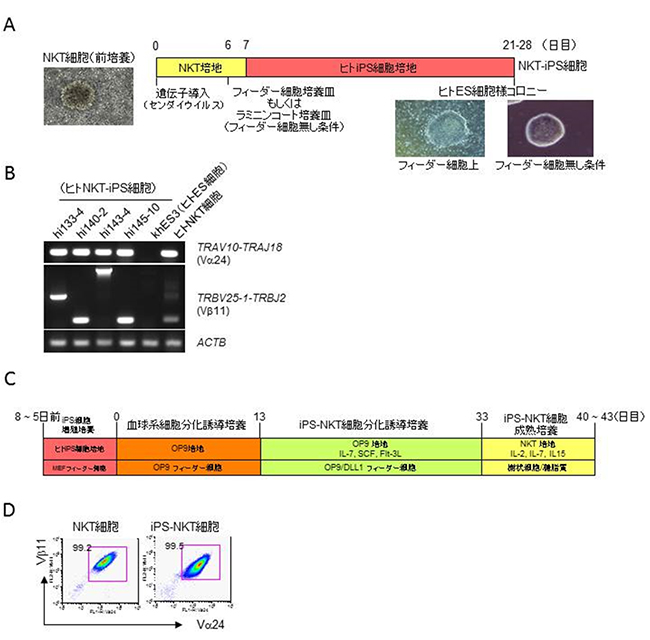
図1 iPS技術によるヒトiPS-NKT細胞の作製方法を確立
- A.ヒトNKT細胞からのiPS細胞樹立方法の概要。前培養したNKT細胞にセンダイウイルスベクターにより初期化因子を導入し、MEFフィーダー細胞(マウス胚性線維芽細胞)上でiPS細胞を誘導した。約3週間後にヒトES細胞様コロニーが観察された。
- B.誘導されたiPS細胞がヒトNKT細胞由来であるかどうかを、PCR法により、NKT細胞特有のT細胞抗原受容体(TCR)の遺伝子再構成(Vα24とVβ11)を検出することで確認した。
- C.iPS細胞からNKT細胞への分化誘導方法の概要。iPS細胞としてある程度増殖させた後、まずOP9フィーダー細胞上で13日間かけて血球系細胞へ分化させた。次に、OP9/DLL1フィーダー細胞上に移してさらに20日間かけてiPS-NKT細胞へ分化させた。最後に、約10日間かけて樹状細胞/糖脂質を用いて成熟培養を行い機能的なiPS-NKT細胞を調製した。
- D.調製したiPS-NKT細胞の表面マーカーの解析結果。NKT細胞特有のTCR (Vα24, Vβ11)の発現をフローサイトメトリー(短時間に多量の細胞を定量的に測定する分析手法)により確認した。
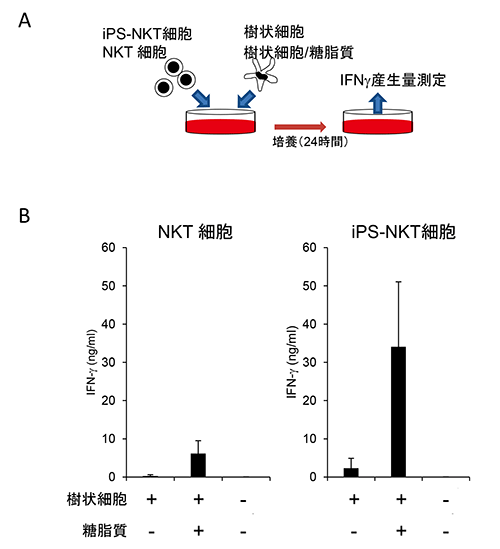
図2 iPS-NKT細胞の試験管内でのIFN-γ産生能
- A.IFN-γ産生能測定の概要。NKT細胞もしくはiPS-NKT細胞に、樹状細胞のみ、または樹状細胞と糖脂質の両方を加え、24時間後にIFN-γ産生量を測定した。
- B.樹状細胞と糖脂質の両方を加えたiPS-NKT細胞では、NKT細胞よりも大きなIFN-γ産生能が示された。
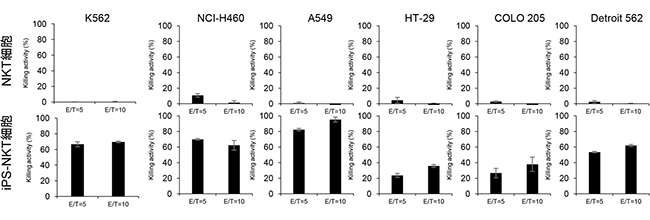
図3 iPS-NKT細胞の試験管内での腫瘍細胞株殺傷能
6種類の腫瘍細胞株(K562;ヒト白血病、NCI-H460;ヒト大細胞がん、A549; ヒト肺細胞基底上皮腺がん、HT-29;ヒト結腸がん、COLO205;ヒト大腸がん、Detroit562; ヒト咽頭がん)に対するNKT細胞もしくはiPS-NKT細胞の抗腫瘍効果を示した。iPS-NKT細胞では6種類全てを強力に殺傷できることが分かった。
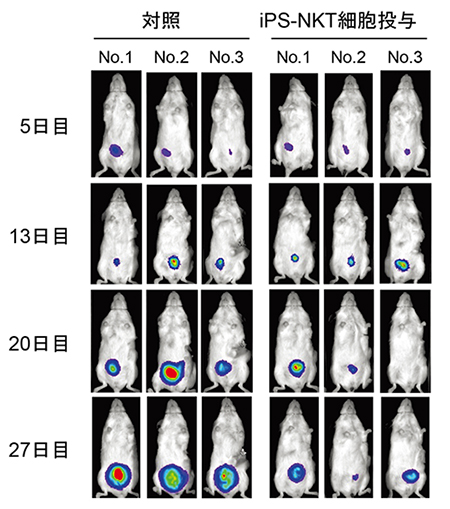
図4 マウスの生体内でのiPS-NKT細胞による抗腫瘍細胞効果
発光する腫瘍細胞を移植した免疫不全マウスにiPS-NKT細胞を移植した後、5、13、20、27日目に腫瘍細胞の大きさを測定した。対照マウスでは腫瘍細胞がだんだん増殖したが、iPS-NKT細胞投与マウスでは腫瘍細胞がほとんど増殖しなかった。
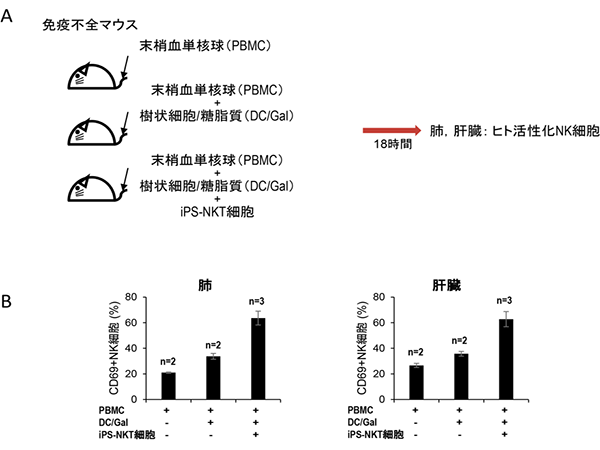
図5 マウスの生体内でのiPS-NKT細胞によるアジュバント効果
- A.マウス生体内でのアジュバント効果解析の概要。図で示すように、免疫不全マウスに末梢血(さい帯血)単核球、樹状細胞/糖脂質、iPS-NKT細胞を投与し、18時間後に肺と肝臓での活性化NK細胞の割合を測定した。
- B.肺と肝臓での活性化ヒトNK細胞マーカー(CD69)の割合をグラフで示した。末梢血単核球+樹状細胞/糖脂質+iPS-NKT細胞の群が最もNK細胞が活性化されたことが分かった。
