要旨
理化学研究所(理研)多細胞システム形成研究センター網膜再生医療研究開発プロジェクトの砂川玄志郎研究員らの研究チーム※は、マウスの能動的低代謝[1]である「休眠」の安定的な誘導法を開発しました。また、マウスが休眠状態に入ると冬眠動物における「冬眠」と同様に熱産生感度が低下し、低代謝状態になることを明らかにしました。
リスやクマなどの冬眠動物は、冬眠という低代謝状態に入ることで基礎代謝[2]が正常時の1~25%にまで低下し、エネルギー消費を節約することで冬期や飢餓を乗り越えます。冬眠動物は入手の困難さやゲノム情報の不足により、最新の分子生物学や遺伝子工学を駆使した研究が難しく、冬眠のメカニズムはいまだによく分かっていません。一方で、哺乳類のモデル生物として使用しているマウスでは、条件が整うと数時間にわたって基礎代謝が正常時の30%程度となる休眠という能動的低代謝状態に入ることが知られていました。しかし、安定した休眠への誘導法や、休眠と冬眠のメカニズムの共通点は知られていませんでした。
今回、研究チームは、マウスの個体差を含んだ代謝の数理モデルを作成し、この数理モデルから推定される値から外れる低代謝状態を休眠状態と定義しました。この手法により休眠の定義が明確となり、客観的で安定した休眠判定が可能になりました。また、この休眠判定法を使い、C57BL/6Jというマウスの系統では、外気温が12〜24℃の範囲内だと100%の確率で休眠に誘導できることを明らかにしました。そこで、この安定的な休眠誘導法を使って、さまざまな環境温度で休眠を誘導し、休眠中の体温制御のパラメータを推定しました。その結果、休眠中のマウスは冬眠動物と同様に熱産生感度を低下させることで低代謝状態になることが分かりました。
本研究によってマウスを能動的低代謝のモデル生物として活用しやすくなりました。今後、分子生物学や遺伝子工学を駆使した能動的低代謝のメカニズム解明が進むと期待できます。またヒトやヒトの臓器を安全に低代謝状態へ誘導できるようになると、再生臓器の長期ストック[3]や重症患者の搬送[4]などの“次世代型の低代謝医療”実現が現実味を帯びてくると考えられます。
本研究は、英国のオンライン科学雑誌『Scientific Reports』(11月15日付け:日本時間11月15日)に掲載されます。
※研究チーム
理化学研究所 多細胞システム形成研究センター 網膜再生医療研究開発プロジェクト
研究員 砂川 玄志郎 (すながわ げんしろう)
プロジェクトリーダー 高橋 政代 (たかはし まさよ)
背景
リスやクマなどの冬眠動物は「冬眠」という低代謝状態に入ることで基礎代謝が正常時の1~25%にまで低下し、エネルギー消費を節約することで冬期や飢餓を乗り越えます。通常では個体が死に至るような低代謝状態に入りながらも、冬眠から目覚めると再び通常の活動を始めることから、冬眠は可逆的(元の状態に戻すことができる性質)な変化といえます。このような省エネ状態をヒトやヒトの臓器に実現できれば、現在では難しい再生臓器の長期ストックや重症患者の搬送など、代謝が高いゆえに弊害となるケースでも、安全かつ可逆的に低代謝を誘導し解決できる可能性があります。実際に冬眠を行う霊長類[5]が見つかっており、ヒトが冬眠できる可能性も十分にあると考えられています。しかし、冬眠そのもののメカニズムがよく分かっていないため、現時点では冬眠の臨床応用は実現できていません。
冬眠のメカニズムを明らかにするためには、冬眠動物を対象に研究を行う必要があります。しかし、冬眠動物は入手や飼育、解析の困難さから研究対象としにくく、ゲノム情報も著しく不足しており、最新の分子生物学や遺伝子工学を駆使した研究が困難です。一方で、哺乳類のモデル生物として使用されているマウス(ハツカネズミ)は条件が整うと数時間に渡って基礎代謝が30%程度となる「休眠」という能動的低代謝状態に入ることが知られています(図1)。
マウスの休眠は冬眠のような長期間にわたる変化ではありませんが、数時間にわたって、睡眠とは明らかに異なる低代謝状態を示します。しかし、マウスの休眠は冬眠と異なり安定した低代謝時間が極めて短く、また安定した誘導法がなかったため、これまで能動的低代謝の研究において、積極的には研究対象とされませんでした(図2)。
研究チームは、マウスの休眠を詳しく解析することで、能動的低代謝の原理の解明や、能動的低代謝を臨床応用するための基盤を整備することを目指しました。そのために、まずマウスの安定的な休眠誘導法を開発し、次に、さまざまな条件でマウスの休眠を誘導することで温度制御の観点から休眠の特徴を解析し、冬眠との相違点を明らかにすることにしました。
研究手法と成果
マウスの休眠誘導の大きな問題点として、個体間で休眠の表現型が大きくばらつくため、休眠の定義が一定でないことが挙げられます。そこで、研究チームはマウス1匹ごとの酸素消費量および体温の経時的変化を測定し、その情報をもとにマウスの代謝の個体差を含む数理モデルを作成して、モデルから推定される値から外れる低代謝状態を「休眠状態」と定義しました(図3)。
この手法により休眠の定義が明確となり、客観的で安定した休眠判定が可能となりました。また、マウスは低栄養状態をきっかけに休眠に入ることが知られていましたが、休眠を確実に誘導できる環境はよく分かっていませんでした。そこで、新たに開発した休眠判定法を用いて、さまざまな外気温(8℃~24℃)で24時間の食事制限を行いマウスの休眠を誘導しました。その結果、C57BL/6Jという系統では、外気温が12~24℃の範囲内だと100%の確率で休眠に誘導できることが明らかになりました。
また、同じ実験から外気温の変化に対して、休眠中の代謝が大きく変化していることが分かりました。正常時には外気温が変化してもマウスの体温は一定に保たれていますが、休眠中は外気温の変化の影響を受けやすくなっていました(図4)。
そこで、外気温に対して変化する体温制御の数理モデルを作成し、今回の実験で得られた正常時と休眠時の代謝を適応し、モデルのパラメータを推定したところ、休眠に入ると体温制御ネットワークの特性が大きく変化することが分かりました。具体的には、哺乳類の体温は通常は一定に保たれており、熱を放出する放熱系と熱を産生する熱産生系がバランスをとることで恒常性を保っています。熱産生系は、動物が維持したい体温の設定温度(TR)と実際の体温(TB)、そして熱産生感度(設定温度と体温の温度差に対してどれだけ熱産生を行うかという係数、H)という三つのパラメータでモデル化することができます(図5)。
Hが、大きければ大きいほど、温度差に対して大きな熱を産生し、小さければ小さいほど温度差に対して鈍くなり熱を産生しなくなります。つまり、実際に発熱を促すシグナルは「(TR - TB)× H」と表せます。理論上はTRとHのどちらか一方が低下するだけでも、熱産生が低下するため、代謝が低下します。実際に冬眠動物はTRとHの両方を下げることで、著しい低代謝を誘導することが知られています。
今回の研究で、休眠マウスはTRをほとんど下げることなく、Hを冬眠動物と同程度に低下させることで代謝を低下させていることが分かりました(図6)。つまり、休眠マウスは冬眠動物と同様に、熱産生感度を低下させ、低代謝状態となることが分かりました。また、休眠マウスは冬眠動物とは違い、体温の設定温度をほとんど低下させることなく、低代謝状態になることも分かりました。
今後の期待
今回、二つの代表的な能動的低代謝である冬眠と休眠で、代謝が低下するメカニズムとして熱産生感度Hが低下する構造は共通であることが分かりました。このため、Hを低下させているメカニズムを明らかにすれば、その上流に存在する能動的低代謝を誘導している普遍的な誘導因子を突き止められる可能性があります。また、ヒトに低代謝を誘導する際にもHを低下させることが重要だと考えられます。今後は休眠中の熱産生系の挙動を詳細に調べていき、脳や末梢組織のどのような部位がHの低下に関与しているのか研究を進めていきます。
また、本研究によってマウスの休眠を安定に誘導できるようになったため、休眠マウスから標本を採取することが容易になりました。このようなサンプルを用いて休眠の誘導因子をスクリーニングする研究も進めていきます。
能動的低代謝は、哺乳類が長年の進化を経て獲得した優れた生存戦略です。その生存戦略をヒトに応用することで、再生医療や救急医療を著しく改善できると考えています。本研究によって能動的低代謝の研究が盛んになり、低代謝のメカニズムの理解が進むことで、“次世代型の低代謝医療”実現が現実味を帯びてくると考えられます。
原論文情報
- Genshiro A Sunagawa, Masayo Takahashi, "Hypometabolism during Daily Torpor in Mice is Dominated by Reduction in the Sensitivity of the Thermoregulatory System", Scientific Reports, doi: 10.1038/srep37011
発表者
理化学研究所
多細胞システム形成研究センター 網膜再生医療研究開発プロジェクト
研究員 砂川 玄志郎 (すながわ げんしろう)
 砂川 玄志郎 (左)と高橋 政代(右)
砂川 玄志郎 (左)と高橋 政代(右)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.能動的低代謝
一部の哺乳類が持つ能動的に基礎代謝を低下させる現象。数カ月に及ぶものを「冬眠(hibernation)」、数時間程度のものを「休眠(daily torpor)」と呼ぶ。基礎代謝が低下するため結果的に体温の低下も伴い、冬眠動物では環境温度より数℃高い程度の体温にまで低下する。冬眠・休眠の間に低下した代謝は可逆的に正常に戻るため、臨床の現場で代謝の亢進によって不利益を被る事態を、能動的低代謝を誘導することで解決できると考えられている。しかし、現在のところ冬眠・休眠の誘導メカニズムは明らかではない。 - 2.基礎代謝
動物は安静状態(静止していて運動をしていない状態、睡眠時など)でも、体温維持、呼吸、心臓の動きなどのさまざまな生命活動を続けている。このような生きていくために必要な最小のエネルギー消費を基礎代謝と呼ぶ。 - 3.再生臓器の長期ストック
再生医療が大きな発展を遂げる中、再生された臓器や組織のストック法はいまだに決定的な手法が開発されていない。再生医療を一般的な治療として普及させるためには、再生医療の産業化、すなわち再生臓器を大量生産し、必要なときに必要なものを運搬する再生医療が求められており、臓器・組織を作製後のストック法は大きな課題となっている。再生臓器・組織に能動的低代謝を誘導できれば、安全かつ効率的なストック法が開発される可能性がある。 - 4.重症患者の搬送
重症な患者の中には病院までたどり着けば助かるが、搬送できないために死に至るケースがある。また、脳梗塞や心筋梗塞などは塞栓が生じて、血流が途絶えてからできるだけ速やかに血流を再開する必要があり、血管の再灌流までに一定時間が経過すると予後が著しく悪化することが知られている。そこで、搬送前の重症患者を安全に能動的低代謝に誘導できれば、治療開始までの時間を稼ぐことができ、現在では救えない患者を救える可能性がある。 - 5.冬眠を行う霊長類
2004年にマダガスカル島で、世界で初めて冬眠するサル(フトオコビトキツネザル)が見つかった(Dausmann KH, Nature, 2004)。また、2015年にはベトナムでアフリカ大陸以外で初めて冬眠をするサル(ピグミースローロリス)が発見された(Ruf T, Sci. Rep., 2015)。
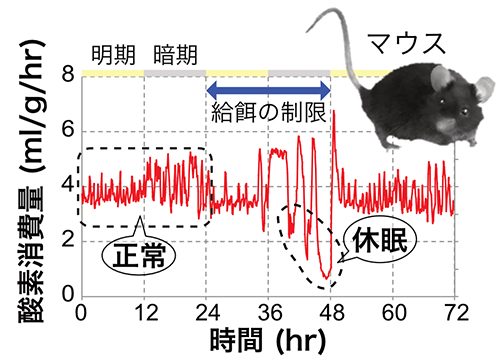
図1 典型的なマウスの休眠現象
マウスの酸素消費量を3日間測定した結果。最初の24時間は、餌を自由に食べられる環境にあり、明期と暗期で概日時計(体内時計)の影響により酸素消費量の日内変動がみられる。マウスは夜行性のため暗期の活動量が多く、結果的に酸素消費量が多くなる。しかし、餌を制限した2日目は暗期に入って数回の低代謝状態、すなわち休眠現象がみられる。3日目に入って餌を再び与えると、1日目と同じような行動パターンに戻ることから、可逆的な低代謝状態であることが分かる。

図2 能動的低代謝状態となる生物
能動的低代謝となる代表的な生物であるリスとマウスを比較した表。リスは「冬眠」、マウスは「休眠」という可逆的な低代謝状態に入ることができる。低代謝の程度は冬眠のほうが大きいが、研究のしやすさは休眠が勝る。
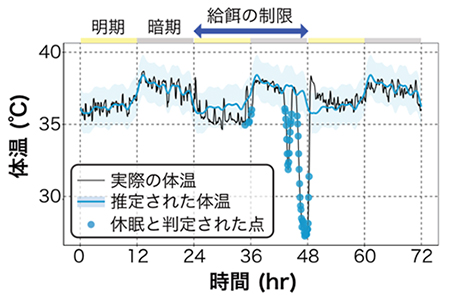
図3 休眠を正常代謝からの外れ値として判定
動物は系統・雌雄・週齢だけではなく個体ごとに代謝の変動がばらつくため、休眠を一つの境界線で定義することは難しかった。そこで、個体ごとに代謝変動を予測できるようにした上で、その予測から大きく外れた状態を休眠と定義した。具体的には個体の代謝変動を1日のデータからモデルに当てはめ、そのモデルから推定された99.9%信頼区間から外れた時点を休眠と定義した。この定義により、休眠状態の客観的な議論が容易になった。
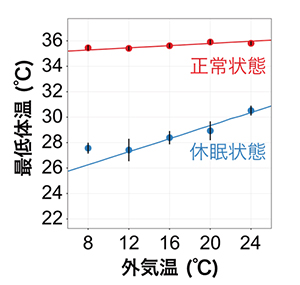
図4 外気温と体温の関係
哺乳類は、外気温に関わらず体温を一定に保つ温度恒常性を持っている。マウスも正常時は外気温の変化に対して、体温変動は極めて小さい(赤い線)。しかし、休眠状態に入ると外気温の低下に伴い体温が低下していくことが分かった(青い線)。外気温が12~24℃の範囲内の環境では外気温-体温関係が直線で近似できるが、8℃まで低下すると熱を産生し始める。動物にとって許容できる最低体温が存在し、それを下回りそうになると休眠状態でも、熱を産生していると考えられる。同様の現象は冬眠動物でもみられることから、背後に共通のメカニズムが存在している可能性がある。
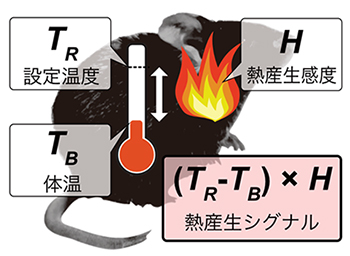
図5 哺乳類の熱産生系
動物が維持したい体温の設定温度TRと実際の体温TBの差に対してどれほどの熱を産生するかを決定する係数が、熱産生感度Hである。
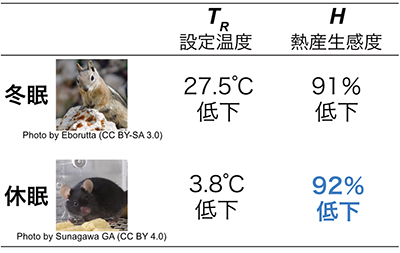
図6 低代謝における熱産生機構の違い
冬眠動物も休眠動物も熱産生感度の低下はほぼ同程度であることが分かった。また、冬眠動物でも冬眠の初期は目標温度が高いことが知られており、目標温度の低下には一定の時間が必要だとすると、休眠動物の設定温度が高いことは休眠現象の低代謝期間が短いことが原因である可能性がある。
