要旨
理化学研究所(理研)グローバル研究クラスタ疾患糖鎖研究チームの蕪木智子客員研究員、木塚康彦研究員、北爪しのぶ副チームリーダー、谷口直之チームリーダーらの研究チーム※は、マウスを用いて、「α2,6シアル酸[1]」と呼ばれる糖を持つ糖鎖[2]が肥満を抑えることを発見しました。
肥満は、高血圧症や糖尿病、動脈硬化を初めとする生活習慣病のリスク因子であることが知られています。肥満に伴って脂肪細胞[3]が肥大・増殖すると、脂肪細胞の働きが悪くなり、代謝の異常や生活習慣病の発症につながります。
糖鎖とは、グルコースなどの糖が鎖状につながってタンパク質などに結合したもので、体内の半分以上のタンパク質は糖鎖を付けた状態で存在しています。糖鎖は体の中でさまざまな役割を果たしており、糖鎖の構造や量の変化が、がん、糖尿病、アルツハイマー病などの疾患の原因の一つとなることが分かっています。一方で、糖鎖と肥満との関係はほとんど分かっていませんでした。
研究チームが高脂肪食を与えて肥満にしたマウスの脂肪組織を調べたところ、末端にα2,6シアル酸を持つ糖鎖の量が、肥満細胞への分化に伴って大きく減少していることを発見しました。これは、α2,6シアル酸を作る酵素であるST6GAL1[4]の遺伝子が、DNAメチル化[5]という仕組みによって“オフ”になるためであることが分かりました。逆に、培養した脂肪細胞においてST6GAL1の量を強制的に増やすと、脂肪の蓄積量が減少することも分かりました。また、脂肪細胞を詳しく解析した結果、インテグリン[6]β1と呼ばれる接着性のタンパク質がα2,6シアル酸を持っており、α2,6シアル酸が少なくなるとインテグリンβ1の働きが弱まり、それが脂肪細胞の増殖や分化を促進することが分かりました。
これらのことから、ST6GAL1が作るα2,6シアル酸を持った糖鎖は、インテグリンβ1などの働きを調節することで脂肪細胞の増殖と肥満を抑えることが明らかになりました。実際、ST6GAL1欠損マウスに高脂肪食を与えると、通常マウスよりも体重や脂肪の増加量が大きくなりました。ヒトの遺伝子解析でも、ST6GAL1が肥満や糖尿病と関係があることが、最近、報告されています。今後、肥満に関連する疾患の治療を考える上で、α2,6シアル酸を標的とした新しい治療法の開発が期待できます。
本研究は、米国の科学雑誌『The Journal of Biological Chemistry』に掲載されるのに先立ち、オンライン版(12月28日)に掲載されました。
背景
日本の肥満者(BMI[7]が25以上)数は増加傾向にあり、2015年の成人の肥満者は約2,500万人と推定されています注1)。肥満は、糖尿病や高血圧、動脈硬化など生活習慣病の発症リスクを高めることが知られています。その原因の一つが、肥満に伴って肥大化・増殖した脂肪細胞の機能異常にあると考えられています。しかし、脂肪細胞の肥大化や増殖のメカニズムはまだ完全には明らかになっていません。
糖鎖とは、グルコースなどの糖が鎖状につながってタンパク質などに結合したもので、体内の半分以上のタンパク質は糖鎖を持った状態で存在しています。糖鎖はタンパク質の修飾の中で最も多く、体の中でさまざまな役割を果たしています。また糖鎖は種類が多様で、それぞれの糖鎖が異なる役割を持っていることから、特定の糖鎖の増減が、がん、糖尿病、アルツハイマー病などの疾患の原因の一つとなることが分かっています。しかし、肥満時に起こる脂肪細胞の肥大化や増殖の過程で、どの糖鎖がどのような役割を果たしているのかはほとんど明らかになっていませんでした。
研究チームは、肥満における糖鎖の役割を明らかにするため、マウスに高脂肪食を与えて肥満を誘発し、そのとき脂肪細胞に起こる糖鎖の変化の解析を試みました。
注1)厚生労働省 国民健康・栄養調査(平成27年) 結果の概要
研究手法と成果
糖鎖は、約180種類ある糖転移酵素[8]と呼ばれる酵素の働きによって細胞の中で作られています。研究チームは、肥満マウスの糖転移酵素の遺伝子発現量を調べたところ、ST6GAL1と呼ばれる酵素の量が、脂肪細胞の中で肥満に伴って最も減少することを発見しました。ST6GAL1は、糖鎖の末端にα2,6シアル酸と呼ばれる糖をつける酵素です(図1左)。そこで、肥満マウスの脂肪組織中のα2,6シアル酸の量を調べたところ、やはり通常の餌で飼育したマウスよりも減少していることが分かりました(図1右)。これらのことから、ST6GAL1が作るα2,6シアル酸が、脂肪の肥大化や肥満と関連性があることが示されました。
脂肪細胞の肥大化や増殖におけるα2,6シアル酸の役割を詳しく調べるため、3T3-L1という脂質代謝研究で用いられるモデル細胞を試薬で処理し、脂肪細胞へと分化させました(図2上)。すると、肥満マウスの脂肪組織と同様、脂肪細胞へと分化するに伴って、細胞内に脂質やタンパク質などを含む球形の脂肪滴が形成され、ST6GAL1の量が減少していくことが分かりました。ST6GAL1の遺伝子を調べたところ、このST6GAL1の減少はDNAメチル化によって引き起こされていたことから、エピジェネティクス[9]によってST6GAL1の遺伝子が“オフ”になっていることが明らかになりました。さらに、細胞の中のST6GAL1の量を強制的に増やして脂肪細胞へ分化させたところ、脂肪の蓄積が抑えられることが分かりました(図2下)。またその原因は、脂肪細胞の増殖が抑えられるためであることも分かりました。
これらのことから、ST6GAL1は脂肪細胞の増殖を抑えており、肥満に伴い脂肪細胞へ分化していくにつれ、DNAメチル化の仕組みによってその量が減少していくことが分かりました。
次に、ST6GAL1が作るα2,6シアル酸がどのように脂肪細胞の増殖を抑えているのかを明らかにするため、α2,6シアル酸を持つ糖タンパク質を探索しました。その結果、インテグリンβ1と呼ばれるタンパク質がα2,6シアル酸を持つことが分かりました。
インテグリンは接着分子と呼ばれるタンパク質で、細胞が細胞外の環境と接着するために必要です。細胞の表面に存在するインテグリンが細胞の外のタンパク質と接着すると、その信号が細胞の中へ伝えられ、FAK[10]と呼ばれるタンパク質がリン酸化[11]され、細胞の形や増殖度合いが変化することが知られています。そこで、肥満に伴って脂肪細胞のインテグリンβ1上のα2,6シアル酸が少なくなったときの、インテグリンβ1を介したFAKのリン酸化を調べました。その結果、リン酸化されたFAKの量が減少し、インテグリンの働きが弱くなっていることが分かりました(図3)。
これらの結果から、ST6GAL1が作るα2,6シアル酸は、脂肪細胞のインテグリンβ1の働きを調節することで、脂肪の増殖を抑えていると考えられました。そこで、ST6GAL1欠損マウスに高脂肪食を与え、体重や脂肪量の変化を調べました。その結果、野生型マウスに比べ、ST6GAL1欠損マウスの方が体重や脂肪量の増加が大きいことが分かりました(図4)。さらに、脂肪細胞の増殖度合いもST6GAL1欠損マウスの方が高いことも分かりました。
今後の期待
研究チームはマウスを用いて、ST6GAL1が作るα2,6シアル酸を持つ糖鎖が脂肪細胞の増殖を抑え、肥満を抑えることを明らかにしました。実際にヒトの遺伝子解析でも、ST6GAL1が肥満や糖尿病と関係があることが、最近、報告されています。今後、肥満に関連する糖尿病、動脈硬化などの疾患の治療を考える上で、α2,6シアル酸を標的にした新たな治療法の開発が期待できます。
原論文情報
- Tomoko Kaburagi, Yasuhiko Kizuka, Shinobu Kitazume, and Naoyuki Taniguchi, "Inhibitory Role of α2,6-Sialylation in Adipogenesis", The Journal of Biological Chemistry, doi: 10.1074/jbc.M116.747667
発表者
理化学研究所
グローバル研究クラスタ 理研-マックスプランク連携研究センター システム糖鎖生物学研究グループ 疾患糖鎖研究チーム
客員研究員 蕪木 智子(かぶらぎ ともこ)
研究員 木塚 康彦(きづか やすひこ)
副チームリーダー 北爪 しのぶ(きたづめ しのぶ)
チームリーダー 谷口 直之(たにぐち なおゆき)
 蕪木 智子
蕪木 智子
 木塚 康彦
木塚 康彦
 北爪 しのぶ
北爪 しのぶ
 谷口 直之
谷口 直之
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.α2,6シアル酸
酸性の糖であるシアル酸が、α2,6という結合様式で糖鎖の末端に結合したもののこと。α2,6シアル酸を持つ糖鎖はタンパク質に結合している。大部分のα2,6シアル酸はST6GAL1によって作られる。 - 2.糖鎖
グルコース(ブドウ糖)などの糖が鎖状につながった物質。遊離の状態で存在するものや、タンパク質や脂質に結合した状態のものがある。α2,6シアル酸は糖鎖の末端に存在する。 - 3.脂肪細胞
脂肪を中に貯蔵する細胞。白色脂肪細胞と褐色脂肪細胞に分けられるが、肥大化して肥満をもたらすのは白色脂肪細胞で、脂肪細胞の約99%を占める。褐色脂肪細胞は、脂肪を燃焼して熱を産生する細胞である。特にことわりがない場合、脂肪細胞とは白色脂肪細胞のことを指す。 - 4.ST6GAL1
糖転移酵素の一つで、細胞の中のゴルジ体に存在し、シアル酸を糖鎖の末端にα2,6結合の様式で転移する。 - 5.DNAメチル化
遺伝子の発現をオフにする機構の一つ。A、T、G、Cから成るDNA配列の中で、CGという並びのCにメチル基が付けられる。DNAがメチル化されるとRNAへの転写が起こりにくくなり、その遺伝子の発現はオフになる。 - 6.インテグリン
細胞の表面に存在し、細胞と細胞外とをつなぐ接着分子の一つ。αとβが結合した二量体から成る。α、βそれぞれが複数種類存在し、β1はその一つである。インテグリンが細胞外の特異的なタンパク質と結合すると、FAKタンパク質がリン酸化され、細胞内にシグナルが伝わって細胞が増殖したり移動したりする。 - 7.BMI
肥満度を測るための国際的な指標で、体重(kg)÷身長(m)÷身長(m)で算出される。18.5未満を低体重、22を標準体重(医学的に最も病気が少ない)、18.5以上25未満を普通体重、25以上を肥満としている。BMIはbody mass indexの略。 - 8.糖転移酵素
主に細胞の中の小胞体、ゴルジ体に存在し、糖鎖の合成に関わる一群の酵素。ひとつひとつ糖を糖鎖に転移していくことで、最終的に成熟した形の糖鎖が作られる。ST6GAL1も糖転移酵素の一つ。 - 9.エピジェネティクス
DNA配列に依存しない遺伝子の調節機構のこと。DNAの塩基配列だけでは説明できない遺伝子発現調節の仕組みとして、近年急速に研究が進んでいる。DNAのメチル化やヒストンの修飾、非コードRNAなどがこれに当たる。 - 10.FAK
チロシンキナーゼの一種。チロシンキナーゼとは、タンパク質のチロシン残基を特異的にリン酸化する酵素で多細胞生物のみに存在し、細胞の分化や増殖、接着、免疫反応などに関わるシグナル伝達に関与する。FAKとはFocal adhesion kinaseの略。 - 11.リン酸化
タンパク質の修飾の一つ。キナーゼと呼ばれる酵素によってリン酸化され、酵素フォスファターゼによってリン酸が外される。リン酸化は、酵素の活性化やタンパク質の輸送の目印など、タンパク質の機能調節に使われる。
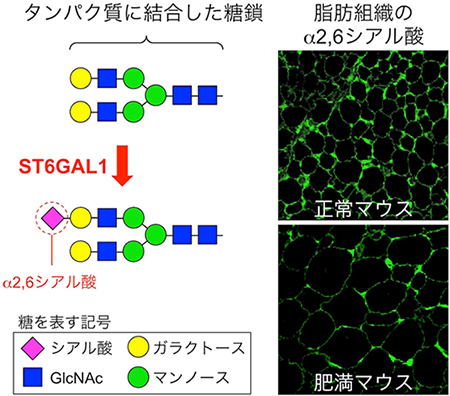
図1 糖転移酵素ST6GAL1が作るα2,6シアル酸と肥満マウスにおけるその減少
左:タンパク質に結合している糖鎖の典型的な構造の一例。糖転移酵素ST6GAL1の作用によって、糖鎖の末端のガラクトースにα2,6シアル酸が転移される。
右:通常の餌で飼育したマウス(正常マウス)と、高脂肪の餌で飼育して肥満にさせたマウスの脂肪組織の染色像。α2,6シアル酸と特異的に結合するレクチン(糖結合タンパク質)を用いて染色した。肥満マウスでは脂肪組織のα2,6シアル酸が減少していることが見て取れる。
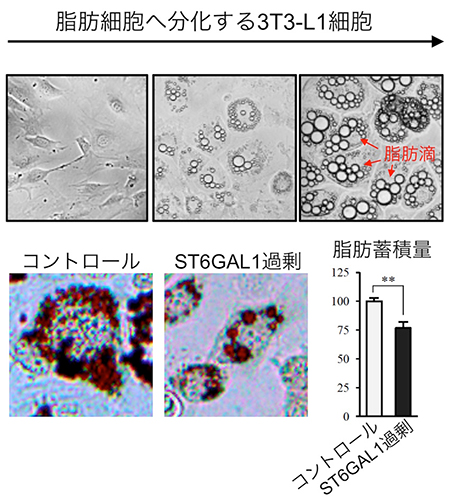
図2 ST6GAL1の過剰な発現による脂肪の減少
上:3T3-L1細胞を特殊な培地で培養することで、脂肪細胞へ分化させた。左は培養初日、中は培養7日目、右は培養14日目の顕微鏡画像。分化が進むにつれ、細胞内に脂肪が蓄積して、脂質やタンパク質などを含む球形の脂肪滴が形成されるのが分かる。
下:7日間脂肪細胞へ分化誘導した3T3-L1細胞(左)と、ST6GAL1を過剰に発現した細胞(右)の脂肪滴を色素(オイルレッド-O)で染色した顕微鏡画像。また、そのときの脂肪の量を測定した結果が右のグラフであり、ST6GAL1を過剰に発現した細胞では脂肪蓄積量が25%ほど減少しているのが分かる。
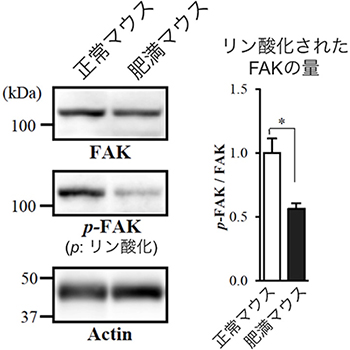
図3 肥満マウスにおけるインテグリンβ1下流のタンパク質FAKのリン酸化の減少
正常マウスと肥満マウスの脂肪組織をウエスタンブロット法により解析した。p-FAKはリン酸化されたFAKを検出している。肥満マウスでは、インテグリンβ1上のα2,6シアル酸が減少したため、その下流にあるFAKのリン酸化が減少した。Actin(アクチン)は、正常マウスと肥満マウスで同じ量のタンパク質が解析されたことを示すコントロール。
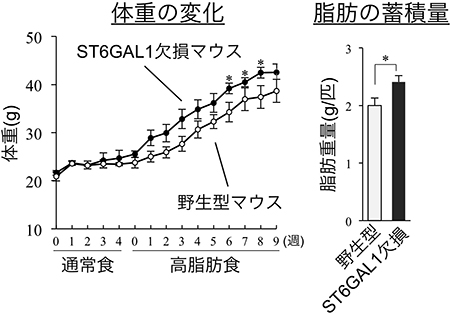
図4 高脂肪食摂取による野生型とST6GAL1欠損マウスの体重増加
野生型マウスとST6GAL1欠損マウスに高脂肪食を摂取させた。左は週ごとの体重の増加、右は精巣上体周囲の白色脂肪の重量を示す。野生型マウスに比べ、ST6GAL1欠損マウスの方が体重や脂肪量の増加が大きいことが分かる。
