要旨
理化学研究所(理研)統合生命医科学研究センター粘膜システム研究グループの金谷高史研究員と大野博司グループディレクターらの国際共同研究グループ※は、腸管の免疫誘導組織であるパイエル板[1]において発現するインターロイキン-22結合タンパク質(IL-22BP)が、パイエル板への細菌抗原の取り込みを円滑にする役割を担うことを発見しました。
腸の粘膜は、食物や食物とともに摂取される外来微生物、40兆個にも及ぶ腸内常在細菌叢などの異物に常にさらされています。これらの中には病原性を持つものが含まれているため、腸管粘膜を覆う腸管上皮細胞には防御機構が備わっています。インターロイキン-22(IL-22)は病原性細菌に感染したとき、免疫細胞において誘導されるサイトカイン[2]です。IL-22は、腸管でIL-22受容体(IL-22R)を発現する腸管上皮細胞に作用し、腸管上皮細胞での粘液や抗菌タンパク質の産生、上皮細胞表面のフコシル化[3]を誘導します。それにより、細菌感染に対する防御機能を増強させます。IL-22BPはIL-22に結合することでIL-22シグナルを阻害する分子です。IL-22BPがIL-22Rと競合し、IL-22シグナルを適切に制御することで腸管の恒常性が維持されていると考えられています。しかし、その生体における役割は十分に理解されていませんでした。
今回、研究チームはまず、腸管の各部位におけるIL-22BPの発現様式を調べました。その結果、IL-22BPがパイエル板という腸管関連リンパ組織に分布する樹状細胞[4]に高発現することを見いだしました。また、野生型マウスとIL-22BP欠損マウスの比較から、IL-22BPがパイエル板の粘膜側を覆う濾胞随伴上皮細胞層(FAE)[5]におけるIL-22シグナルを阻害することが分かりました。FAEにおいてIL-22シグナルが阻害されると、粘液や抗菌タンパク質の産生、上皮細胞表面のフコシル化が阻害され、細菌抗原がFAEに到達しやすい環境が形成されます。その結果、細菌抗原がFAEのM細胞[5]を介して効率よくパイエル板へ取り込まれ、腸管免疫応答が誘導されることが明らかになりました。
本成果は今後、より効果的なパイエル板への粘膜ワクチンデリバリーシステム[6]を開発する上で有用な知見になると期待できます。
本研究は、米国の科学雑誌『Journal of Experimental Medicine』に掲載されるのに先立ち、オンライン版(5月16日付け:日本時間5月16日)に掲載されます。
※共同研究グループ
理化学研究所 統合生命医科学研究センター 粘膜システム研究グループ
グループディレクター 大野 博司(おおの ひろし)(横浜市立大学大学院 生命医科学研究科 大学院客員教授)
研究員 金谷 高史(かなや たかし)(横浜市立大学大学院 生命医科学研究科 大学院客員研究員)
研修生 陣野原 俊(じんのはら とし)(横浜市立大学大学院 生命医科学研究科 大学院生)
テクニカルスタッフⅡ 榊原 小百合(さかきばら さゆり)
特別研究員 加藤 完(かとう たもつ)
テクニカルスタッフⅡ 橘 直子(たちばな なおこ)
特別研究員 佐々木 崇晴(ささき たかはる)
研修生 橋本 佑介(はしもと ゆうすけ)(横浜市立大学大学院 生命医科学研究科 大学院生)
慶應義塾大学
薬学部 生化学講座
教授 長谷 耕二(はせ こうじ)
医学部 消化器内科
准教授 佐藤 俊朗(さとう としろう)
東京大学 医科学研究所
幹細胞治療研究センター 幹細胞セロミクス分野
特任准教授 渡会 浩志(わたらい ひろし)
感染・免疫部門 炎症免疫学分野
教授 清野 宏(きよの ひろし)
特別研究員 柴田 納央子(しばた なおこ)
医薬基盤・健康・栄養研究所 ワクチンマテリアルプロジェクト
プロジェクトリーダー 國澤 純(くにさわ じゅん)
エモリー大学
教授 イフォー・ウイリアムズ(Ifor Williams)
背景
腸の粘膜は、食物や食物とともに摂取される外来微生物、40兆個にも及ぶ腸内常在細菌叢などの異物に常にさらされています。これら抗原の中には病原性を持つものが含まれているため、腸管粘膜を覆う腸管上皮細胞には抗原に対する防御機構が備わっています。その代表的なものは、粘液や抗菌タンパク質の産生、上皮細胞表面のフコシル化などです。これらの防御機構は、腸内の外来微生物由来の分子を認識するパターン認識受容体[7]やサイトカイン受容体によって活性化されるシグナル伝達経路[8]によって効果的に制御されています。
サイトカインの一種であるインターロイキン-22(IL-22)は、病原性細菌が感染すると3型自然免疫リンパ球[9]などの免疫細胞から産生され、IL-22受容体(IL-22R)を発現する腸管上皮細胞に作用します。その結果、上皮細胞において細胞内情報伝達分子のSTAT3[10]が活性化されることで粘液や抗菌タンパク質の産生が誘導され、病原性細菌感染に対する防御機能が増強されます。また、IL-22は腸管上皮細胞の増殖を促すことにより、炎症性疾患などで損傷した上皮組織の修復を行います。このようにIL-22は、腸管の恒常性維持に重要な役割を果たしています。
一方で、IL-22は特定の条件下においては病態を悪化させる因子にもなり得ることから、IL-22を介したシグナル伝達経路は適切に制御される必要があります。IL-22シグナルを制御する因子としてIL-22結合タンパク質(IL-22BP)が知られています。IL-22BPはIL-22への親和性がIL-22Rよりもはるかに高く、IL-22Rと競合しIL-22へ結合することでIL-22シグナルを阻害します。IL-22BPがIL-22シグナルを適切に制御することで腸管の恒常性が維持されていると考えられていますが、その生体における役割は十分に理解されていませんでした。
研究手法と成果
研究チームはまず、IL-22BPの生体内での役割を明らかにするため、腸管の各部位におけるIL-22BPの発現様式を調べました。その結果、IL-22BPがパイエル板という腸管関連リンパ組織において高発現すること、さらにIL-22BPは主にパイエル板内の樹状細胞で産生されることを見いだしました。
パイエル板は、粘膜側を覆う濾胞随伴上皮細胞層(FAE)を介して腸管内の細菌抗原を取り込み、抗原特異的な免疫応答を誘導する組織です。FAEには5~10%の割合でM細胞が存在しています。このM細胞が抗原の取り込み口として働き、取り込んだ抗原をFAEと近接するパイエル板のドーム下領域(SED)に分布する樹状細胞に渡します。今回分かったIL-22BPを産生する樹状細胞は、SEDに分布していました(図1)。そのため研究チームは、IL-22BPがFAEの性質や状態に影響を与えるのではないかと考えました。
次に、野生型マウスとIL-22BP欠損マウスにそれぞれIL-22を投与し、IL-22シグナルの活性化を調べました。その結果、野生型マウスではIL-22シグナルの活性化が粘膜面を覆う絨毛上皮細胞でみられましたが、FAEではみられませんでした(図2左)。一方、IL-22BP欠損マウスでは、FAEにおいてIL-22シグナルの活性化がみられたことから、IL-22BPがFAEにおけるIL-22シグナルを恒常的に阻害していることが示されました(図2右)。そこで、IL-22BP欠損マウスからFAEを採取して遺伝子発現を解析したところ、粘液や抗菌タンパク質の産生、上皮細胞表面のフコシル化を制御する遺伝子の発現が亢進していることが分かりました(図3)。
これらのIL-22BP欠損マウスにおけるFAEの性質や状態の変化は、細菌抗原のFAEへの到達や接着を阻害すると考えられ、パイエル板への細菌抗原の取り込みが減少すると推測されます。実際にIL-22BP欠損マウスのパイエル板への細菌抗原の取り込みを調べたところ、病原性細菌の一種であるSalmonellaTyphimurium(ネズミチフス菌)や腸内共生細菌の一種であるAlcaligenes(アルカリゲネス属)の取り込みが減少しました。一方で、細菌の取り込みを担うM細胞の機能に大きな変化はみられませんでした。
これらのことから、IL-22BPがFAEにおける粘液や抗菌タンパク質の産生、上皮細胞表面のフコシル化を恒常的に阻害し、細菌抗原がFAEに到達しやすい環境が形成され、M細胞を介した細菌抗原の取り込みが円滑に行われることが明らかになりました。
今後の期待
これまでパイエル板への細菌抗原の取り込みは、取り込み口であるM細胞の有無に大きく依存すると考えられていました。今回、FAEにおいて粘液や抗菌タンパク質の産生、上皮細胞表面のフコシル化などの防御機能が阻害されることがパイエル板への細菌抗原の取り込みに重要であることが明らかとなりました。本成果は今後、より効率的なパイエル板への粘膜ワクチン抗原デリバリーシステムを開発する上で有用な知見になると期待できます。
原論文情報
- Toshi Jinnohara*, Takashi Kanaya*, Koji Hase, Sayuri Sakakibara, Tamotsu Kato, Naoko Tachibana, Takaharu Sasaki, Yusuke Hashimoto, Toshiro Sato, Hiroshi Watarai, Jun Kunisawa, Naoko Shibata, Ifor R Williams, Hiroshi Kiyono, and Hiroshi Ohno, "IL-22BP dictates characteristics of Peyer’s patch follicle-associated epithelium for antigen uptake", Journal of Experimental Medicine, doi: 10.1084/jem.20160770
*These authors contributed equally to this work.
発表者
理化学研究所
統合生命医科学研究センター 粘膜システム研究グループ
研究員 金谷 高史(かなや たかし)
グループディレクター 大野 博司(おおの ひろし)
 大野 博司
大野 博司
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.パイエル板
小腸の粘膜下にリンパ球などの免疫細胞が集合して作られるリンパ組織。粘膜側は濾胞随伴上皮細胞層(FAE)と呼ばれる、絨毛とは異なった上皮細胞層に覆われている。腸管内の細菌などの抗原をFAEを介して取り込む。取り込まれた抗原はFAEに近接するドーム下領域(sub-epithelial dome: SED)に分布する樹状細胞に受け渡され、T細胞へと抗原提示が行われる。最終的に抗原特異的なIgA(免疫グロブリンA)抗体を産生するB細胞が成熟する。抗原特異的なIgA抗体は腸管内に放出され、抗原の排除に寄与する。 - 2.サイトカイン
細胞同士の情報伝達に関わるさまざまな生理活性を持つ可溶性タンパク質の総称。 - 3.フコシル化
単糖の一種であるフコースが付加されること。本稿では上皮細胞の表面のフコシル化を指す。近年、上皮細胞のフコシル化は、病原性細菌の一種である Salmonella Typhimurium(ネズミチフス菌)に対する防御として働くことが報告されている。 - 4.樹状細胞
樹状突起を持つ白血球で、多くの亜集団がある。微生物の排除やTリンパ球に異物の情報を伝える抗原提示細胞として働き、免疫反応の本質的な司令塔としての役割を担っている。 - 5.濾胞随伴上皮細胞層(FAE)、M細胞
パイエル板の粘膜側を覆う上皮細胞層。FAEには5~10%の割合でM細胞が存在する。M細胞は抗原の取り込みに特化した上皮細胞で、細菌などの抗原を取り込み、パイエル板のドーム下領域(SED)に分布する樹状細胞へ受け渡す。残りは主に絨毛の大部分を占める吸収上皮細胞様の細胞で構成されている。FAEはfollicle-associated epitheliumの略。 - 6.粘膜ワクチンデリバリーシステム
パイエル板へワクチン抗原を効率よく取り込ませるためのデリバリーシステム。ほとんどの抗原がM細胞から取り込まれると考えられるため、M細胞を標的とした方法が開発されている。 - 7.パターン認識受容体
細胞表面にある受容体タンパク質。さまざまな病原性微生物由来成分、PAMP(pathogen-associated molecular patterns)を認識して自然免疫を作動させる。動物や昆虫ではToll様受容体が知られている。 - 8.シグナル伝達経路
生体内である種のシグナルが他のシグナルに変換され、連続して伝わる過程のこと。一般的にその担い手はタンパク質であることが多く、シグナル伝達因子と呼ぶ。 - 9.3型自然免疫リンパ球
自然免疫リンパ球はリンパ球系に属する細胞であるが、抗原特異的な免疫応答は誘導されず、T細胞受容体およびB細胞受容体を発現しない。3型自然免疫リンパ球はIL-22を産生する主要な細胞集団であり、消化器系をはじめとする粘膜組織に多くみられる。 - 10.STAT3
サイトカイン、増殖因子、ホルモンなどのシグナルを、細胞膜上の受容体から核まで伝達する細胞内情報伝達分子。核に入った後は、転写因子としてDNAに結合して遺伝子の発現を制御する。7種類のSTATが報告されており、それぞれ異なる刺激により活性化される。STAT3は、IL-6ファミリーのサイトカインや、上皮成長因子(EGF)などの増殖因子の刺激で活性化される。
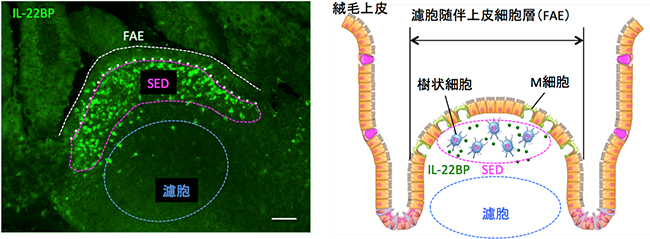
図1 パイエル板におけるIL-22結合タンパク質(IL-22BP)の発現とその模式図
左:パイエル板の組織切片を抗IL-22BP抗体を用いて免疫染色を行ったところ、濾胞随伴上皮細胞層(FAE)に近接するドーム下領域(SED)において、IL-22BP陽性細胞(明るい緑の点)が多数みられた。パイエル板には、SEDと濾胞が含まれる。スケールバーは20マイクロメートル(μm、1μmは1,000分の1mm)。
右:IL-22BPはパイエル板のSEDに分布する樹状細胞で産生される。FAEには、細菌抗原の取り込み口として働くM細胞が含まれる。
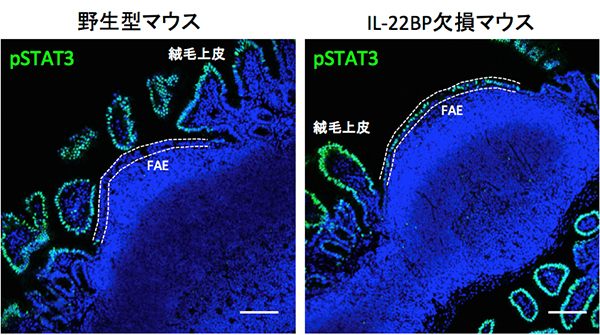
図2 野生型とIL-22BP欠損マウスのFAEにおけるIL-22シグナル活性化の評価
野生型およびIL-22BP欠損マウスにIL-22を投与し、15分後にリン酸化STAT3(pSTAT3)の発現(緑の明るい点)を顕微鏡観察することにより、IL-22シグナルの活性化を評価した。スケールバーは40μm。
左:野生型マウスでは、絨毛上皮細胞でpSTAT3のシグナルが観察されたが、濾胞随伴上皮細胞層(FAE、白い破線の間)では観察されなかった。
右:IL-22BP欠損マウスでは、絨毛上皮細胞に加えてFAEにおいてもpSTAT3が観察された。これによりFAEにおいて、IL-22シグナルが活性化されたことが分かった。
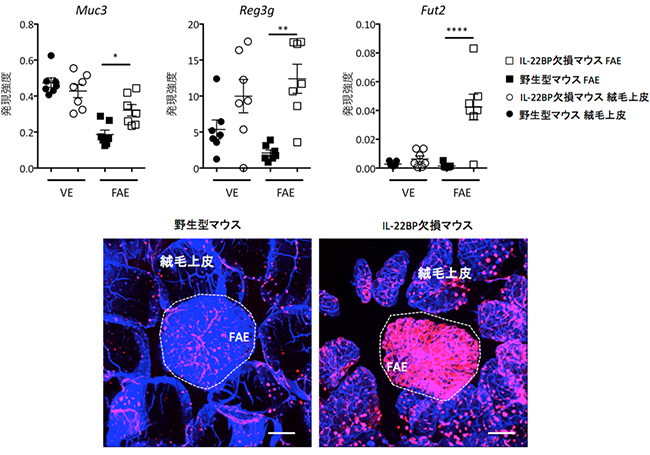
図3 IL-22BP欠損マウスのFAEでの遺伝子発現解析と顕微鏡画像
グラフ:野生型およびIL-22BP欠損マウスから絨毛上皮(VE)と濾胞随伴上皮細胞層(FAE)を分離し、遺伝子発現を解析した。IL-22BP欠損マウスでは粘液(Muc3)、抗菌タンパク質(Reg3g)の産生、上皮細胞表面のフコシル化(Fut2)を制御する遺伝子の発現が亢進された。グラフ中の*印は横線で示した比較における統計学的な有意差を示す。*の数が多いほど差が大きい。
画像:野生型およびIL-22BP欠損マウスのパイエル板のFAE(白い破線内)におけるフコシル化をレクチン染色で評価したところ、IL-22BP欠損マウスにおいて著しいフコシル化が観察された(ピンク色の部分)。
