要旨
理化学研究所(理研)統合生命医科学研究センター免疫器官形成研究グループの古関明彦グループディレクター、増井修研究員らの国際共同研究チーム※は、マウスを用いて、エピジェネティクス[1]制御因子であるポリコーム複合体[2]が、不活性X染色体の形成過程に重要な役割を果たすことを発見しました。
哺乳類の性染色体の構成は、雄はXY、雌はXXであるため、雌ではX染色体の遺伝子が雄の2倍あります。Y染色体の遺伝子は50個ほどなのに対して、X染色体には1,000個ほどあります。そのため、雌雄間でX染色体の遺伝子量(転写量)の差を補正するメカニズムを進化させたと考えられています。それが、雌がX染色体の1本を不活性化する「X染色体不活性化[3]」です。X染色体不活性化には、Xist遺伝子[4]の転写産物である「Xist RNA[4]」が必須ですが、Xist RNAがX染色体の各遺伝子の転写を抑制するメカニズムについてはよく分かっていませんでした。
今回、国際共同研究チームは、タンパク質PCGF3またはPCGF5(PCGF3/5)に着目し、PCGF3/5がマウスの不活性X染色体上に蓄積することを明らかにしました。PCGF3/5はポリコーム複合体「PCGF3/5-PRC1[5]」を形成し、ゲノムDNAに働きかけて転写を抑制すると考えられています。次に、Pcgf3/5遺伝子を欠失させてPCGF3/5-PRC1を形成できないノックアウトマウス[6]を作製して詳しく解析したところ、雌の胎児に特異的な致死性を示すことが分かりました。また、Pcgf3/5遺伝子を欠失したマウスES細胞(胚性幹細胞)[7]では、PCGF3/5-PRC1だけでなく、もう一つのポリコーム複合体PRC2[8]もXist RNAが蓄積する領域から消失し、Xist RNAが標的遺伝子の転写を抑制できないことが分かりました。これらの結果から、これまで、Xist RNAは PRC2を呼び込んだ後にPRC1を不活性X染色体上に蓄積させると考えられていましたが、Xist RNAはまずPCGF3/5-PRC1を呼び込み、その後でPRC2を呼び込むことが示されました。また、Xist RNAが持つ標的遺伝子に対する転写抑制能力に、PCGF3/5-PRC1が重要な役割を果たしていると結論づけられました。
本成果により、長らく謎であったX染色体不活性化のメカニズムの一端が明らかになりました。今後さらに研究が進むことによって、哺乳類が獲得してきたX染色体不活性化という高度な制御を受ける生命現象の理解がさらに進むと期待されます。
本研究は、米国の科学雑誌『Science』(6月9日号)に掲載されます。
※国際共同研究チーム
理化学研究所 統合生命医科学研究センター 免疫器官形成研究グループ
グループディレクター 古関 明彦(こせき はるひこ)
研究員 増井 修(ますい おさむ)
テクニカルスタッフⅡ 古関 庸子(こせき ようこ)
オックスフォード大学
教授 ニール・ブロックドルフ(Neil Brockdorff)
大学院生 マファルダ・アルメイダ(Mafalda Almeida)
かずさDNA研究所 技術開発研究部 染色体工学チーム
チーム長 中山 学(なかやま まなぶ)
背景
哺乳類の性染色体の構成は、雄はXY、雌はXXであるため、雌ではX染色体の遺伝子が雄の2倍あります。Y染色体には精子形成や性決定に関わる遺伝子が50個ほどあるだけなので、哺乳類の生存にはY染色体の有無はあまり影響しません。しかし、X染色体には生存に不可欠なものも含めて1,000個ほどの遺伝子があります。そのため、雌雄間でX染色体の遺伝子量(転写量)の差を補正するメカニズムを進化させたと考えられています。それが「X染色体不活性化」です。すなわち、雌は2本あるX染色体のうちの1本を不活性化し、機能するX染色体を雄と同じ1本になるようにします。不活性化されたX染色体を「不活性X染色体」といいます。
不活性X染色体は、X染色体上にあるXist遺伝子が転写するノンコーディングRNA[9]である「Xist RNA」が、X染色体を包み込むように蓄積してクロマチン[10]上にさまざまなエピジェネティクス修飾因子と呼ばれるタンパク質群を呼び込み、クロマチンが高度に凝集したヘテロクロマチン[11]となることによって形成されると考えられています。それらのエピジェネティクス修飾因子には、ポリコーム複合体PRC1とPRC2があります。両者とも酵素活性を持ち、クロマチンを構成するヒストン[12]に化学修飾を付加して、近くの標的遺伝子の転写を抑制することが知られています。
これまで考えられてきたXist RNAのX染色体不活性化における分子機構では、Xist RNAが直接PRC2に結合して、ヒストンH3の27番目リジン残基にメチル基を付加した後に、このメチル化されたヒストンH3が目印となってPRC1を呼び込み、PRC1はヒストンH2Aの119番目のリジン残基にユビキチン化[13]という化学修飾を誘導するとされてきました(図1)。しかし、この分子機構の全体像を実験的に証明したという報告はありませんでした。
また、最近の研究からPRC1にはその構成タンパク質の種類の違いから四つのサブタイプがあることが分かっており(図2)、それぞれが異なる機能を持つと考えられています。しかし、PRC1のどのサブタイプが不活性X染色体上に蓄積するか、またそれらがX染色体不活性化にどのような役割を持つのかはよく分かっていませんでした。
研究手法と成果
ポリコーム複合体PRC1の四つのサブタイプは、PCGF1~6のタンパク質のどれが含まれるかによって区別されますが、共通のサブユニットとしてタンパク質RING1A/Bを持っています。RING1A/BはPRC1により触媒されるヒストンのユビキチン化を直接行うタンパク質です。
国際共同研究チームはまず、PCGF1~6のそれぞれに緑色蛍光タンパク質(GFP)を結合させたマウスES細胞(胚性幹細胞)を作製し、細胞核内でのXist RNAとGFPの位置関係を蛍光顕微鏡により調べました。その結果、PCGF3とPCGF5が最も高頻度かつ近距離にXist RNAと共局在することが分かりました。PCGF3とPCGF5は、アミノ酸配列の相同性が高いことから、互いに機能的補完性を持つと推定されています。実際に、PCGF3またはPCGF5が含まれるPRC1はその構成タンパク質が完全に一致することから、「PCGF3/5-PRC1」と呼ばれています。
次に、Pcgf1~6のそれぞれの遺伝子を欠失させたマウスES細胞を作製し、これらのES細胞においてXist RNAの発現を人為的に誘導できる実験系を構築しました。対照には、いずれのPcgf遺伝子も欠失していない親株のES細胞を用いました。これらのES細胞にXist RNAを誘導発現させると、対照の親株ES細胞では、細胞核内でXist RNAが蓄積した領域にPRC1とPRC2が蓄積していました。ところが、Pcgf3とPcgf5の両遺伝子を欠失したES細胞では、Xist RNAの蓄積領域にPRC1とPRC2は両方とも蓄積していませんでした。一方、Pcgf1遺伝子を欠失したES細胞では、親株ES細胞と同様にXist RNAの蓄積領域にPRC1とPRC2が蓄積していました。これらの結果から、不活性X染色体上に存在するPRC1の主なサブタイプは、PCGF3/5-PRC1であることが示されました。
また、上述のようにPCGF3/5-PRC1が消失したES細胞では、PRC2もXist RNAの蓄積領域から消失しましたが、逆にPRC2を消失したES細胞では、PCGF3/5-PRC1は消失しませんでした。このことから、PRC2の蓄積はPCGF3/5-PRC1に依存していることが示されました。
さらに、同様の現象がマウスの体外で培養したES細胞だけでなく、マウス個体でも生じるかを検証するため、以下の実験を行いました。Pcgf3とPcgf5の両遺伝子を欠失したノックアウトマウスを作製し、これらのマウスを交配してできた胎児を解析したところ、雄の胎児に比べて雌の胎児がより早い段階で死亡することを見いだしました。このとき、雄の胎児に付属する胎盤に比べて、雌の胎児に付属する胎盤の形成は不完全でした。このことから、雌に特異的に生じるX染色体不活性化に異常が生じていたことが強く示唆されました。
また、この雌の胎児の個々の細胞核を解析したところ、ES細胞で観察されたときと同様に、PCGF3/5-PRC1とPRC2の両方が不活性X染色体上から消失していることが分かりました(図3)。
以上の結果から、Xist RNAはまずPCGF3/5-PRC1を呼び込み、その後にPRC2を呼び込むと考えられ、これまで考えられてきた分子機構とは異なる新しい分子機構が存在することが示されました(図4)。
さらに、Xist RNAが標的遺伝子の転写を抑制する機能に、PCGF3/5-PRC1がどのような役割を果たしているかを調べました。マウスの16番染色体からXist RNAを人為的に誘導発現させることができるES細胞では、16番染色体上の各遺伝子の転写が抑制されます。Pcgf3とPcgf5の両遺伝子を欠失させたマウスES細胞で、16番染色体上の各遺伝子の転写量を測定しました。その結果、転写量はほとんど減少していなかったことから、Xist RNAによる16番染色体上の各遺伝子の転写抑制は十分に起こらなかったことが分かりました。このことからPCGF3/5-PRC1は、本来の不活性X染色体の形成過程において、Xist RNAが標的遺伝子の転写を抑制する段階で作動することが示されました。
今後の期待
本成果は、ヒトを含む哺乳類が長い進化の過程で獲得してきたX染色体不活性化という生命現象の全容解明につながると期待できます。また、今回見いだした「Xist RNAがPCGF3/5-PRC1を介してPRC2を標的部位に呼び込み標的遺伝子の転写を抑制する」という分子機構は、Xist RNAと類似した他のノンコーディングRNAにも共通した、より普遍的なエピジェネティクスの分子機構である可能性が考えられ、今後検証される必要があります。
原論文情報
- Mafalda Almeida, Greta Pintacuda, Osamu Masui, Yoko Koseki, Michal Gdula, Andrea Cerase, David Brown, Arne Mould, Cassandravictoria Innocent, Manabu Nakayama, Tatyana B. Nesterova, Lothar Schermelleh, Haruhiko Koseki, and Neil Brockdorff, "PCGF3/5-PRC1 initiates Polycomb recruitment to facilitate gene silencing in X chromosome inactivation", Science, doi: 10.1126/science.aal2512
発表者
理化学研究所
統合生命医科学研究センター 免疫器官形成研究グループ
グループディレクター 古関 明彦(こせき はるひこ)
研究員 増井 修(ますい おさむ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
補足説明
- 1.エピジェネティクス
遺伝情報を伝達するゲノムDNAの塩基配列自体には変更を加えずに、DNA塩基やゲノムを構成するタンパク質に化学修飾して、ゲノムDNAの機能を調節する分子機構のこと。 - 2.ポリコーム複合体
昆虫からヒトに至るまで保存されているタンパク質複合体。PRC1とPRC2に大別される。標的とするクロマチン領域に結合して、その部分にエピジェネティクス化学修飾することで周辺に存在する遺伝子からの転写を抑制する。 - 3.X染色体不活性化
英国の遺伝学者故Mary F. Lyon博士により発見された生命現象。哺乳類の雌の細胞で2本のX染色体のどちらか1本の染色体全体が、転写不活性化を受ける現象をいう。X染色体からの遺伝子転写量を雌雄間で補正して調節する役割を持つ。 - 4.Xist遺伝子、Xist RNA
Xist遺伝子はX染色体不活性化に必須の遺伝子として同定された。Xist RNAは、 Xist遺伝子から転写されるノンコーディングRNAで、X染色体を覆うように蓄積することにより転写を抑制する。最終的にX染色体上のほとんどの遺伝子発現が抑制されることにより、X染色体不活性化が完成する。 - 5.PRC1
ポリコーム複合体の一種。ヒストンH2Aの119番目のリジン残基をユビキチン化して、近傍遺伝子の転写を抑制すると考えられている。不活性X染色体上に蓄積する。近年、構成タンパク質の異なる四つの複合体として存在することが提唱されている。 - 6.ノックアウトマウス
遺伝子操作により、ゲノム上の特定の遺伝子が欠失しているマウス。 - 7.ES細胞(胚性幹細胞)
ほ乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製した細胞株で、体を構成する全ての種類の細胞に分化する能力(多能性)を持つもの。 - 8.PRC2
ポリコーム複合体の一種。ヒストンH3の27番目のリジン残基をメチル化して、近傍遺伝子の転写を抑制すると考えられている。不活性X染色体上に蓄積する。 - 9.ノンコーディングRNA
タンパク質を構成するアミノ酸配列をコードするmRNAに対して、それらをコードしないRNAをいう。ノンコーディングRNA自身が何らかの機能を持つ場合が多い。 - 10.クロマチン
真核生物において、遺伝情報を担うゲノムDNAとそれに付属するヒストンなどの各種タンパク質との複合体のこと。 - 11.ヘテロクロマチン
クロマチンが凝集した領域のこと。この領域内に存在する遺伝子はRNA転写が不活性であると考えられている。 - 12.ヒストン
真核生物でゲノムDNAに結合して染色体を作るタンパク質群。ヒストンH1、H2A、H2B、H3、H4の5種類が知られている。さまざまな場所でメチル化、アセチル化、リン酸化など多種類の化学的修飾を受け、それにより遺伝子の働きが制御される。 - 13.ユビキチン化
ユビキチンは他のタンパク質の修飾に使われるタンパク質。タンパク質分解、DNA修復、転写調節、シグナル伝達などさまざまな生命現象に関わる。ユビキチン化とはタンパク質修飾の一種で、ユビキチンリガーゼなどの働きによりユビキチンタンパク質が基質タンパク質に付加されること。ユビキチンが複数連なったポリユビキチン鎖の修飾を受けたタンパク質は、通常選択的にプロテアソームで分解される。
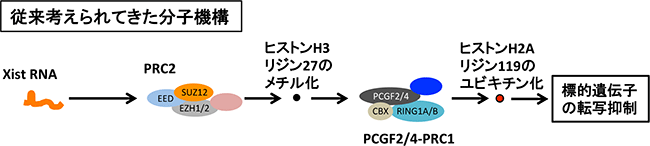
図1 従来のX染色体不活性化におけるXist RNAの分子機構
Xist RNAが直接、ポリコーム複合体PRC2に結合して、ヒストンH3の27番目のリジン残基にメチル基を付加する。その後、メチル化されたヒストンH3が目印となって、PRC1(PCGF2/4-PRC1)を呼び込む。PRC1は、ヒストンH2Aの119番目のリジン残基にユビキチン化という化学修飾を誘導し、近くの標的遺伝子の転写抑制に寄与すると従来は考えられてきた。
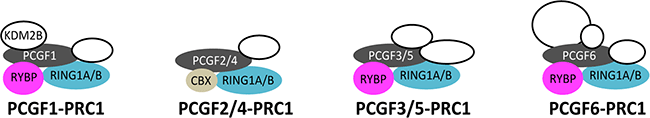
図2 PRC1の四つのサブタイプ
タンパク質複合体のPRC1には四つのサブタイプが存在し、それぞれ含まれるPCGF1~6のタンパク質により区別される。PCGF2/4-PRC1はPCGF2またはPCGF4が含まれるPRC1を、PCGF3/5-PRC1はPCGF3またはPCGF5が含まれるPRC1を意味する。
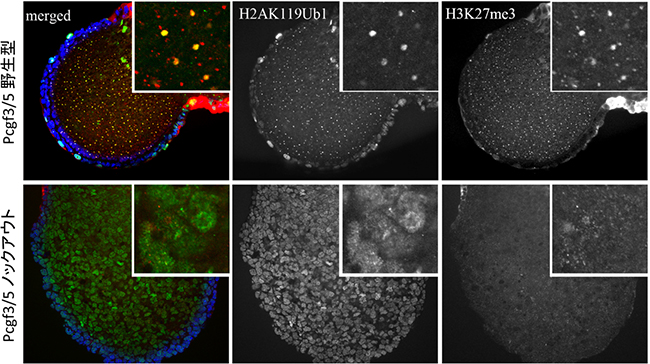
図3 Pcgf3/5ノックアウトマウス胎児の免疫染色像
野生型またはPcgf3/5ノックアウトマウス由来の雌の胎児(7.5日目胚)を免疫染色により解析した。免疫染色にはユビキチン化されたヒストンH2A(H2AK119Ub1)、並びにメチル化されたヒストンH3(H3K27me3)に対する抗体を用いた。両シグナルはそれぞれPRC1とPRC2により触媒されるので、これら二つのポリコーム複合体の局在状態を示す。野生型の雌では、両シグナルは細胞核内に単一のスポットとして現れ、不活性X染色体上へ局在した(上段)。一方、Pcgf3/5遺伝子をノックアウトした雌の胎児では、両シグナルはそのスポット状の局在性を喪失して細胞核内に分散した染色像を示した(下段)。各パネルの右上部分には胎児の一部を拡大した画像を示している。青:細胞核染色、緑:H3K27me3染色、赤:H2AK119Ub1染色
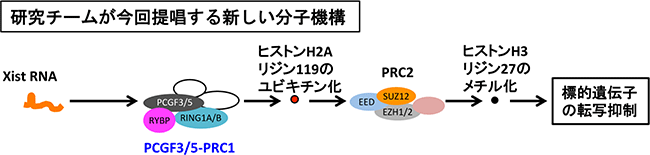
図4 新しいXist RNAのX染色体不活性化における分子機構
Xist RNAはまずPCGF3/5-PRC1を呼び込み、ヒストンH2Aの119番目のリジン残基をユビチキン化する。その後でPRC2を呼び込み、ヒストンH3の27番目のリジン残基をメチル化し、標的遺伝子の転写を抑制するという新しい分子機構が示された。
