要旨
理化学研究所(理研)望月理論生物学研究室の黒澤元研究員と望月敦史主任研究員らの共同研究チーム※は、体内時計が温度に影響されない仕組みに関する新たな仮説「温度-振幅カップリング」を提唱しました。
一般に、細胞の増殖などの生体プロセスは、温度が上がると速くなります。それに対して、体内時計の周期[1]はほとんど温度に影響されません。この体内時計の温度補償性と呼ばれる性質は、体内時計の研究が始まった1950年代から大きな謎とされてきました。
共同研究チームは、体内時計に関わる遺伝子やタンパク質の1日のリズムの変動を記述する数理モデル[2]を用いて、温度が上昇して反応が速くなっても周期は一定となる条件を探しました。そして体内時計の周期を一定に保つためには、温度上昇とともにリズムの振れ幅を大きくする必要があることを見つけ、「温度-振幅カップリング」と名付けました。この仮説が正しいとすると、実際の生物を用いてリズムの振れ幅を観測すれば、高い温度で大きな振れ幅になるはずです。そこでラットの培養細胞を用いて、遺伝子活性リズムを異なる温度で計測しました。その結果、予測していた通り、体内時計に関わる主要な遺伝子は高い温度で振れ幅の大きい活性リズムを刻んでいました。
今回、理論と実験を組み合わせた研究により、体内時計が温度に影響されない仕組みとして温度-振幅カップリングが有力であることを示しました。今後、さまざまな生物種で体内時計の温度補償性の仕組みが研究されることによって、体内時計の設計原理の進化が明らかになると期待できます。
本研究成果は、米国のオンライン科学誌『PLOS Computational Biology』(6月8日付け:日本時間6月9日)に掲載されます。
※共同研究チーム
理化学研究所 望月理論生物学研究室
研究員 黒澤 元(くろさわ げん)(数理創造プログラム 研究員)
主任研究員 望月 敦史(もちづき あつし)(理論科学連携研究推進グループ階層縦断型理論生物学研究チーム チームリーダー)(数理創造プログラム 副プログラムディレクター)
近畿大学 医学部
教授 重吉 康史(しげよし やすふみ)
講師 鯉沼 聡(こいぬま さとし)
研究員 藤岡 厚子(ふじおか あつこ)
背景
体内時計は、睡眠覚醒のタイミングや成長ホルモン分泌のタイミングを制御している約1日のリズムです。これまでの研究により、体内時計に必須な遺伝子(体内時計遺伝子)が多数発見されてきました。体内時計遺伝子の活性は約1日周期で変動し、この遺伝子活性リズムが体内時計を動かしています。
遺伝子活性リズムを作り出すのは、合成や分解などの化学反応です。化学反応の多くは、温度が10℃上がると反応速度は2~3倍になります。体内時計の部品である化学反応が温度上昇とともに速くなるのなら、体内時計の刻みは温度依存となり、高温では周期が短くなりそうです。しかし、実際にはどういうわけか、温度が上がっても体内時計の周期はほぼ一定です。この体内時計の性質は温度補償性と呼ばれ、体内時計の研究が始まった1950年代から大きな謎とされてきました。
研究手法と成果
共同研究チームはまず、体内時計に関わる遺伝子やタンパク質の1日のリズムの変動を記述する数理モデルを用い、体内時計が温度に影響されない仕組みに迫りました。そして体内時計の周期を一定に保つためには、温度上昇とともにリズムの振れ幅を大きくする必要があることを見つけました。もともと温度上昇とともに化学反応が速くなると、周期は短くなる傾向があります(図1)。高い温度で振れ幅を大きくすることにより、周期が短くなる傾向を相殺することができました(図1、2)。共同研究チームはこの温度補償性を説明する仕組みを、「温度-振幅カップリング」と名付けました。
数理モデルの結果が正しいとすると、体内時計を持つ生物において高い温度で大きな振幅の振動が観測されるはずです。この仮説を検証するため、ラットの培養細胞を用いて、体内時計で重要とされている7遺伝子の活性リズムをqPCR法[3]により異なる温度で計測しました。その結果、遺伝子活性リズムの周期は、温度が変わってもほぼ一定でした。それに対して、遺伝子活性リズムの振れ幅は、多くの遺伝子で温度上昇とともに大きくなっていました(図3)。以上の培養細胞を用いた実験結果により、温度-振幅カップリングが実際に確かめられました。共同研究チームは、理論と実験を組み合わせた研究により、体内時計が温度に影響されない仕組みとして温度-振幅カップリングが有力であることを示しました。
今後の期待
体内時計が温度に影響されない温度補償性は、恒温動物/変温動物を問わず、体内時計を持つあらゆる生物種が示す普遍的な性質です。今回、数理モデルと哺乳類の培養細胞を用いた実験を組み合わせることで、温度-振幅カップリングが温度補償性の仕組みとして有力であることを示しました。
現在のところ、温度-振幅カップリングが多くの生物種に普遍的な温度補償性の仕組みなのか、それとも培養細胞に特有なものなのかは全く不明です。今後、さまざまな生物種で温度補償性の仕組みが研究されることによって、体内時計の設計原理の進化が明らかになると期待できます。
原論文情報
- Gen Kurosawa, Atsuko Fujioka, Satoshi Koinuma, Atsushi Mochizuki, Yasufumi Shigeyoshi, "Temperature-amplitude coupling for stable biological rhythms at different temperatures", PLOS Computational Biology, doi: 10.1371/journal.pcbi.1005501
発表者
理化学研究所
主任研究員研究室 望月理論生物学研究室
研究員 黒澤 元(くろさわ げん)
(数理創造プログラム 研究員)
主任研究員 望月 敦史(もちづき あつし)
(理論科学連携研究推進グループ階層縦断型理論生物学研究チーム チームリーダー)
(数理創造プログラム 副プログラムディレクター)
 黒澤元
黒澤元
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
補足説明
- 1.体内時計の周期
温度や光条件が変化しない環境に生物をおいたときに観測される約1日の周期で、フリーラン周期と呼ばれる。 - 2.数理モデル
数学的手法を用いて生命現象をシミュレーションするモデルのこと。 - 3.qPCR法
定量ポリメラーゼ連鎖反応法の略。遺伝子活性(mRNAの量)を計測する手法。
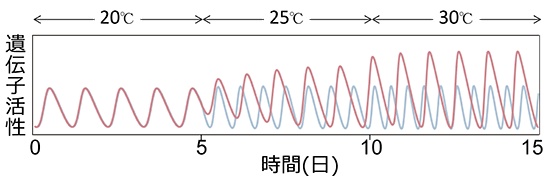
図1 数理モデルから予測された温度に影響されない体内時計の仕組み
体内時計の遺伝子ネットワークモデルを用いた温度補償性シミュレーション。温度が上がると反応が速くなると仮定すると、計算した周期は短くなる傾向があった(水色)。一方で、温度が上がっても周期が一定となる場合は、リズムの振れ幅が大きくなっていた(桃色)。温度に影響されない体内時計を実現するためには、温度とともに振れ幅は大きくなる必要があると予測された。
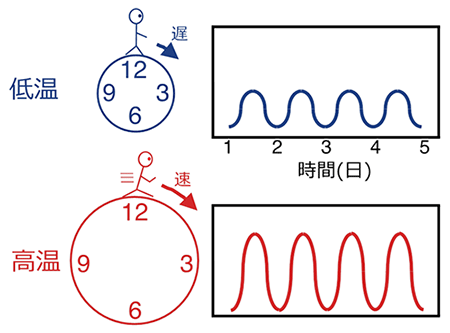
図2 体内時計が温度に影響されない仕組み(イメージ)
体内時計の部品は化学反応である。温度が上がると反応が速くなって、時計の針は進みやすい。温度上昇とともにリズムの振れ幅を大きく(1日に進む道のりを長く)することで、温度に影響されずに時を刻める。
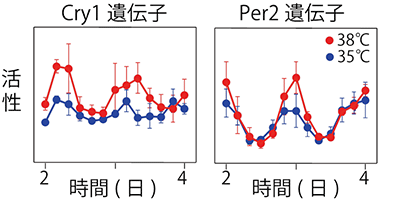
図3 ラット培養細胞における体内時計遺伝子の活性リズムとその温度依存性
35℃(青)と38℃(赤)と環境の温度を変えても、主要な体内時計遺伝子(Cry1遺伝子とPer2遺伝子)の活性リズム周期はほとんど変化しない。それに対して活性の振れ幅(振幅)は、温度とともに大きくなった。
