要旨
理化学研究所(理研)生命システム研究センター合成生物研究グループの上田泰己グループディレクター、篠原雄太特別研究員、小山洋平研究員らの共同研究グループ※は、哺乳類の概日時計[1](体内時計)の周期長を決定しているリン酸化酵素の“基質との結合”および“生成物との結合”の二つの結合の強弱が温度によって変化し、高温でのリン酸化反応速度の上昇にブレーキをかけることが、概日時計の温度補償性[2]に重要であることを解明しました。
地球上の多くの生物種には、1日約24時間周期の概日リズム[1]が備わっています。概日時計の特徴の一つである温度補償性(周期長が温度に依存せず常に一定であること)は、ショウジョウバエの羽化リズムが温度に依存しないことに着目した研究により、1950年代に明らかになりました。しかし、温度補償性の詳しい分子機構は分かっておらず、大きな謎とされてきました。
今回、共同研究グループは、生化学実験と実験データに基づいた数理モデル[3]により、リン酸化酵素カゼインキナーゼⅠδ(CKⅠδ)の“高温でCKⅠδ-ATP(アデノシン三リン酸)複合体と基質との結合が弱くなる”ことと“高温でCKⅠδ-ADP(アデノシン二リン酸)複合体と生成物との結合が強くなる”ことの二つの結合メカニズムが、温度に依存しないリン酸化反応を実現していることを突き止めました。また、低分子化合物とCKⅠδ変異体による遺伝学的なアプローチにより、温度依存的な生成物結合を阻害すると、マウス概日時計に温度依存性が表れたことから、温度補償性には温度依存的な生成物結合が重要であることが分かりました。さらに、出芽酵母などに進化的に保存されているCKⅠファミリー[4]に特異的な領域を温度依存的なリン酸化酵素(TTBK1)に挿入することで、温度に依存しないリン酸化反応の再構成にも成功しました。
今後、高温で基質結合の親和性の低下や高温で生成物結合の親和性の上昇を酵素において再現できれば、高温で安定な酵素の設計やリン酸化活性が制御できると考えられます。また、本研究で発見した低分子化合物や、概日リズムの周期を短くするCKⅠδ変異体は、概日時計の周期長を制御できるため、時差ボケなどの概日リズム睡眠障害[5]などの治療法の開発につながると期待できます。
本研究成果は、米国の科学雑誌『Molecular Cell』(9月7日号)に掲載されます。
本研究は、日本学術振興会科学研究費補助金基盤研究(S)「哺乳類概日振動体の構成的な理解」(研究代表者:上田泰己)および特別研究員奨励費「合成生物学的アプローチによる哺乳類概日時計の温度補償性の理解」(研究代表者:篠原雄太)、文部科学省「ポスト「京」で重点的に取り組むべき社会的・科学的課題に関するアプリケーション開発・研究開発」重点課題:生体分子システムの機能制御による革新的創薬基盤の構築の一環で行われました。
※共同研究グループ
理化学研究所
生命システム研究センター 細胞デザインコア 合成生物学研究グループ
グループディレクター 上田 泰己(うえだ ひろき)(東京大学大学院 医学系研究科 機能生物学専攻 教授)
特別研究員 篠原 雄太(しのはら ゆうた)
研究員 小山 洋平(こやま ようへい)
テクニカルスタッフⅠ 鵜飼(蓼沼)磨貴(うかい (たでぬま) まき)
上級研究員 山田 陸裕(やまだ りくひろ)
上級研究員 鵜飼 英樹(うかい ひでき)
テクニカルスタッフⅠ 藤島 博史(ふじしま ひろし)
ライフサイエンス技術基盤研究センター エピジェネティクス制御研究ユニット
研究員 菊地 正樹(きくち まさき)
ユニットリーダー 梅原 崇史(うめはら たかし)
産業技術総合研究所 創薬分子プロファイリング研究センター
分子シミュレーションチーム
研究チーム長 広川 貴次(ひろかわ たかつぐ)(筑波大学大学院 人間総合科学研究科 医学系専攻 教授)
東京大学大学院 医学系研究科 機能生物学専攻
講師(研究当時) 田井中 一貴(たいなか かずき)(現 新潟大学 脳研究所 特任教授)
背景
地球上の多くの生物種には、1日約24時間の概日時計(体内時計)が備わっています。概日時計の特徴の一つである温度補償性(周期長が温度に依存せず常に一定であること)は、ショウジョウバエの羽化リズムが温度に依存しないことに着目した研究により、1950年代に明らかになりました。この温度補償性の機構はさまざまな分野の研究者から注目を集めましたが、その詳しい分子機構は大きな謎とされてきました。
2009年、上田グループディレクターらはリン酸化酵素の一種であるカゼインキナーゼⅠδ(CKⅠδ)によるリン酸化反応が、哺乳類の概日時計の周期長を決定していることを発見し、そのリン酸化反応が温度に依存せずに常に一定であることを突き止めました注1)。一般的な生体内の生化学反応は温度が10℃上がると、反応速度は2~3倍速くなります。しかし、CKⅠδのリン酸化反応は一般的な生化学反応とは異なり温度に依存せず、その反応機構は明らかになっていません。
そこで共同研究グループは、温度に依存しないリン酸化反応機構を理解するために、(1)システム生物学[6]的に温度に依存しないリン酸化反応機構の解明、(2)低分子化合物とアミノ酸変異の導入を介した、同定した素過程への摂動(生成物結合の抑制)による温度補償性の制御、(3)温度に依存しない酵素反応を再構成することで温度補償性の分子機構を理解する、という計画を立てました。
注1)2009年9月1日プレスリリース「体内時計をつかさどる「時間の定規」を発見」
研究手法と成果
(1)温度に依存しないリン酸化反応機構の解明
酵素CKⅠδの反応相手(基質)である時計タンパク質[7]PER1/2には、リン酸化されるセリン残基やスレオニン残基が複数含まれているためリン酸化反応の解析は複雑です。一方、共同研究グループは今回、基質のアミノ酸配列中にセリン1残基を含む単純なペプチド(14個のアミノ酸配列)でも、リン酸化反応に必要なアデノシン三リン酸(ATP)存在下で、温度に依存しないリン酸化反応が起こることを発見しました。この反応において、ミカエリス・メンテン式[8]により酵素の親和性を示すミカエリス定数(Km)[8]を求めると、高温でKmが大きくなりました。これは、CKⅠδと基質の結合が温度に依存しており、高温で弱くなることを示しています(図1上段)。
次に、CKⅠδとセリン2残基のうち片方がリン酸化されているペプチド(14個のアミノ酸配列)を用いて、2個目のリン酸化反応を速度論解析しました。等温滴定型カロリメトリー[9]を用いて、2個のリン酸基が付加された生成物とCKⅠδとアデノシン二リン酸(ADP)を加えて結合定数を測定しました。すると、CKⅠδは温度依存的に生成物と強く結合し、その結合は高温で強くなることが分かりました。また、質量分析[10]により反応解析すると、CKⅠδには脱リン酸化活性があることが分かりました。さらに、CKⅠδは基質が存在しない環境下でもATPを加水分解してADPに変換させ(ATPase反応)、リン酸化反応中はATPとADPが混在していることを発見しました。これらの結果を総合的に考えると、多段階なリン酸化反応では、温度依存的な生成物結合がリン酸化のブレーキになることが、温度補償性に重要であるといえます(図1下段)。
続いて、リン酸化反応機構のうち、どの過程が温度補償性に重要であるかを明らかにするために、各素過程を変化させたときに温度補償性が保たれるかを検証するための数理モデルを構築しました。マルコフ連鎖モンテカルロ法[11]を用いたシミュレーションの結果、“基質であるペプチドに1個目のリン酸基が付加するリン酸化の温度補償性には、CKⅠδ-ATP複合体と基質の間の結合が高温で弱くなることが重要”であることが分かりました(図1上段)。また、“2個目のリン酸基が付加するリン酸化(特にリン酸基が1個付加されたペプチドの量が多い場合)の温度補償性には、CKⅠδ-ADP複合体とリン酸基が2個付加された生成物の間の結合が高温で強くなることが重要”であることが分かりました(図1下段)。
このように、生化学実験と数理モデルのシミュレーションの両面から、“CKⅠδ‐ATP複合体と基質の結合が高温で弱くなる”ことと“CKⅠδ‐ADP複合体と生成物との結合が高温で強くなる”ことの二つのメカニズムにより、温度に伴う反応速度の上昇にブレーキがかかることがリン酸化反応の温度補償性に重要であることを解明しました。
(2) 温度依存的な生成物結合の抑制による温度補償性の制御
共同研究チームは、温度依存的な生成物結合の過程を低分子化合物で阻害することで、温度に依存しないリン酸化反応に温度依存性を持たせることを試みました。LOPAC1280ケミカルライブラリー[12]を用いて、CKⅠδの脱リン酸化活性を阻害するケミカルスクリーニングを行い(図2上段)、生成物結合を特異的に阻害するアウリントリカルボン酸(ATA)を発見しました。実際に、このATAをリン酸化反応中に加えるとリン酸化活性が向上し、リン酸化反応に温度依存性を持たせることに成功しました(図2下段)。
リン酸化反応中にATAがCKⅠδのどの部位に結合しているかを知るために、CKⅠδとATAの結合定数を等温滴定型カロリメトリーにより調べたところ、CKⅠδにATAが2分子、結合していることが分かりました。ATAはCKⅠδのATPase(ATP加水分解酵素)活性を阻害していることから、ATAの結合部位のうちの一つはATPの結合部位と同じであると推測できます。残りの結合部位を明らかにするために、ATPがあらかじめCKⅠδに結合した状態でATAとのドッキングシミュレーション[13]を行いました。その結果、ATAはCKⅠδの224番目のアミノ酸であるリジン(以下、K224)の周辺に最も強く結合すると予測できました(図3)。ATAはリン酸基が2個付加されたペプチドとCKⅠδの結合を阻害していて、このペプチドもK224の周辺に結合する、と考えました。
これまでに、リン酸基(H2PO4-)と構造が似ているタングステン酸イオン(WO42-)と硫酸イオン(SO42-)では、それらがCKⅠδと結合した立体構造がX線結晶構造解析[14]がそれぞれ報告されていました。これらの構造では結合部位が4カ所あることが知られていましたが、このうちの一つはATAが結合されると予測されたK224を含む部位でした(図3)。
次に、K224にアミノ酸変異を導入して、細胞系による実験でCKⅠδ変異体のリン酸化活性を調べたところ、K224D(224番目のリジンがアスパラギン酸に変異)とK224E(224番目のリジンがグルタミン酸に変異)のCKⅠδ変異体が、温度補償性を示すパラメーターであるQ10値[15]を上げていることが分かりました。つまりATAが結合すると強く示唆されている部位(K224周辺)が、細胞系の実験でも温度補償性に重要な部位であることが示されました。
そこで、CKⅠδのK224D変異体をコードする遺伝子を胚性幹細胞(ES細胞)[16]のROSA26と呼ばれる染色体の遺伝子領域に導入して、発生初期のマウス胚に移植することでES細胞由来の遺伝子改変マウス(K224D変異マウス)を作製しました。そして、K224D変異マウスの概日リズムの周期長を測定したところ、野生型マウスは23.7時間なのに対し、K224D変異マウスは19.6時間と短いことが分かりました(図4上段)。周期長が変化する時計タンパク質の変異体はtau変異体注2)など報告されていますが、今回発見したCKIδ変異体はこれまでで最も短周期でした。
また、マウスの概日時計の中枢組織である視交叉上核(SCN)を摘出後培養して、組織レベルでの温度補償性の検証実験を行いました。その結果、温度を7℃変化させたとき、野生型のSCNスライスでは周期長は0.3時間だけ変化したのに対し、K224D変異体では1.2時間変化していることが分かりました(図4下段)。このことから、温度依存的な生成物結合は、温度補償性を保持するために必要なプロセスであることが示されました。
注2) Lowrey et al., Positional syntenic cloning and functional characterization of the mammalian circadian mutation tau.Science, 288, 483-92, (2000).
(3)温度に依存しないリン酸化反応の再構成
共同研究チームは、マウス以外の生物種にも温度に依存しないリン酸化反応が保存されているという仮説を立てました。そこで酵母由来のCKⅠ homolog 1の温度変化に応じたリン酸化反応を測定したところ、マウスと同様にリン酸化反応に温度依存性はありませんでした。そこで、アミノ酸配列をCKⅠδやCKⅠδに極めて似ているアミノ酸配列を持つリン酸化酵素(CKⅠファミリー)と他のリン酸化酵素で比較すると、CKⅠファミリーには、他のリン酸化酵素にはない特異性が高い領域(固有の領域)がK224の近くに存在することが分かりました。
この領域について原子レベルでの役割を明らかにするために、CKⅠδの立体構造を用いた分子動力学シミュレーション[17]を行いました。その結果、K224周辺では構造変化(ゆらぎ)が他の領域に比べて大きく、低温(25℃)と高温(35℃)で構造のゆらぎの大きさに変化がみられました(図5左、中)。さらに、X線結晶構造解析により、CKⅠδとADPが結合した立体構造を新たに決定したところ、K224付近の領域のゆらぎが大きいことが分かりました(図5右)。このようにCKⅠファミリーに固有の領域を含むK224周辺の領域では構造のゆらぎが大きく、このゆらぎが温度により変化することで、CKⅠδと基質または生成物との結合の強さを調節していることが分かりました。
そこで、温度に依存するリン酸化反応を持つヒト由来のタウチューブリンキナーゼ1(TTBK1)に温度補償性の機能を付加することを試みました。出芽酵母などに進化的に保存されているCKⅠファミリー固有の領域を含むアミノ酸配列を、TTBK1に挿入したTTBK1(rMT)を作製しました。その結果、リン酸化反応の温度依存性が大幅に小さくなり、温度に依存しないリン酸化反応を再構成することに成功しました。このことから、CKⅠファミリー固有の領域は温度補償性に十分であることが分かりました(図6)。
今後の期待
本研究は、約60年間にわたって謎とされてきた温度補償性の分子機構を解明した、時間生物学分野を大きく進展させるものといえます。また、今後、CKⅠファミリーに特異的な領域を酵素において再現できれば、高温で安定な酵素の設計やリン酸活性が制御できると考えられます。特に温度補償性を持つ酵素の設計は、さまざまな酵素反応への温度補償性の付加や酵素活性の制御にも役立つものと期待できます。
また酵素活性を抑制する化合物は数多く発見されていますが、酵素活性を向上させる化合物はほとんど発見されていません。そのため今回発見した低分子化合物を探索するスクリーニング方法は、他の酵素の活性を向上させるアゴニスト(作動薬)探索の戦略になる可能性があります。
さらに、概日リズムの周期を短くするCKⅠδ変異体は、概日リズムの周期長を制御できるため、概日リズム睡眠障害や精神疾患などのメカニズムの解明や薬剤による治療法の開発にも貢献すると期待できます。
原論文情報
- Yuta Shinohara, Yohei M. Koyama, Maki Ukai-Tadenuma, Takatsugu Hirokawa, Masaki Kikuchi, Rikuhiro G. Yamada, Hideki Ukai, Hiroshi Fujishima, Takashi Umehara, Kazuki Tainaka and Hiroki R. Ueda, "Temperature-Sensitive Substrate and Product Binding Underlie Temperature-Compensated Phosphorylation in the Clock", Molecular Cell, doi: 10.1016/j.molcel.2017.08.009
発表者
理化学研究所
生命システム研究センター 細胞デザインコア 合成生物学研究グループ
グループディレクター 上田 泰己(うえだ ひろき)
特別研究員 篠原 雄太(しのはら ゆうた)
研究員 小山 洋平(こやま ようへい)
 上田 泰己
上田 泰己
 篠原 雄太
篠原 雄太
 小山 洋平
小山 洋平
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
補足説明
- 1.概日時計、概日リズム
シアノバクテリアからヒトに至るまで多くの生物種では、その生理活性や遺伝子発現は日周リズムを示す。この日周リズムは、時刻の手掛かりとなる外部環境(明暗、温度など)を一定にしても継続する。これは、体内に約24時間周期を発振する内在性の概日時計(体内時計)が存在することによる。哺乳類の場合、概日時計の中枢は脳の視床下部にある視交叉上核(SCN)に存在する。概日時計が生み出す約24時間周期の振幅振動を概日リズムという。 - 2.温度補償性
多くの生化学反応は温度により反応速度が大きく変わる。酵素反応の場合、温度を10℃上昇させれば反応速度はおよそ2倍以上速くなる。ところが、概日時計の周期は、外部温度がおおよそ27~37℃くらいの範囲で変化しても、ほとんど変化しない。この現象を温度補償性と呼ぶ。 - 3.数理モデル
ある現象の振る舞いを理解するために方程式を用いたモデルのこと。 - 4.CKⅠファミリー
カゼインキナーゼⅠ(CKⅠ)は、哺乳類では七つのアイソフォーム(α、β、γ1、γ2、γ3、δ、ε)が存在するモノマーのセリン・スレオニン・タンパク質リン酸化酵素。CKⅠファミリーは、DNA修復、細胞分裂、核の局在、膜輸送などの多くの細胞プロセスに関与している。 - 5.概日リズム睡眠障害
体内時計が昼夜の24時間リズムと合わなくなることで起きる睡眠障害。例えば内在性の概日リズムと外部環境が同調できないため夜になっても寝付けなかったり、朝起きられなかったりなどの症状が起きやすい。 - 6.システム生物学
生命現象を多数の要素が構成されるシステムとして考える学問。本研究では酵素反応の素過程を要素として考え、どの要素が温度補償性に重要なのかを同定した。 - 7.時計タンパク質
約24時間周期で遺伝子発現を繰り返しているタンパク質のこと。代表的なタンパク質としてPERやCRYがある。これらの時計タンパク質は、睡眠や代謝などさまざまな生理機能に携わっている。 - 8.ミカエリス・メンテン式、ミカエリス定数( Km)
酵素反応の速度を表す一般的な式。酵素反応の初速度 Vの基質依存性は多くの場合 V= kcat[E]0[S]/( Km+[S])という式で記述でき、この式をミカエリス・メンテン式という。ここで[E]0は酵素濃度、[S]は基質濃度を表す。また、 kcatと Kmをそれぞれ触媒定数およびミカエリス定数という。 kcatは基質濃度が高いときの酵素活性を示す。 Kmは基質との結合の強さに対応し、値が大きいほど基質との結合が弱いことを示す。 - 9.等温滴定型カロリメトリー
一定の温度下で滴定に伴う熱量変化を測定することができる精密装置。主にタンパク質間などの分子間相互作用の測定に用いる。 - 10.質量分析
分子の質量を測定する分析装置。リン酸化されたペプチドとペプチド基質の分子量が異なるため、本研究では質量分析を用いてCKⅠδがリン酸化ペプチドのリン酸基を外していることが検出できた。 - 11.マルコフ連鎖モンテカルロ法
望みの確率分布に従う確率変数をコンピューター上で発生させるための手法。本研究では実験の測定結果に近いと確率が高くなるような確率分布を用いて確率変数(速度パラメーター)を発生させた。本研究のマルコフ連鎖モンテカルロ法によるシミュレーションは、理化学研究所のスーパーコンピュータ(RICC)を用いて行われた。 - 12.LOPAC1280ケミカルライブラリー
シグマ・アルドリッチ社の化合物ライブラリー。1,280種の化合物のうち21種類は厚労省薬事法で輸入できないため、購入時にリストから外し、実際には1,259種類の化合物についてスクリーニングを行った。 - 13.ドッキングシミュレーション
薬剤などの分子がタンパク質のどの部位に結合するかをシミュレーションで予測する手法。コンピューター上でタンパク質のさまざまな部位に薬剤を結合させ、エネルギーなどの指標を用いてどの部位が結合しやすいかを評価する。 - 14.X線結晶構造解析
タンパク質などの分子の結晶を作製し、照射したX線の散乱パターンを解析することで分子の立体構造を決定する手法。本研究のX線結晶構造解析は理化学研究所のSPring-8を用いて行われた。 - 15.Q10値
温度を10℃上げたときの、反応速度比率を示す。例えば、温度補償されたリン酸化反応は、10℃上げたとしてもほとんど反応速度は変わらないため、Q10が0.8~1.4となる。一般的な酵素反応は温度に依存するため、Q10=2~3を示す。 - 16.胚性幹細胞(ES細胞)
脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。ES細胞は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。 - 17.分子動力学シミュレーション
ニュートンの運動方程式などをコンピューター上で解くことにより、分子の動きの時間変化を予測する手法。本研究の分子動力学シミュレーションは、理化学研究所のスーパーコンピュータ(RICC)を用いて行われた。
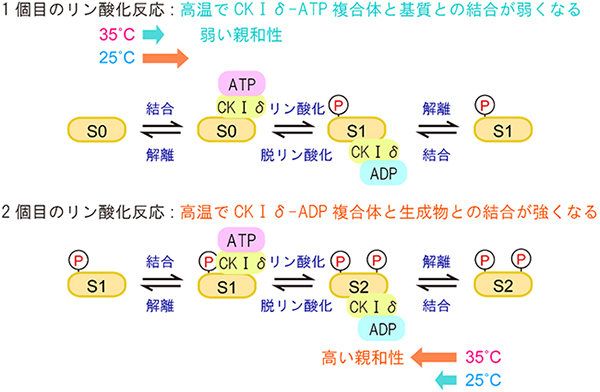
図1 カゼインキナーゼⅠδ(CKⅠδ)による温度補償されたリン酸化反応機構
一般的な酵素反応は、各過程が温度に強く依存し、高温で反応速度が上昇する。
上)1個目のリン酸化の温度補償性には、CKⅠδ-ATP複合体と基質(S0)との結合が温度に依存して高温(35℃)で弱くなることが重要である。
下) 2個目のリン酸化(特にリン酸基が1個付加した生成物の量が多い場合)の温度補償性には、CKⅠδ-ADP複合体とリン酸基が2個付加された生成物(S2)との結合が高温(35℃)で強くなることが重要である。
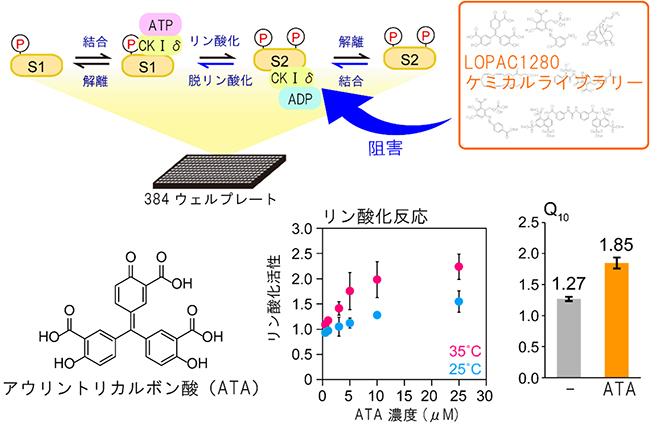
図2 生成物結合を阻害する低分子化合物のケミカルスクリーニング
上段:温度依存的な生成物結合を特異的に阻害する化合物の探索方法。これにより、アウリントリカルボン酸(ATA)を発見した。
下段:左は、ATA構造式。中央は、ペプチドの2個目のリン酸化反応中にATAを加えたときのグラフ。ATAを加えると、低温(25℃)よりも高温(35℃)でリン酸化活性が上昇している。右は、温度を10℃挙げたときの反応速度比を表すQ10値のグラフ。Q10値が0.8~1.4の場合、温度補償性があるとされる。ATAを加えた場合、Q10値が上昇しており、中央のグラフの結果と合わせて考えると、ATAを加えることで、リン酸化反応に温度依存性を持たせることができたことが分かる。
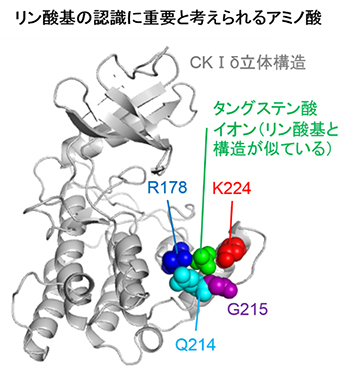
図3 タングステン酸イオンと結合したCKⅠδの立体構造
リン酸基(H2PO4-)と構造が似ているタングステン酸イオン(WO42-)と相互作用しているアミノ酸が四つ存在する。それらは、178番目のアミノ酸であるアルギニン(R178)、214番目のアミノ酸であるグルタミン(Q214)、215番目のアミノ酸であるグリシン(G215)、224番目のアミノ酸であるリジン(K224)である。
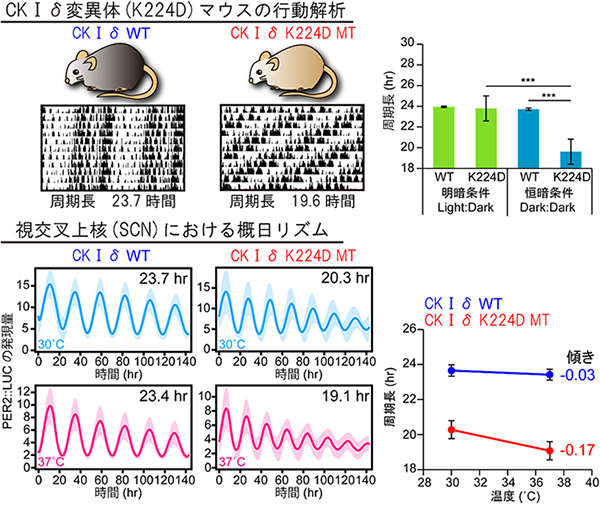
図4 CKⅠδのK224D変異体マウスの表現型
染色体のROSA26遺伝子領域にCKⅠδの野生型(WT)と変異型(K224D)をノックインして、ES細胞由来の遺伝子改変マウスを作製した。K224D変異マウスでは概日リズムが短くなり、視交叉上核(SCN)において高温(37℃)条件でも温度依存性が見られたことから、温度依存的な生成物結合は温度補償性の保持に必要であるといえる。
上段)ロコモーターアクティビティによる行動解析で、マウスの概日リズムを測定した(左図)。野生型マウスの周期長は23.7時間だったのに対し、K224D変異マウスは19.6時間と短くなった。野生型マウスとK224D変異マウスの周期長の差は恒暗条件で認められた(右図)。
下段)野生型とのK224D変異マウスのSCNをそれぞれ摘出して30℃と37℃の培養環境下で概日リズムを測定すると、K224D変異マウスの方が高い温度依存性がみられた。

図5 CKⅠδ-ADP複合体の構造ゆらぎ
左・中)CKⅠδ-ADP複合体の25℃(左)と35℃(中)での分子動力学シミュレーションによる構造の変化(ゆらぎ)。構造の色はゆらぎの大きさを表す(RMSF:root mean square fluctuation、データのゆらぎの大きさを表す数値)。
右)本研究でのX線結晶構造解析により決定されたCKⅠδ-ADP複合体の立体構造とその構造ゆらぎ。構造の色はゆらぎの大きさを表す(B-factor:X線結晶構造解析で得られる構造ゆらぎの大きさを表す数値)。B-factorの単位(Å2)はRMSFの単位(オングストローム、Å、1Åは100億分の1m)の2乗になっている。
分子動力学シミュレーションとX線結晶構造解析のどちらも、CKⅠファミリーに固有の領域で色が黄色~赤色となっており、この領域周辺のゆらぎが大きくなっていることが分かる。
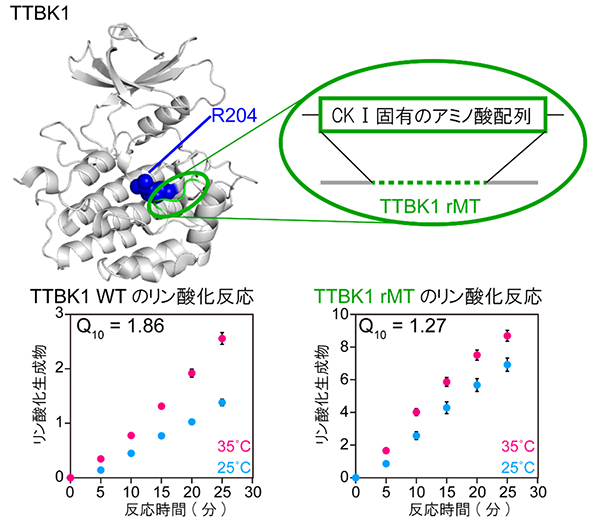
図6 温度に依存しないリン酸化反応の再構成
上)CKⅠδとTTBK1のタンパク質構造を比較すると、TTBK1には欠損領域が存在している。その領域にCKⅠファミリー固有のアミノ酸配列の挿入をし、TTBK1(rMT)を作製した。CKⅠδのR178部位はTTBK1にもR204(青)として保存されている。
下)Q10値が0.8~1.4の場合、温度補償性があるとされる。左側のTTBK1 WT(野生型)のリン酸化反応は温度に依存している(Q10=1.86)が、CKⅠ固有のアミノ酸配列を挿入したTTBK1 rMTのリン酸化反応では温度補償性がみられた(Q10=1.27)。
