要旨
理化学研究所(理研)生命システム研究センター合成生物学研究グループの上田泰己グループディレクター(東京大学大学院医学系研究科教授)、鵜飼英樹上級研究員、ライフサイエンス技術基盤研究センター生体モデル開発ユニットの清成寛ユニットリーダーの共同研究チームは、これまで1~2年をかけて作製していた「ノックインマウス」を、2~3カ月かつ同時進行(並列)で多種類作製する方法を確立しました。
外来遺伝子[1]が体の全細胞の染色体DNAの任意の位置に挿入されたマウス(ノックインマウス)を作製し、その挿入遺伝子の影響を解析する技術は、生物個体で観察される生命現象を研究する上で欠かせません。個体レベルでの生命現象には多数の遺伝子が関与しているため、多種類のノックインマウスを作製する必要があります。しかし通常、ノックインマウスの作製には非常に煩雑な操作が必要なため、1~2年かかります。また、多種類のノックインマウスを並列に作製することは困難でした。
そこで、共同研究チームはまず、ノックインマウスの作製に必要なノックインES細胞[2]の作製手法を簡便化・高効率化することで、多種類のノックインES細胞を並列に短期間(約1カ月)で作製する技術を確立しました。次に、2010年に清成ユニットリーダーらが開発した、体の全細胞がES細胞に由来するマウス(ESマウス[3])を、キメラマウス[4]の交配を介さずに直接作製する技術注1)と組み合わせることで、ノックインESマウスを並列・短期間(2~3カ月)で作製する技術体系を確立しました。そして、この“次世代型マウス遺伝学”技術を誰もが実践できるように、操作上の注意点などを詳細に記したプロトコル[5]にまとめ、報告・公開しました。
本成果のノックインES細胞およびノックインESマウス作製技術は、マウスを用いた基礎生物学的研究だけでなく、ヒトiPS細胞[2]などを用いた疾患研究、ヒト疾患モデル臓器や疾患モデルマウスの作製にも応用できることから、医学・医薬品開発の研究においても重要な基盤技術といえます。今後、国内外の研究者が本技術を利用することにより、多くの医学・生物学研究が大きく加速するものと期待できます。
本研究は、英国の科学雑誌『Nature Protocols』オンライン版(11月16日付け:日本時間11月17日)に掲載されます。
本研究は、国立研究開発法人日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)の研究開発領域「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」における研究開発課題「睡眠・覚醒リズムをモデルとした生体の一日の動的恒常性の解明」(研究開発代表者:上田泰己)の一環で行われました。なお、本研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、科学技術振興機構(JST)より移管されています。
注1)Kiyonari et al.,.“Three inhibitors of FGF receptor, ERK, and GSK3 establishes germline-competent embryonic stem cells of C57BL/6N mouse strain with high efficiency and stability” Genesis, 48, 317-327,2010
背景
ある現象に関わっていると予想される、さまざまな遺伝子の変異体(変異遺伝子)などの外来遺伝子が、体の全細胞の染色体DNAの任意の位置に挿入されたマウスを「ノックインマウス」と呼びます。ノックインマウスを作製し、その表現型を解析する技術は、疾患などの生命現象を研究する上で欠かせません。
通常、ノックインマウスの作製には、①外来遺伝子が染色体DNAの任意の位置に挿入されたES細胞(ノックインES細胞)を作製する、②そのノックインES細胞から体の一部の細胞がノックインES細胞に由来するマウス(キメラマウス)を作製する、③キメラマウスを5~6回以上交配することで体の全細胞がノックインES細胞に由来するノックインマウスを作製する、三つのステップからなります(図1)。
研究に用いるための充分な質と量の個体を得るには5~6回以上の交配が必要なため、三つのステップを経てノックインマウスを作製するには1~2年かかります。さらに、ノックインES細胞を作製する操作も非常に煩雑で、かつ外来遺伝子が染色体DNAの狙った部位に正確に挿入される確率も低いため、複数種類のノックインマウスを同時進行(並列)で作製することは困難です。
個体で観察される生命現象(例えば睡眠リズムや、概日リズム[6]、疾患など)に関わる遺伝子は、一つの生命現象につき十数種類以上あります。そのうちの一つの遺伝子の機能や仕組みを理解するためだけでも、変異遺伝子を導入したノックインマウスを多種類作製する必要があります。このような背景から、ノックインマウスを短期間に並列で作製し解析するという“次世代型マウス遺伝学”技術の確立が必要でした。
英国ケンブリッジ大学のオースティン・スミスらの研究グループは、2008年にES細胞の多能性[2]の維持に効果を持つ特殊な培養液(3i培地[7])を開発しました。清成ユニットリーダーらは2010年に、3i培地で培養したES細胞を8細胞期胚[8]に導入しマウスの子宮に移植することで、体の全細胞が導入したES細胞に由来するESマウスが効率よく産まれることを見いだしました(図2)。
そこでこのESマウスを、ノックインES細胞を用いて作製した場合、そのESマウスは体の全細胞がノックインES細胞に由来することが期待されます。この場合、その後の交配は必要ないため、従来の手順に比べて、より短期間で目的のノックインマウスを得られると考えられます。そこで共同研究チームは、多能性を維持したノックインES細胞を短期間で並列に作製するための要素技術を開発し、それらをESマウス作製方法と組み合わせることにより、多種類のノックインESマウスを短期間で並列に作製する“次世代型マウス遺伝学”技術の確立を試みました。
研究手法と成果
1)高効率で簡単なES細胞へのノックイン方法の開発
多種類のノックインES細胞を並列に作製するためには、操作が簡単で、任意の染色体DNA部位のみに高効率で正しく遺伝子を挿入できる方法が必要です。正しく遺伝子を挿入できる確率が高ければ、たくさんの細胞の中から正しく挿入された「当たり」の細胞を選ぶ手間や、当たるまでに繰り返さなければならない実験回数が減ります。従来の遺伝子挿入方法では、任意の染色体DNA部位に目的の遺伝子が正しく挿入される確率は数%から高くても30%程度でした。しかし、近年開発が進んでいるゲノム編集[9]技術を用いることで、挿入確率が50%程度まで改善されることが報告されています注2)。
ゲノム編集技術では、染色体DNAに挿入したい遺伝子を担うプラスミドDNA[10](ドナーベクター)と、染色体DNAを切断するための酵素を発現するプラスミドDNAをES細胞内に導入する必要があります。これらのプラスミドDNAの細胞内への導入効率が、染色体DNAへの遺伝子挿入の効率化に重要です。
そこでさまざまな条件検討を行った結果、DNA導入効率の改善に成功しました。細胞への導入効率が高いと必要な細胞数や試薬量が減り、従来法の1/50量のDNAを用いるだけで安定にDNA導入細胞が得られるようになりました(図3)。使用するDNAや試薬の量が減ると操作が簡単になり、並列的に操作できるようになりました。また並列に多種類の実験を行っても総合的なコストが安くなります。さらにいくつかの改良を加えることにより、任意の染色体DNA部位に目的の遺伝子が正しく挿入される確率が90~100%にまで改善されました。少しの細胞を調べるだけで当たりの細胞を得られるため実験効率があがり、少ない労力でより並列に多種類の実験を行うことができるようになりました。
2)細胞クローニング[11]の自動化
ノックイン操作により遺伝子が目的の染色体DNA部位に正しく挿入されたことを確認するためには、1細胞に由来し形成されたES細胞コロニー[12]を顕微鏡下で一つずつ手作業で分離・回収することでクローン化し、各クローンの遺伝子型を判定します。このクローニングと呼ばれる分取作業は非常に煩雑なため、多種類のノックインES細胞を並列に扱うことは困難でした。そこで、この作業を機械により自動化するための手法の開発に取り組みました。
ES細胞を培養すると、ES細胞は培養皿の底面に接着してコロニーを形成します。共同研究チームは、まずコロニーを培養液中に浮遊させました。この浮遊コロニーを含む培養液を回収し、セルソーター[13]を用いて多数のコロニーを自動的に培養ウエルに単離することに成功しました(図4)。煩雑な操作を自動化することにより、多種類のノックインES細胞の短時間クローニングが可能となりました。
3)フィーダー細胞[14]を用いない簡便なESマウス作製用高品質培養方法の確立
従来のESマウス作製に用いるES細胞は、フィーダー細胞を接着させた培養皿上で3i培地を用いて培養されてきました。しかし、多種類のノックインES細胞を培養する場合、多くのフィーダー細胞の準備は煩雑です。そこで、さまざまな培養条件を検討し、タイプBゼラチン[15]塗布培養皿あるいはBIO (6-bromoindirubin-3-oxime)[16]を含む培養液を塗布したアミン表面処理培養皿上で3i培養液を用いて培養することにより、ES細胞の多能性を維持したまま培養できることを発見しました(図5)。
この手法を用いることにより、培養皿の準備が簡便になるとともに、ES細胞を8細胞期胚へ導入する際にフィーダー細胞が混入する可能性も排除されました。
4)次世代型マウス遺伝学技術の確立
これらの要素技術を用いて実際にノックインES細胞を並列作製し、さらにそのノックインES細胞からノックインESマウスを交配なしで作製することによって、最短2カ月(新生児マウスの場合)でノックインESマウスを並列作製できることを示しました(図6)。
注2)Sakuma, T., Nakade, S., Sakane, Y., Suzuki, K. T. & Yamamoto, T. “MMEJ-assisted gene knock-in using TALENs and CRISPR-Cas9 with the PITCh systems.” Nat Protoc 11, 118-133,2016
今後の期待
本成果が提供する次世代型マウス遺伝学技術を用いることで、これまで1~2年かけて作製していたノックインマウスを2~3カ月で作製できるようになります。この手法に含まれるノックインES細胞作製およびESマウス作製技術は、マウスを用いた基礎生物学的研究だけでなく、ヒトiPS細胞などを用いた疾患研究や、医薬品の開発に重要な役割を果たすヒト疾患モデル臓器や疾患モデルマウスの作製にも応用できます。したがって、医学・医薬品開発の研究においても重要な基盤技術といえます。
今回の論文では、この方法を誰もが実践できるように、操作上の注意点などを詳細に記したプロトコルにまとめ、報告・公開しました。今後、国内外の研究者が本技術を利用することで、多くの医学・生物学研究が大きく加速するものと期待できます。
原論文情報
- Hideki Ukai, Hiroshi Kiyonari, Hiroki R. Ueda, "Production of knock-in mice in a single generation from embryonic stem cells", Nature Protocols, doi: 10.1038/nprot.2017.110
発表者
理化学研究所
生命システム研究センター 細胞デザインコア 合成生物学研究グループ
グループディレクター 上田 泰己(うえだ ひろき)
(東京大学 大学院医学系研究科機能生物学専攻 教授)
上級研究員 鵜飼 英樹(うかい ひでき)
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 生命動態情報研究グループ 生体モデル開発ユニット
ユニットリーダー 清成 寛(きよなり ひろし)
 上田 泰己
上田 泰己
 鵜飼 英樹
鵜飼 英樹
 清成 寛
清成 寛
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
東京大学 大学院医学系研究科 総務係
Tel: 03-5841-3304 / Fax: 03-5841-8585
ishomu [at] m.u-tokyo.ac.jp(※[at]は@に置き換えてください。)
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
Tel: 03-6870-2224 / Fax: 03-6870-2243
kenkyuk-ask [at] amed.go.jp(※[at]は@に置き換えてください。)
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.外来遺伝子
細胞に導入された、細胞がもともと持っていない遺伝子。化学的・電気的手法やウイルスなどを用いて人為的に細胞に導入することができる。 - 2.ES細胞、iPS細胞、多能性
ES細胞(胚性幹細胞)は、着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。多能性幹細胞は、多能性(体を構成するほぼ全ての種類の細胞に分化する能力)を持ち、試験管内で培養して無限に増やすことができる。iPS細胞(人工多能性幹細胞)は、成人の皮膚細胞などの体細胞や組織から採取した細胞に Oct3、 Sox2、 Klf4遺伝子などを導入して初期化し多能性を持たせ、人工的に作製した多能性幹細胞。 - 3.ESマウス
体のほぼ全ての細胞が初期胚に移植したES細胞から派生したマウス。理研ライフサイエンス技術基盤研究センター生体モデル開発ユニットの清成寛ユニットリーダーらは、3i培地条件下で培養し多能性を高いレベルで維持させたES細胞を発生初期の8細胞期胚に移植するとESマウスが高効率に産まれることを発見した。 - 4.キメラマウス
二つの異なる遺伝子セットを持つマウス。白い毛色のマウスの初期胚に黒い毛色のマウスから作製したES細胞を導入すると、通常白黒のマーブル模様のような毛色のキメラマウスが産まれる。白い部分は初期胚と同じ遺伝子セットを持っており、黒い部分はES細胞由来の遺伝子セットを持っている。全身が黒いマウス(全ての細胞がES細胞と同じ遺伝子セットを持つマウス)を得るためには、交配を繰り返す必要がある。 - 5.プロトコル
ある特定の実験を確実に実行するための手順書。例えば、試薬を混ぜる分量や順番などが詳細に記されている。 - 6.概日リズム
体内時計ともいう。外界の光や温度の周期的変化を排除した状態においても生物に観察される生理現象や行動の約24時間周期の変動リズム。 - 7.3i培地
3種類の異なる分化誘導シグナルの阻害剤を含んだ培地。高い多能性を維持しながら増殖させることが可能。 - 8.8細胞期胚
8個の細胞からなる初期胚。受精卵は1細胞から2細胞期、4細胞期を経て8細胞期胚、桑実胚、胚盤胞へと発生する。従来キメラマウスの作製に用いられていた胚盤胞よりも早い発生段階の胚。 - 9.ゲノム編集
細胞内の染色体DNAに遺伝子を挿入したり、逆に欠損させたりする技術。細胞は傷ついたDNAを修復する手段として相同組換え修復経路を持っている。これを利用すると高い効率で遺伝子を挿入することができる。染色体DNAの任意の場所を切断可能なTALENやCas9といった人工酵素が設計可能となり、急速に発展した。 - 10.プラスミドDNA
宿主であるバクテリアのゲノムDNAとは物理的に独立して自律複製し、安定に存在できる遺伝因子。ベクター(運び屋)として利用される。 - 11.クローニング
同じ遺伝子型をもつ集団を作製すること。ノックインされた細胞集団の中には、複数の遺伝子が挿入されている細胞などが混在している可能性があり、同じ遺伝子型を持つ細胞集団であるとは限らない。そこで1細胞ごと(あるいは1細胞に由来した集団)に分離する。 - 12.ES細胞コロニー
ES細胞集団の塊。ES細胞が細胞分裂して増殖する際、分裂した細胞同士は離れることなく増殖と共に球形の細胞塊を形成する。一細胞由来のコロニーの場合、そこに含まれる細胞集団の遺伝子セットは均一であるため、このコロニーを分離回収することで細胞のクローニングが可能となる。 - 13.セルソーター
細胞分離装置の一つ。細胞集団の中から任意の特徴(大きさ、形態、細胞内成分など)を持つ細胞を自動的に分離する装置。細胞の分離には超音波や高電荷、低水圧送液などさまざまな方法が用いられる。それぞれに特性があるので目的に合わせた選択が必要。今回の成果では、細胞へのダメージが少ない低水圧送液タイプを用いることが有効であった。 - 14.フィーダー細胞
目的の細胞の培養条件を整えるために補助的に用いられる他の細胞種。ES細胞の培養には、マウス胎児由来の繊維芽細胞を用いることが多い。必ずしも生きている細胞である必要はなく、通常は増殖しないようにあらかじめガンマ線照射や抗生物質によって処理して用いる。 - 15.ゼラチン
動物の皮膚などの主成分であるコラーゲンに熱を加えて抽出したもの。細胞を培養皿に接着させるための足場としてよく利用される。熱抽出の前処理の方法により等電点の異なるタイプA、タイプBが製造される。通常の細胞培養にはタイプAが使用されるが、今回の成果ではタイプBが有効であった。 - 16.BIO (6-bromoindirubin-3-oxime)
GSK-3阻害剤の一つ。本成果では、アミン処理培養皿の表面にBIOを塗布することで、フィーダー細胞がない条件下でもES細胞の多能性を高く保ったまま培養することに成功した。

図1 従来のノックインマウスの作製方法
ノックインマウス作製には、①ES細胞に任意の遺伝子をノックインしたノックインES細胞を作製する、②体の一部の細胞がノックインES細胞由来であるキメラマウスを作製する、③キメラマウスを交配する、三つのステップがある。この方法により最終的に体の全細胞に遺伝子がノックインされたノックインマウスが作製される。
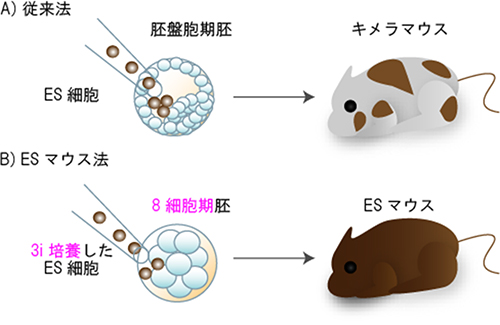
図2 キメラマウス作製法(従来法)とESマウス作製法
A:従来のES細胞培養用の培養液で培養したES細胞を胚盤胞期胚に導入すると、体の一部の細胞がES細胞に由来するキメラマウスが産まれる。
B:3i培養液を用いて培養したES細胞を、胚盤胞より初期の胚である8細胞期胚に導入すると、体の全細胞が導入したES細胞に由来するESマウスが通常90%~100%という高確率で産まれる。
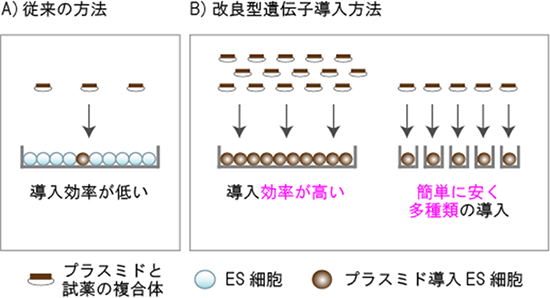
図3 従来型と改良型のES細胞への遺伝子導入方法
A:遺伝子を細胞に導入するには、プラスミドDNAと導入用試薬で複合体を形成させ、細胞培養液に添加する。従来法では導入効率が低かった。
B:方法を改良することで導入効率が高くなった。使用する細胞数、試薬、DNAの量が減り、簡単に安く多種類の導入が可能になった。
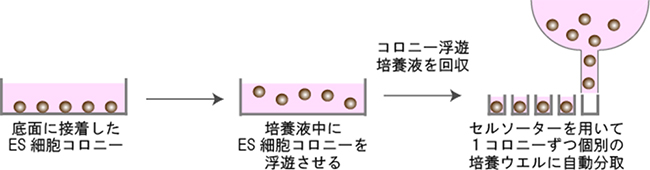
図4 ES細胞コロニー単離の自動化手法
1細胞ごとに分散したES細胞を培養皿上で培養すると、ES細胞は底面に接着してそれぞれが1細胞に由来するコロニーを形成する。ES細胞コロニーを培養液中に浮遊させ、培養液を回収し、セルソーターに仕掛ける。セルソーターは各コロニーを検出して、コロニーを一つずつ小さな培養ウエルに分配する。

図5 培養皿の表面処理の違いによるキメラマウス作製効率の差
A:特殊表面処理無しの通常細胞培養用培養皿で培養したES細胞を用いて作製したマウス。ESマウス(黒)が産まれる確率は非常に低く、ほとんどがキメラマウス(白または斑)になってしまう。
B:BIOを含む培養液を塗布したアミン表面処理培養皿で培養したES細胞を用いて作製したマウス。高確率でESマウスが産まれる。
C:タイプBゼラチンを塗布した培養皿で培養したES細胞を用いて作製したマウス。高確率でESマウスが産まれる。
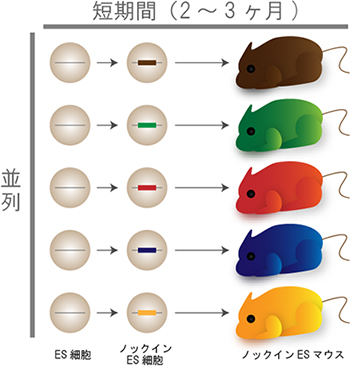
図6 交配を用いない次世代型マウス遺伝学技術
ES細胞におけるゲノム編集技術を簡便化・高効率化することでノックインES細胞を短期間で並列的に作製するとともに、交配を経ずに短期間でノックインESマウスを作製する。
